甘蓝型油菜叶绿素含量的主基因+多基因遗传分析
李远红,余坤江,何雨琦,王晓东
(1.贵州大学农学院,贵州贵阳 550025; 2.江苏省农业科学院经济作物研究所,江苏南京 210014)
油菜是我国食用植物油的第一大来源,同时兼具观、菜、蜜、饲、肥等[1]多维度利用价值。2020年,我国油菜种植面积、油菜籽产量已达3 610.7万hm2、7 179.6万t,在我国食用油市场中具有举足轻重的地位[2-3]。近年来,利用杂种优势来大幅度提高油菜产量难度较大,高光效育种受到越来越多研究者的重视[4]。叶片是植物进行光合作用的主要器官,决定植物体内干物质的积累。叶绿素在绿色植物进行光合作用时起到至关重要的作用,植物吸收太阳辐射后体内会激发反应中心色素从而启动光化学反应,为生物圈提供动力。叶绿素含量的高低直接影响植物光合潜力和初级生产[5],对油菜籽粒的产量也具有显著影响[6-7]。因此,解析油菜叶绿素含量的遗传机制对于推进我国的油菜高光效育种具有重要的理论及实践意义。
关于油菜叶绿素含量的研究报道较多,国内外学者已对其性状的遗传做了相关研究。Zhao等分离出油菜黄绿叶(yvl)突变体,通过BSA-seq定位在BnaA03,全基因组测序发现CHLH在突变体中碱基替换,导致CHLH活性降低,从而影响叶绿体发育和叶绿素的合成[8]。Ye等构建了近等基因系 (NIL),对叶绿素基因座进行了精细定位,研究发现cqSPDA2是欧洲油菜叶绿素含量的一个显性QTL,在A02上被精细定位到 21.89~22.04 Mb 区间[9]。郎丽娜在研究油菜在盐胁迫中的QTL时,在LG5发现与叶绿素相关基因座qSPAD5[10]。代文东等利用紫红叶油菜和绿叶油菜通过DarT-seq技术对BC1群体单株进行基因分型并构建连锁遗传图谱,共检测出8个叶绿素含量QTL,分别位于A0l、A03、A06、A07、C01、C03和C04连锁群上[11]。此外,有学者利用构建的分子遗传连锁图谱,定位了油菜种胚[12]、角果皮[13]部位叶绿素含量性状相关的QTL。这些研究均根据田间各遗传群体测量叶绿素含量来进行遗传分析,而通过数量性状遗传分离分析方法进行深入系统研究的报道较少。植物主基因+多基因混合模型是盖钧镒等提出来解决数量性状遗传的分析方法[14],并在多种作物中已普遍运用。虽已有研究对油菜叶绿素进行QTL定位,但叶绿素合成和调控机制仍较复杂。彭门路等以有、无突变体(yl1)杂交的6个世代(P1、P2、F1、F2、B1、B2)为材料,利用主基因+多基因混合遗传模型对突变性状进行遗传分析,结果表明甘蓝型油菜叶绿素缺失性状受1对加性-显性主基因控制,yl1叶绿素缺失为不完全显性遗传[15]。笔者旨在应用该分析方法研究甘蓝型油菜叶片叶绿素含量,解析其遗传变异规律,为相关性状的分子标记开发和高光效育种改良奠定基础。
1 材料与方法
1.1 试验材料
本研究以甘蓝型油菜高叶绿素含量品系APL01、低叶绿素含量品系Holly及2个品系杂交后衍生的198个重组自交家系群体(AH群体目前已发展到F2:13代)为材料,种植于贵州省贵阳市贵州大学教学试验场(26°N、106°E、海拔为1 100.55 m、土壤为黄壤)。采用随机区组试验设计,每个品系种植4行,行距40 cm,株距20 cm,每行15株。试验地肥力均匀一致,田间管理参照当地大田栽培管理措施。所有试验材料均由江苏省农业科学院经济作物研究所提供。
1.2 叶绿素含量的测定
在2019、2020、2021年3个年份环境下,使用叶绿素计(型号:SPAD-502;品牌:柯尼卡美能达;产地:日本)测定APL01和Holly以及AH群体各品系9张叶片期叶片的叶绿素相对含量(SPAD值),每个品系测量3株,每株测量3张叶(由上至下第3、4、5张叶),每张叶测量3个点,取其平均值,测量时避开主叶脉。2019、2020、2021年3个年份环境分别用19GY、20GY、21GY表示。
1.3 统计分析
对2019—2020年3个年份环境的甘蓝型油菜叶片叶绿素含量,利用Excel、SPSS 21.0软件[16]进行数据统计及群体变异分析。利用植物主基因+多基因混合遗传模型,结合SEA-G3DH软件对亲本和AH群体3个年份环境的SPAD值进行遗传分析[17]。遗传模型的选择首先根据AIC值(Akaike’s information criterion)最小原则确定3~4个候选模型,然后对候选模型进行适合性检验,以确定最适模型,最后计算最适模型下的遗传参数。分析软件由南京农业大学章元明教授提供。
2 结果与分析
2.1 叶绿素含量的变异分析
由表1可知,在3个不同年份环境下种植的AH群体叶绿素含量的变异系数大小顺序依次为21GY>19GY>20GY,说明第3个年份环境测量叶绿素含量时其变异丰度最大,而3个年份环境间群体叶绿素含量存在变异,表明该性状受环境影响。从平均值上看,19GY,21GY的平均叶绿素含量较接近,差值仅达2.16,20GY的均值较高于19GY和21GY,20GY与19GY的差值为7.32,20GY与21GY的差值为5.16。21GY的变异系数是3个环境中最高,可见在3个年份环境下所测得的叶绿素含量,第3个环境影响最大,其次是第1个环境,最后是第2个环境。
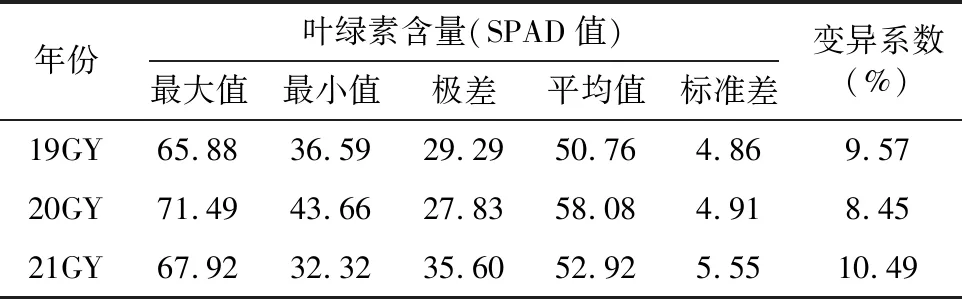
表1 在3个年份环境下AH群体的叶绿素含量变异情况
2.2 叶绿素含量分布特征分析
从图1可以看出,在3个年份环境下的叶绿素含量在43~66的区间呈连续的分布,表现为典型的数量性状特征。19GY、21GY的叶绿素含量主要都集中在40~60的区间范围内,而在0~40和60以上的分布频数较低。20GY的叶绿素含量主要集中在50~65的区间范围内。其群体叶绿素含量分布呈现为正态分布,表明该群体中叶绿素含量的遗传符合主基因+多基因遗传特征。

2.3 叶绿素含量遗传模型分析
2.3.1 遗传模型的选择 采用是植物数量性状主基因+多基因混合遗传模型对亲本及AH群体的叶绿素含量性状进行遗传分析,估算获得了0对主基因(0MG模型)、1对主基因(1MG模型)、2对主基因(2MG模型)、多基因(PG模型)、1对主基因+多基因(MX1模型)、2对主基因+多基因(MX2模型)、3对主基因(3MG模型)、3对主基因+多基因(MX3模型)、4对主基因(4MG模型)等9类共39种遗传模型的极大似然函数值和AIC值(表2)。根据Akaike准则,选取AIC值最小及与最小AIC值比较接近的遗传模型作为候选模型,每个环境确定4个候选模型。用2019年叶绿素含量数据获得19GY的候选模型为3MG-A、3MG-CEA、MX3-AI-AI、4MG-AI,用2020年叶绿素含量数据获得20GY的候选模型为3MG-A、3MG-CEA、MX3-AI-AI、MX3-AI-A;21GY获得候选模型为MX3-AI-AI、MX3-AI-A、MX3-A-A、4MG-A。

表2 叶绿素含量各遗传模型的AIC值

从上述结果来看,其中2个年份环境(20GY、21GY)的最适模型皆为MX3-AI-AI,而19GY年份环境下所检验出的最适模型为4MG-AI,而3个年份环境下2个候选模型的AIC值(MX3-AI-AI为1 248.57,4MG-AI为1239.92)较接近,造成这个分析结果的原因可能是因为19GY的环境差异较大,叶片的叶绿素含量所受环境的影响也相对加强,结合3个环境结果,推测出AH群体叶绿素的最适模型为MX3-AI-AI。
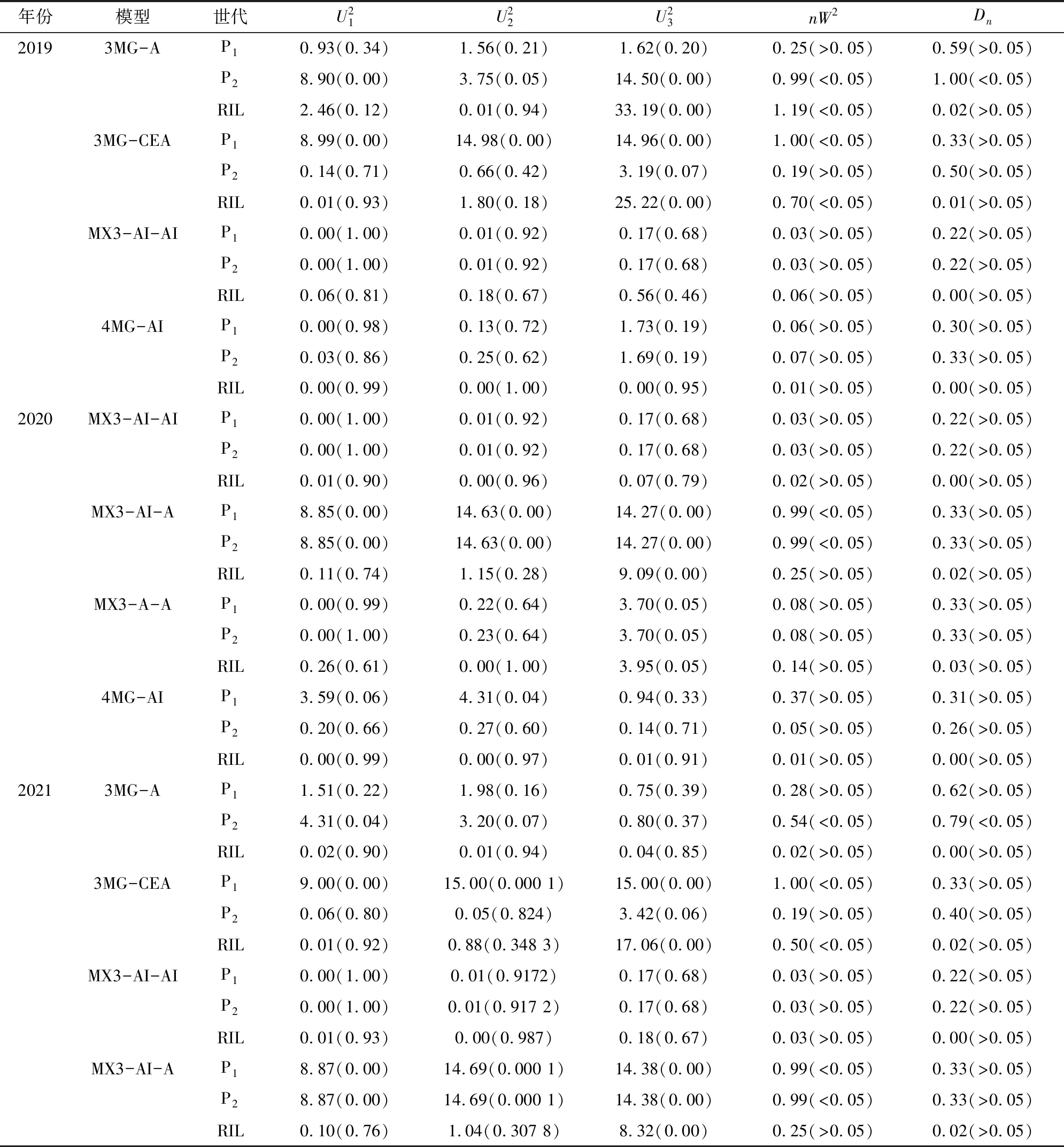
表3 AH群体的模型适合性检验
2.3.3 最适模型下遗传参数的估计 分别计算油莱AH群体在3个年份环境下叶片叶绿素含量在最适遗传模型下的各遗传参数,结果(表4)表明,在19GY环境下,群体叶绿素含量的3对主基因的加性效应均表现为负向遗传效应,效应大小顺序为da>dc>db;主基因上位性效应分别为-6.35、-6.35、-6.34、-6.34;主基因遗传率为63.22%;多基因遗传率为35.7%。 20GY环境下的群体叶绿素含量3对主基因的加性效应均表现为负向遗传效应,加性效应大小顺序为da>dc>db;主基因上位性效应分别为-6.60、-6.61、-6.60、-6.60;主基因遗传率为73.09%;多基因遗传率为26.32%。21GY环境下的群体叶绿素的3对主基因的加性效应均表现为负向遗传效应,加性效应大小顺序为da>dc>db;主基因上位性效应分别为-7.24、-7.25、-7.24、-7.24;在19GY、20GY中,主基因加性效应和主基因上位性效应值都是负值,说明2个效应都能使叶绿素含量降低。在21GY中,主基因加性效应值都为负值,主基因上位性效应为正值,说明主基因加性效应使叶绿素含量降低,则主基因上位性效应提高叶绿素含量。综上所述,AH群体叶绿素含量受主基因加性和上位性效应调控,同时,存在明显的多基因加性效应影响。
连续2年3个环境的数据中,主基因遗传率为63.22%~73.33%,多基因遗传率在25.94%~35.7%,主基因遗传率平均值69.88%,显著大于多基因遗传率,可见叶片叶绿素含量的遗传体系中,主基因的贡献率占主要部分。此外,AH群体叶绿素含量在3个环境方差都为0.66左右,说明叶绿素含量易受环境影响。
3 讨论与结论
3.1 油菜叶片叶绿素含量变异丰富
自20世纪70年代以来,许多国家将遗传改良的重点放到了提高作物光合效率上,并且明确指出提高光效是作物育种的重要内容[18]。本研究利用APL01、Holly品系及2个品系杂交后衍生的198个重组自交家系群体,叶绿素含量在2019、2020、2021年的变异系数分别为9.57%、8.45%、10.49%,叶绿素含量(SPAD值)为50.76、58.08、52.92。从结果分析来看,荐红举等对连续2年588份甘蓝型油菜品种的叶绿素分析后发现,在不同年份中叶绿素含量变化较小,变异系数分别为11.27%、12.73%[19]。有研究对紫红叶和绿叶油菜品系构建遗传分离群体的叶绿素含量分析,叶绿素含量的变异系数为8.00%[11]。研究结果表明,油菜叶绿素含量变异系数较稳定,具有丰富的变异,本研究与前人研究结果相符。而造成叶绿素含量变异的原因,主要是受环境的影响[20-21]。
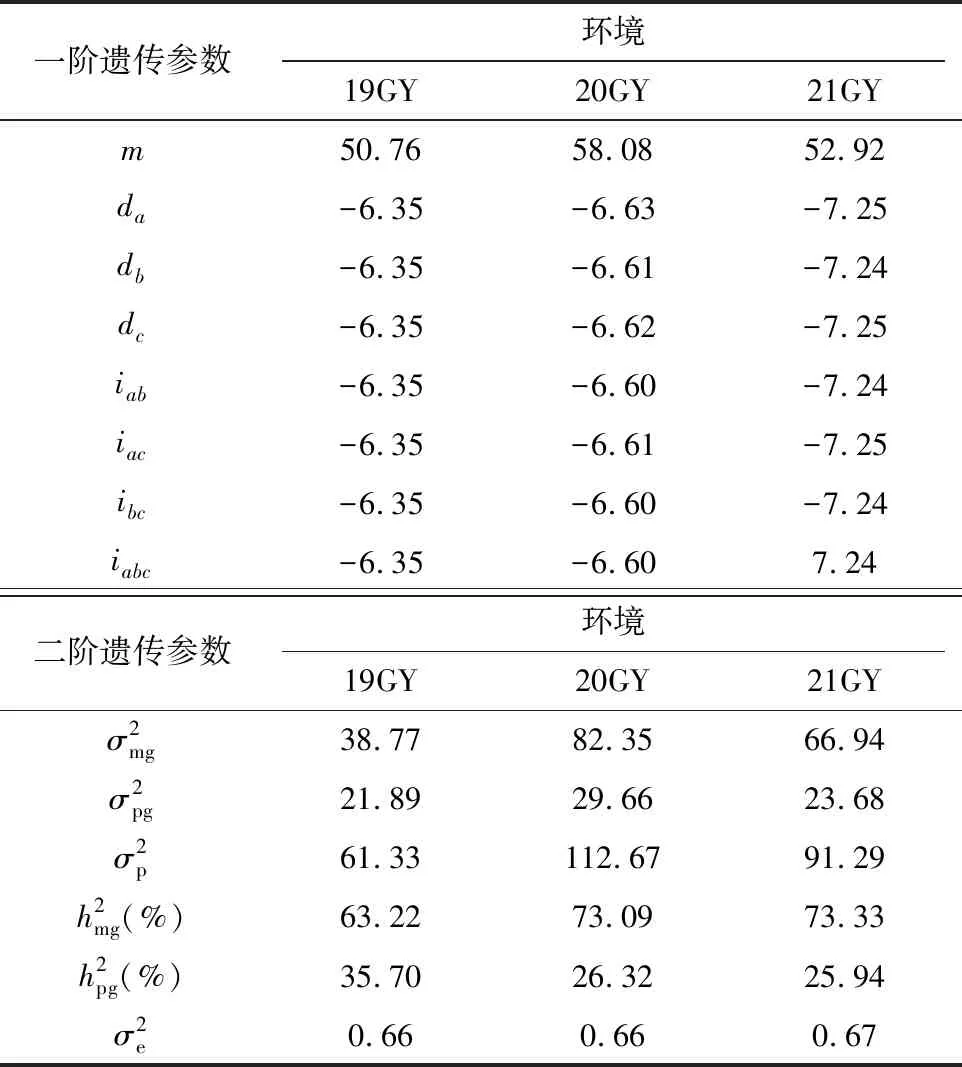
表4 AH群体叶绿素含量在MX3-AI-AI模型下遗传参数估计值
3.2 叶绿素含量受主基因+多基因共同控制
叶色调控在光合作用和干物质生产中具有重要作用,明确其遗传机制有利于后续育种实践。关于植物叶绿素或黄化性状的遗传,国内外已有较多研究,但针对甘蓝型油菜叶片叶绿素含量相关QTL或候选基因的研究相对较少。本研究采用植物主基因+多基因混合遗传模型,结合SEA-G3DH软件得出AH群体叶绿素含量最优遗传模型为MX3-AI-AI,即3对加性-上位性主基因+多基因加性-上位性混合遗传模型,与前人研究结果不尽相同。田颖等利用油菜黄化突变体L638-y与正常叶色材料2598杂交后代用于黄化基因标记,发现叶色由2对隐性核基因gr1、gr2调控[22-23]。相关研究认为,调控叶绿素含量受1对加性-显性主基因控制,不存在多基因效应的影响[14]。唐亮等研究了水稻群体叶绿素含量基因的遗传规律,发现叶绿素含量受2对主基因+多基因共同控制[24]。可见,叶绿素含量的遗传机制相对复杂。代文东等研究检测出8个叶绿素含量QTL,证实叶绿素含量同时也受加性效应的调控,加性效应在4.99~9.20[10]。本研究加性效应在6.35~7.25,与前人研究结果不同,为进一步挖掘相关QTL提供参考。造成这些异同点的原因,首先是试验材料的不同,揭示甘蓝型油菜叶绿素遗传机制的研究较少。其次,研究方法大都采用盖钧镒等编制的植物数量性状分离分析软件。本研究采用南京农业大学刘兵等研制的植物数量性状分离分析Windows软件包SEA,该软件具有友好的操作界面,能够计算出一阶遗传参数和部分二阶遗传参数,结果更易分析。叶绿素属数量性状,环境因素干扰大,大多研究群体较小,本研究扩大育种群体规模,更利于考察该性状。甘蓝型油菜叶绿素含量性状是由主基因控制和多基因共同控制,且主基因遗传率显著高于多基因遗传率。本研究明确了甘蓝型油菜主基因间作用方式为累加作用,并且得到了主基因加性效应、主基因上位性效应各效应值,这为深入研究甘蓝型油菜叶绿素含量性状的遗传机制提供了基础。研究结果表明,叶绿素含量的遗传力高,育种过程中在早期世代对叶绿素含量高的材料进行选择是有效的,在本试验中,后代存在叶绿素含量超过亲本的材料,说明可以采用杂交和回交方式转移主基因,获得超亲材料。

