PHF19 在肺腺癌中的表达及对免疫微环境的影响
谢军瑶,巩健男,韩晓瑾,李建强
(1.山西医科大学第二临床医学院,山西 太原 030001;2.山西医科大学第二医院呼吸与危重症医学科,山西 太原 030002)
肺癌是全球癌症死亡的主要原因之一[1]。其中,肺腺癌(lung adenocarcinoma,LUAD)是肺癌最常见的组织学类型,约占所有肺癌的50%。LUAD具有恶性程度高、早期缺乏典型的临床症状、早期易发生局部浸润和转移、预后较差等特点[2]。近几十年来,包括非侵入性手术切除、化疗、放疗和免疫治疗在内的多模式治疗策略已取得巨大进展,但LUAD 的治愈结果仍不令人满意,5 年的相对总生存率约为22%[3]。为了提高患者生存率,迫切需要确定预后标志物和有效的药物靶点。
多梳蛋白家族(polycomb group protein, PcG)是形成染色质修饰复合物的重要表观遗传调节因子,其组成与细胞环境相关。在哺乳动物中,已经发现了两种主要的多梳蛋白抑制复合物(polycomb repressive complex, PRC),即PRC1(组蛋白泛素连接酶)和PRC2(组蛋白甲基转移酶)。PRC 在表观遗传修饰的启动和维持中起重要作用,并参与癌症的发生和进展。PHD 锌指蛋白19(PHD finger protein 19, PHF19)包含一个Tudor 结构域,两个植物同源结构域和一个扩展同源结构域,是PRC2 中的重 要 成 员 之 一[4,5]。PHF19 可 通 过 自 身Tudor 区 域结合于H3 赖氨酸36 位点来参与染色体活化[6]。PHF19 在表观遗传调控中起着至关重要的作用,是多 种 病 理 生 理 过 程 的 关 键 调 控 因 子[7,8]。另 外,PHF19 在多种肿瘤的发生发展和侵袭过程中起着重要作用。Zhu 等[9]研究发现,PHF19 是与肝细胞癌免疫浸润和预后相关的致癌指标。Jain 等[10]研究发现,PHF19 在控制前列腺癌细胞增殖和侵袭性之间的平衡方面有重要作用。Schinke 等[11]研究发现,PHF19 可作为多发性骨髓瘤的治疗靶点。然而,PHF19 在LUAD 中的作用尚不清楚。
众所周知,免疫治疗是近年来出现的一种高效的肿瘤治疗方法。之前的研究表明[12],肿瘤微环境(the tumor microenvironment,TME)中细胞的成分在肿瘤增殖、血管生成、侵袭和转移、化疗耐药性以及癌症的其它标志中起调节作用。Zhang 等[13]研究发现,TME 中肿瘤浸润免疫细胞(tumor-infiltrating immune cells,TIICs)调节癌症的进展并发挥潜在的预后价值。由于TIICs 是有吸引力的治疗靶点,因此发现更多的免疫靶点或免疫机制对于TIICs 的研究至关重要。然而,对PHF19 与免疫浸润的相关性知之甚少。
本研究探讨了PHF19 在LUAD 中的表达水平、临床预后、遗传改变、甲基化值、生物学功能和免疫调节作用。其中,主要探讨了PHF19 表达与LUAD 免疫调节之间的潜在关系。总之,本研究提示PHF19 在LUAD 中具有重要的预后价值和免疫相关性。
1 材料与方法
1.1 数据获取和预处理
所有原始数据均从癌症基因组图谱(TCGA)(https://cancergenome.nih.gov/)数 据 库 中 下 载。从TCGA 数据库获取TCGA-LUAD 的RNA 队列数据,并对所有数据进行归一化处理以去除丢失和重复的结果。
1.2 PHF19 在LUAD 中的表达分析
利 用TIMER 数 据 库[14](https://cistrome.shinyapps.io/timer/)的“Diff Exp”模块分析了泛癌中PHF19 的表达谱。Wilcoxon 检验比较差异表达情况,P<0.05 为差异具有统计学意义。
利 用UALCAN 数 据 库[15](http://ualcan.path.uab.edu)分析PHF19 的表达在LUAD 不同临床病理分期、淋巴结转移等中的差异。t检验分析表达差异,P<0.05 为差异具有统计学意义。
1.3 PHF19 表达在LUAD 患者中的预后价值
通过Kaplan-Meier 生存曲线和Log rank 检验对PHF19 mRNA 高表达组和低表达组的TCGALUAD 队列进行生存分析,以评估PHF19 表达在LUAD 患者总生存期(OS)的预后价值,P<0.05 为差异具有统计学意义。
1.4 PHF19 在LUAD 中的基因突变分析
利 用cBioPortal 数 据 库[16](http://www.cbioportal.org/)分 析 了230 例LUAD 患 者PHF19 基 因的突变情况,并且可视化每个个体样本中突变的完整细节。
利用TIMER 数据库评估PHF19 与TP53 突变的关系。Wilcoxon 检验比较差异表达情况,P<0.05 为差异具有统计学意义。
1.5 PHF19 在LUAD 中的启动子甲基化水平分析
为了确定LUAD 中PHF19 启动子的甲基化水平,利用UALCAN 数据库分析正常和肿瘤组织之间的PHF19 甲基化值。t检验分析表达差异,P<0.05 为差异具有统计学意义。
1.6 PHF19 共表达基因的富集分析
LinkedOmics 数 据 库[17](http://www.linkedomics.org/login.php)包含了来自TCGA 数据库32 种癌症类型的多组学数据和临床数据。在LinkedOmics 的“LinkFinder”模 块 中,使 用Pearson 检 验 对PHF19 的共表达基因进行统计分析,P<0.05 为差异具有统计学意义,并通过热图和火山图显示结果。在“LinkInterpreter”模块中,利用基因集富集分析(Gene set enrichment analysis, GSEA)对PHF19及其共表达基因的GO 功能和KEGG 通路进行了探索。最 后,基 于KEGG 数 据 库[18](https://www.kegg.jp/),探索 PHF19 及其关联基因在细胞周期通路中的作用和位置关系并生成路线图。
1.7 PHF19 与肿瘤免疫细胞浸润的相关性分析
利用TIMER 数据库“Gene”模块探索PHF19表达与TIICs 浸润水平之间的关系,利用“Correlation”模块探索PHF19 表达与TIICs 的免疫标志物和免疫检查点相关基因之间的关系。采用Spearman 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 PHF19 在泛癌中的表达分析
利用TIMER 分析了来自TCGA 数据库的PHF19 mRNA 在不同肿瘤组织和邻近正常组织中的表达差异。结果显示,PHF19 在泛癌中上调,而在LUAD 组织中显著上调(P<0.001),见图1。

图1 PHF19 在泛癌中的表达Fig 1 Expression of PHF19 in pan-cancer
2.2 PHF19 表达与LUAD 临床病理特征的关系
利用UALCAN 数据库分析PHF19 表达在LUAD 组织和正常肺组织中的差异,结果显示:515例LUAD 组织中PHF19 的表达明显高于59 例正常肺组织,差异有统计学意义(P=1.624E-12),见图2A。
分析PHF19 表达在LUAD 中不同临床分期中的差异,结果显示:Stage 1 组、Stage 2 组、Stage 3 组和Stage 4 组中PHF19 的表达与正常肺组织相比,差异有统计学意义(P<1E-12,P<1E-12,P=1.624E-12,P=3.417E-06),见图2B。
分析PHF19 表达在LUAD 淋巴结转移中的差异,结果显示:N0组、N1组、N2组中PHF19的表达与正常肺组织相比,差异有统计学差异(P<1E-12,P<1E-12,P=1.626E-12),而在N3 组患者中PHF19的表达无统计学差异(1.349E-01),见图2C。
2.3 PHF19 表达与患者总生存期的关系
PHF19 低表达组患者的OS 明显高于PHF19高表达组(HR=1.21,P=0.022),见图2D。结果表明,PHF19 表达与患者OS 显著相关,可成为预测LUAD 患者生存的一个生物标志物。
2.4 PHF19 在LUAD 中 的 基 因 突 变
利用cBioPortal 数据库分析了LUAD 中PHF19 的突变状态,结果显示:0.9%的患者出现遗传变异,扩增和错义突变是最常见的突变,见图3A、B。
利用TIMER 数据库评估PHF19 与TP53 突变的关系,结果显示:TP53 突变体中PHF19 表达明显高于TP53 野生型,即PHF19 的高表达与TP53 的突变呈正相关(P<0.001),见图3C。

图3 PHF19 在LUAD 中的基因突变Fig 3 PHF19 gene mutation in LUAD
2.5 PHF19 在LUAD 中的启动子甲基化
利用UALCAN 数据库比较了正常组织和肿瘤组织之间PHF19 的甲基化值。结果显示,PHF19的启动子甲基化水平在LUAD 中显著降低(P=4.088E-05),表明PHF19 的转录表达可能是由于启动子甲基化的改变,见图4。
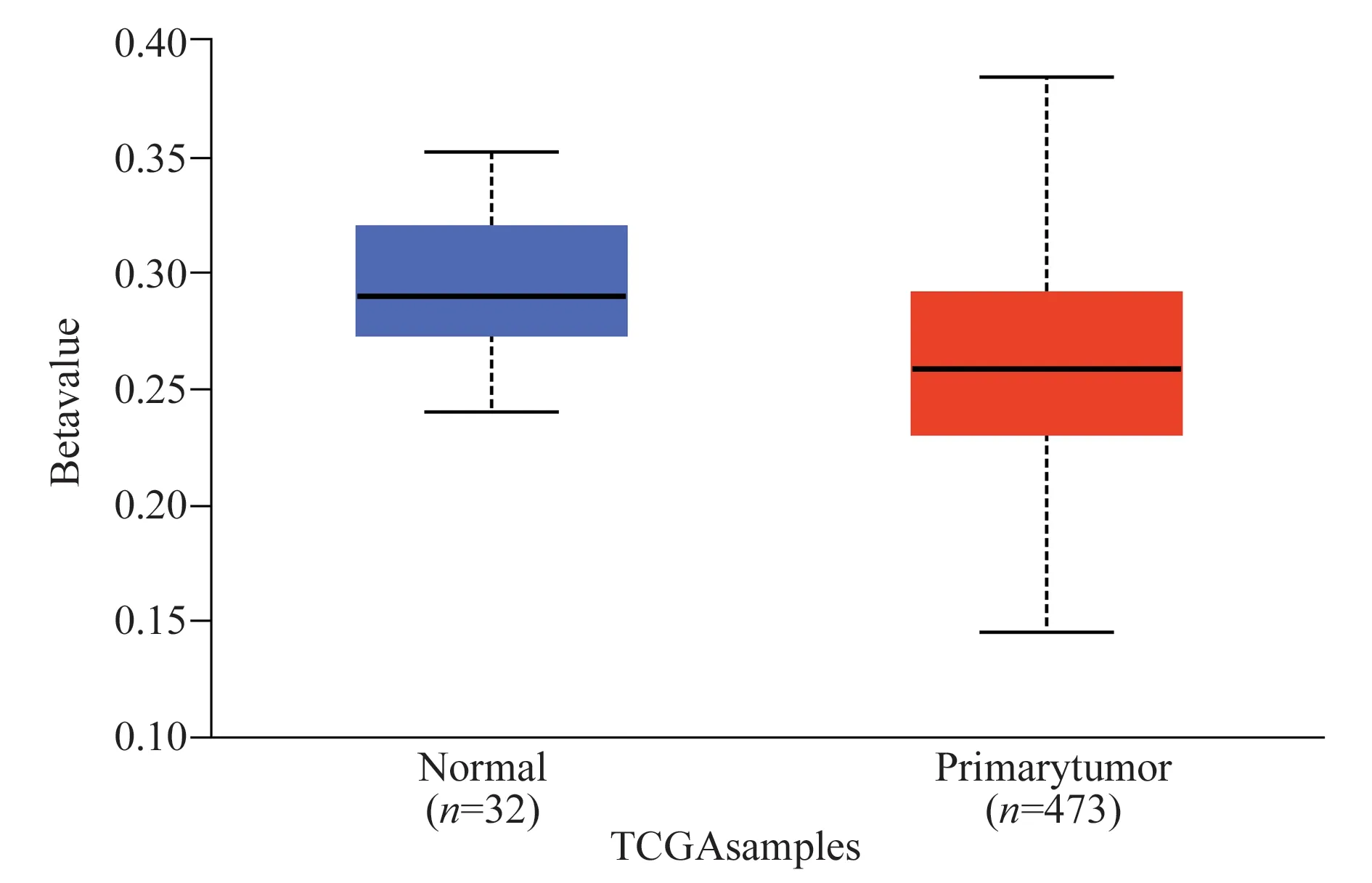
图4 LUAD 中PHF19 的启动子甲基化水平Fig 4 Promoter methylation levels of PHF19 in LUAD
2.6 PHF19 共表达基因的富集分析
基于515 名TCGA -LUAD 患者的PHF19 mRNA 测序数据,利用LinkedOmics 的“LinkFinder”模块,分析PHF19 在LUAD 中的共表达基因,以探索其在肿瘤组织中的潜在功能。深红色点表示的基因与PHF19 呈正相关,深绿点表示的基因与PHF19 呈负相关(FDR<0.01),见图5A。并且筛选出关联最紧密和最疏远的Top 50 基因绘制热图,见 图5B、C。 在“LinkInterpreter”模 块 中,利 用GSEA 对PHF19 及其共表达基因的GO 功能和KEGG 通路进行探索。GO 项分析表明,这些关联基因主要富集于染色体分离、DNA 复制、细胞周期检查点、双股断裂修复、细胞周期G2/M 相变、细胞周期G1/S 相变等生物过程中,见图5D。KEGG 分析主要富集于细胞周期、DNA 复制、同源重组、黄体酮介导的卵母细胞成熟、错配修复、卵母细胞减数分裂、p53 信号通路、核苷酸切除修复等通路中,其中,以细胞周期通路最明显,见图5E。此外,进一步探索PHF19 及关联基因在细胞周期通路中的作用和位置关系,生成路线图并用红色标记标出通路中对应基因的相关位置,大部分基因与细胞周期的G1/S 期和G2/M 期有关,见图5F。这些结果表明,PHF19 可能参与LUAD 细胞增殖和凋亡。

图5 LinkedOmics 数据库分析LUAD 组织中的PHF19 共表达基因Fig 5 The PHF19 co-expressed gene in LUAD tissues analysed by the LinkedOmics database
2.7 PHF19 表达与TIICs 浸润水平之间的关系
PHF19 的表达与CD4+T 细胞(r=0.136,P=2.80E-03)、中性粒细胞(r=0.169,P=1.96E-04)、树突状细胞(r=0.163,P=3.02E-04)的浸润呈显著正相关,与B 细胞、CD8+T 细胞、巨噬细胞的浸润呈无相关性(P>0.05),见图6。

图6 LUAD 组织中PHF19 表达与TIICs 浸润水平之间的关系Fig 6 Relationship between PHF19 expression and TIICs infiltration level in LUAD tissues
2.8 PHF19表达与TIICs的免疫标志物之间的关系
PHF19 的表达与CD8+T 细胞的免疫标志物(CD8A、CD8B)、CD4+T细胞的免疫标志物(CD4)、M1型巨噬细胞的免疫标志物(IRF5)、M2型巨噬细胞的免疫标志物(CD163、VSIG4)、中性粒细胞的免疫标志物(ITGAM)、树突状细胞的免疫标志物(NRP1、ITGAX)呈正相关,与中性粒细胞的免疫标志物(CEACAM8)、树突状细胞的免疫标志物(CD1C)呈负相关,见表1。

表1 通过TIMER 数据库检测LUAD 组织中PHF19 表达与TIICs 的免疫标志物之间的关系Tab 1 The relationship between the expression of PHF19 in LUAD tissue and the immune markers of TIICs detected by the TIMER database
2.9 PHF19表达与免疫检查点相关基因之间的关系
PHF19 的表达与LUAD 组织TME 中PD-L1、PD-1 和CTLA-4 相关基因的表达密切相关(均P<0.05),表明PHF19 可能通过参与LUAD 的免疫逃逸从而导致癌症发生,见图7。

图 7 LUAD组织中PHF19表达与免疫检查点相关基因之间的关系Fig 7 Relationship between PHF19 expression and immune checkpoint related genes in LUAD tissues
3 讨论
LUAD 是一种恶性肿瘤,其特征是肺和支气管中细胞不受控制的生长。尽管过去几十年LUAD的诊断和治疗取得了很大进展,但晚期患者的预后仍然很差。其中,大量研究集中在LUAD 的免疫治疗上,几种免疫检查点抑制剂提高了晚期LUAD 患者的存活率[19]。然而,由于治疗上耐药,大量患者逐渐对免疫治疗无反应。因此,探索LUAD 的敏感诊断和预后的生物标志物至关重要。
表观遗传机制与肿瘤的发生发展密切相关。近年来研究发现,在肺癌发展的不同阶段发生了各种各样的表观遗传修饰,其中一些修饰是肿瘤进展的关键[20]。表观遗传学是指影响基因表达而不修改主基因组DNA 序列的有丝分裂遗传变化。表观遗传特征包括DNA 甲基化、组蛋白修饰、非编码RNA 和染色质的重塑。表观遗传调控基因突变引起的表观基因组图谱变化具有明确的临床意义,尤其对预后风险分层及预测疾病进展或复发具有重要意义[21]。本研究发现,0.9%的LUAD 患者出现了PHF19 遗传变异,扩增和错义突变是最常见的突变,提示PHF19 可能成为LUAD 的预测指标。众所周知,TP53 突变是LUAD 中最常见的突变之一,它影响LUAD 的进展和预后。TP53 突变体中PHF19 的表达明显高于TP53 野生型,这可以部分解释TP53 的突变可以促进LUAD 的进展。之前的研究还发现[22],LUAD 中的TP53 突变状态与较高的PD-L1 表达水平相关。上述结果为LUAD 的免疫治疗进一步提供支持。另外,启动子DNA 甲基化已被证明会影响转录抑制并参与肿瘤肿瘤发生[23]。上述分析结果显示,PHF19 的启动子甲基化水平在LUAD 中显著降低,表明PHF19 的转录表达可能是由于启动子甲基化的改变。
为了进一步了解PHF19 参与致癌的潜在分子机制,本研究首先利用LinkedOmics 数据库确定PHF19 的共表达基因,结果显示,LUAD 中与PHF19 共表达的基因有ASF1B、HMGB2、CDT1、KIF18B、PTTG1 等。其 中,与PHF19 最 相 关 的ASF1B 和HMGB2 已经被证实可以促进LUAD 的增 殖 和 侵 袭,并 可 以 作 为 潜 在 靶 标[24,25]。这 提 示PHF19 可能参与LUAD 的进展。接下来,通过功能富集分析了PHF19 共表达基因在LUAD 中的功能和调控网络。GO 项分析发现,PHF19 的生物学过程主要集中在细胞分裂过程中。KEGG 分析发现,PHF19 在细胞周期途径中显著富集。同时,通过KEGG 数据库进一步探索了PHF19 及关联基因在细胞周期通路中的作用和位置关系,可视化发现大部分相关基因与细胞周期的G1/S 期和G2/M 期有关,进一步表明PHF19 可能通过细胞周期通路参与LUAD 进 展。Mason M 等[26]研 究 发 现,低 水 平 的PHF19 可以导致多发性骨髓瘤的生长和细胞周期停滞。García-Montolio 等[27]研究发现,慢性髓系白血病细胞中低水平的PHF19 可以引起细胞周期停滞并促进其向红系途径分化。这与本研究分析的结果一致,故我们推测PHF19 可能是LUAD 肿瘤细胞增殖的必要条件。
癌症的生长和扩散不仅取决于肿瘤细胞的特征,还取决于与TME 中TIICs 的相互作用,这与LUAD 患者的生存率呈正相关[28]。本研究表明,PHF19 的表达不仅与TME 中部分免疫细胞亚型浸润相关,而且还与这些免疫细胞的生物标志物相关,但不绝对一致。Zhang 等[29]研究发现,TME 中的中性粒细胞浸润增强了非小细胞肺癌细胞在体外的增殖和侵袭能力。另外,由于树突状细胞具有启动和调节T 细胞反应的独特能力,已被广泛用于肺癌在内的许多肿瘤的免疫治疗[30]。上述结果提示,TIICs 可能是PHF19 介导的LUAD 致癌作用的部分原因。免疫检查点阻断法已经成为各种恶性肿瘤的标准治疗方法。然而,只有一小部分特定类型的癌症患者对免疫治疗有反应,这可能是由于免疫激活不足,无法识别肿瘤特异性抗原[31]。因此,必须确定其它潜在的治疗靶点。之前研究已经表明,PD-1、PD-L1 和CTLA-4 是负责肿瘤免疫逃逸的重要免疫检查点。PD-1 通路是TME 局部免疫抑制的关键介质[32],通过抑制免疫细胞上的PD-1 受体或肿瘤细胞上的PD-L1 配体来阻断PD-1 途径可以抑制肿瘤生长。本研究探讨了PHF19 与3 种免疫检查点相关基因之间的关系。结果显示,LUAD 组织中二者呈显著正相关,提示PHF19 可能在LUAD的免疫逃逸中发挥重要作用。这些结果表明,PHF19 可以作为LUAD 免疫治疗的有效靶点,为肿瘤患者的临床治疗提供新的希望。
总之,本研究利用生物信息学分析技术,探讨了PHF19 在LUAD 中的表达水平、临床预后、遗传改变、甲基化值、生物学功能和免疫调节作用。结果表明,PHF19 可能是LUAD 患者一种新的潜在预后和免疫相关生物标志物。本研究为进一步研究PHF19 在LUAD 的发展和治疗中的具体机制奠定了基础。然而,这项研究是基于公共数据库的,所以有一些局限性。因此,还需要更多基础实验来验证这种生物学影响。
作者贡献度说明:
谢军瑶:研究课题的提出、设计和论文初稿写作;巩健男:研究课题数据分析和论文修改;;韩晓瑾:数据获取;李建强:审阅及指导工作。
所有作者声明不存在利益冲突关系。

