紫草素对完全弗氏佐剂诱导的类风湿性关节炎小鼠模型的治疗作用
黄君霞, 解佑银, 孔德一, 邵丽林, 张雷芳
(浙江海洋大学食品与药学院/浙江省海洋生物医用制品工程技术研究中心, 浙江 舟山 316022)
类风湿关节炎(Rheumatoid arthritis, RA)是目前人类普遍存在的一种自身免疫性疾病, 该病发病时主要表现为关节及其四周组织产生非化脓性炎症[1]。相关调查[2]显示, RA 的发病年龄广泛, 各个年龄段皆可发病, 且发病率高, 通常100 个人中会有1~2 人患有RA 疾病, 中国RA 发病率为0.4%, 患病人数多, 30~50 岁的病人很多, 且女性患者比男性患者高2~3 倍[3]。RA 如果不及时诊断与治疗, 易侵袭其他器官和关节。相关调查显示, 未及时治疗的RA患者3 年致残率高达75%[4]。临床研究表明, RA 治疗手段缺乏高度敏感性分子标志, 易造成误诊和误治。因此, 需要研发有效、经济的治疗RA 的药物, 减轻RA 患者的经济压力, 同时降低药物的不良反应及并发症。
AA 模型是建立免疫性关节炎动物模型的常用方法[5], 以小鼠足趾为注射点, 分2 次在小鼠皮内注射0.1 mL 免疫制剂CFA 致炎[6, 7]。完全弗氏佐剂可以起到对机体产生刺激而引起继发性自身免疫应答反应的作用。AA 小鼠模型所导致的关节炎病变属于一种急性的对外来抗原等刺激产生相关反应。注射免疫制剂后的小鼠致敏后会立即引起相关关节的肿胀和疼痛, 18~24 d 达到病情的峰值, 并持续3 d, 随后越来越低。在对病变的研究过程中发现, 小鼠会出现前肢或后肢的关节肿胀畸形甚至溃烂[8]。
紫草素(Shikonin, SHI)是从宗阜根中分离得到的重要活性化学成分。紫草素中化学物质成分含量极多且种类丰富, 如生物碱类、三萜类、紫草多糖类等。SHI 具有良好的抗炎、免疫抑制、镇痛等生物活性[9-14]。紫草素的抗炎作用多与NO、TNF-α、IL-6、IL-1β、IL-8 和NF-κB 等有关[15, 16]。
本研究以紫草素为研究对象, 评价其在AA 小鼠模型中的抗炎作用, 观察足踝的病理变化, 测定炎症因子和氧化应激的相关指标。
1 材料与方法
1.1 材料
1.1.1 药物与试剂 IL-6 ELISA 试剂盒、IL-1β ELISA 试剂盒、TNF-αELISA 试剂盒、NO ELISA 试剂盒、SOD 检测试剂盒、MDA 检测试剂盒均购自上海碧云天公司。紫草素、美洛昔康、完全弗氏佐剂购自美国SIGMA 公司。
1.1.2 仪器 SpectraMax M3 型多功能酶标仪, 美国Molecular Devices 公司;DK-S24 型电热恒温水浴锅, 上海森信实验仪器有限公司;CF16RN 型高速台式冷冻离心机, 日本HITACHI 公司;DHG-9140A 型鼓风干燥箱, 上海精宏实验设备有限公司。
1.2 方法
1.2.1 动物分组与模型建立 ICR 雄性小鼠40 只, 重25~30 g(中国杭州浙江实验动物中心), 饲养在标准环境条件下[温度(24±2)℃, 40%~60%湿度和12 h光-暗循环], 自由进食和饮水。适应环境1 周后, 将小鼠随机分为4 组:正常对照组、AA 模型组、阳性对照(美洛昔康)组、紫草素组。
AA 模型建立方法:将小鼠右足跖周围的毛去除, 对小鼠关节进行消毒, 正常对照组小鼠注射生理盐水(0.02 mL/只), 其余组均后右足跖部注射0.02 mL CFA, 以注射点周围出现明显白泡为佳, 使其致炎发展成佐剂性关节炎(AA), 造模成功后的第15 天, 模型小鼠再次注射CFA 以更贴近于RA 临床上反复发作的特点。在造模20 d 后开始给予药物治疗, 阳性对照组灌胃美洛昔康50 mg/(kg·d), 紫草素组灌胃紫草素2 mg/(kg·d), 正常对照组和AA 模型组均灌胃等体积的0.9%生理盐水, 给药周期为60 d。记录小鼠体重和足踝处肿胀程度, 从而对关节炎症状进行评分。
1.2.2 样本收集 小鼠最后一次灌胃给药后禁食24 h, 解剖前称重并记录体重, 采血, 3 000 r/min 离心10 min, 血清-80 ℃保存。快速切除完整的右足踝关节部位, 固定在4%磷酸盐缓冲多聚甲醛中进行组织学分析, 4 ℃保存。取出脾脏和胸腺, 称重后计算脾脏指数和胸腺指数。免疫器官指数(mg/g)=免疫器官(脾脏、胸腺)/体质量。
1.2.3 足跖肿胀度和关节炎评分 造模前测量小鼠的后肢足跖厚度, 取平均值作为基数后进行AA 造模。给药前测定和给药后每隔7 d 测定足跖厚度。足跖肿胀度=(给药后足跖厚度-造模前足跖厚度)/造模前足跖厚度。
采用关节炎分数评分法于给药前和给药后每隔7 d 记录关节炎病变严重程度, 每组盲选3 只, 取其平均值为关节炎分数。关节炎指数评分标准见表1。

表1 关节炎指数评分标准
1.2.4 组织学分析 采用HE 染色法观察足踝关节组织学变化, 判定小鼠的滑膜炎症程度和软骨破坏程度以及骨浸润程度。
1.2.5 测定血清中炎症因子和抗氧化因子活性 测定血清中炎症因子一氧化氮(NO)、肿瘤因子α(TNF-α)、白细胞介素6(IL-6)和白细胞介素1β(IL-1β)含量, 血清中抗氧化因子丙二醛(MDA)含量和超氧化物歧化酶(SOD)活力。
1.2.6 统计分析 使用Graph-Pad Prism 8.0 软件进行统计分析。数值以均数±标准差(s)表示。组间均数比较采用t检验或单因素方差分析, 然后采用纽曼-科伊尔斯检验。P<0.05 时, 对比组之间的差异具有显著性意义;P<0.01 时, 对比组之间的差异具有极显著性意义。
2 结果与分析
2.1 造模前后小鼠关节变化
在第二次免疫完成后, 拍照记录造模后的变化情况。根据图1 可知, 对正常的小鼠进行建模后, AA 模型组与正常组小鼠相比关节处可见明显的红肿, 足跖肿大现象, 表明AA 模型建立成功。
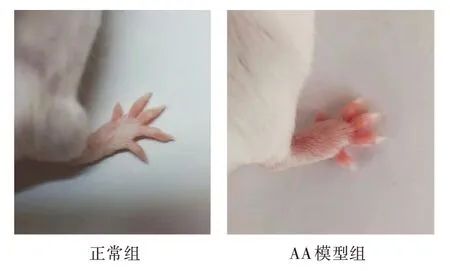
图1 正常小鼠和AA 模型小鼠关节变化对比情况
2.2 给药后小鼠关节变化
在处死前拍照记录小鼠足跖处情况, 分析给药前后变化情况。给药60 d 后, 可见正常对照组的小鼠关节处正常, 未出现红肿和关节变形的现象(图2)。AA 模型组明显出现红肿和溃烂现象。而美洛昔康组和紫草素组, 小鼠足跖肿胀明显消退, 关节处的溃烂情况也得到改善。类风湿关节炎的临床表现关节红肿、僵硬、疼痛, 严重者出现关节畸形。紫草素组与美洛昔康组肿胀程度均弱于AA 模型组, 说明紫草素可以减轻炎症, 对小鼠关节炎有很好的治疗作用, 并且效果与美洛昔康相近。
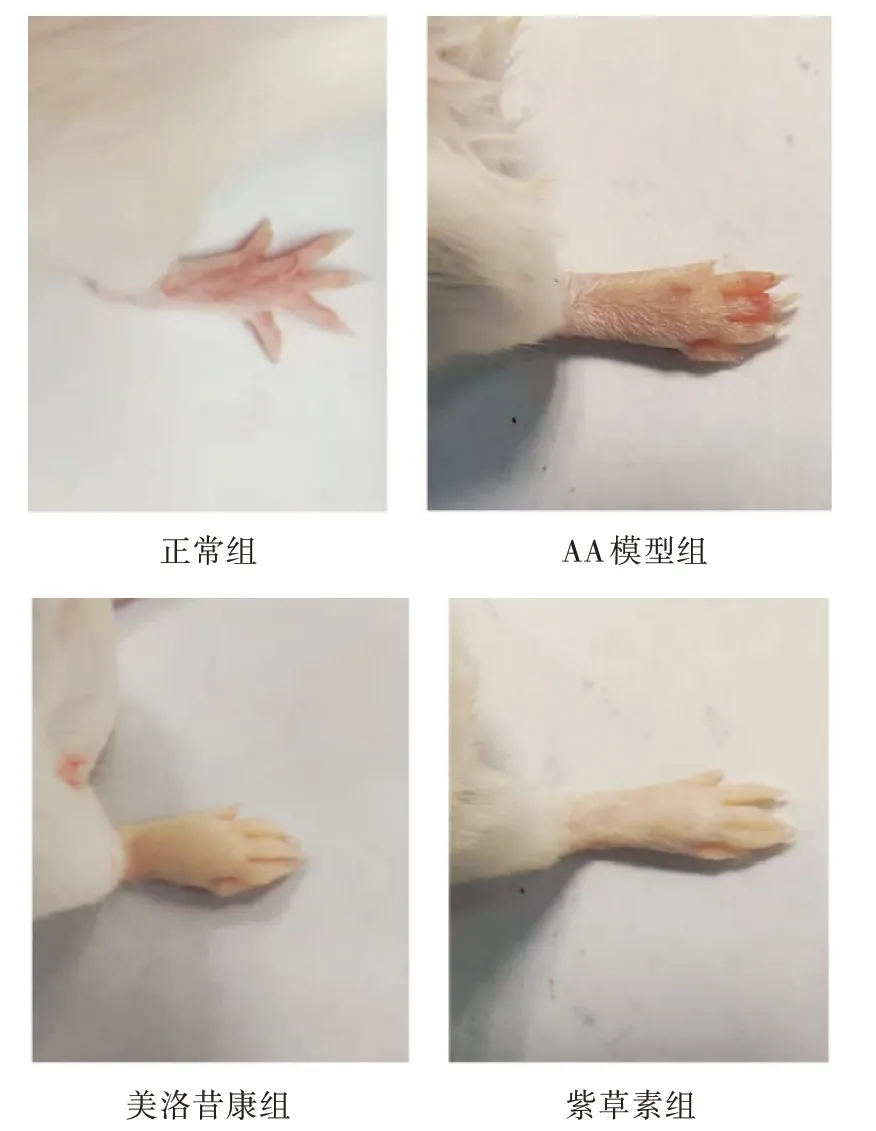
图2 给药后小鼠关节变化情况
2.3 紫草素对小鼠体重的影响
根据图3 可知, 正常对照组小鼠体重平稳增长, 变化幅度明显, AA 模型组小鼠体重增长幅度不大。与AA 模型组相比, 紫草素组与美洛昔康组小鼠体重增长幅度明显, 差异显著或极显著(P<0.05 或P<0.01)。正常组小鼠体重最大, 其次为紫草素组、美洛昔康组, 最后为AA 模型组, 说明致炎后小鼠的体重增长受到了严重抑制, 紫草素治疗对小鼠体重恢复具有促进作用。类风湿关节炎会引起胃肠道并发症, 对小鼠的消化吸收产生影响。因此, 小鼠出现食欲下降从而导致体重下降的现象。
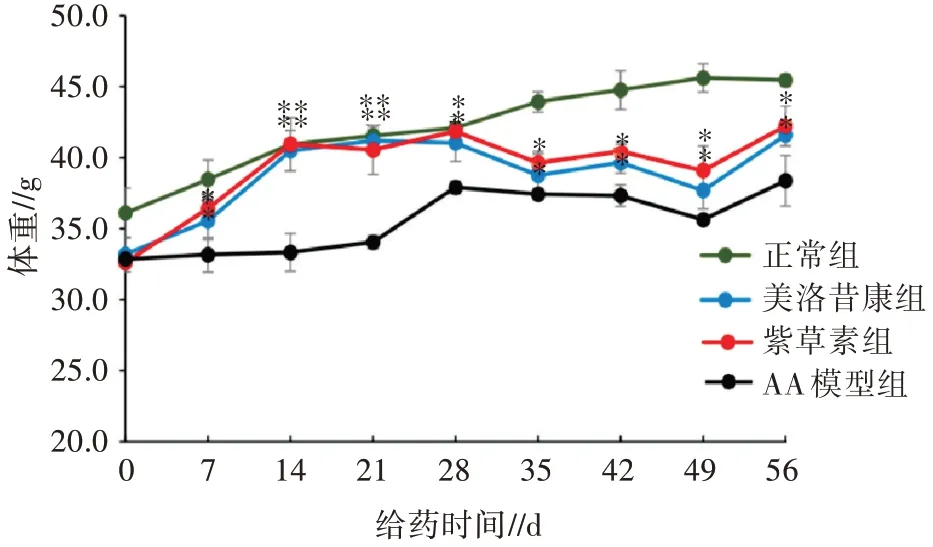
图3 紫草素对小鼠体重的影响(n=6, ±s)
2.4 紫草素对小鼠足跖肿胀和关节炎指数的影响
通过测量足跖厚度和观察组织外观, 计算足跖肿胀度和关节炎指数评分来判定小鼠关节炎程度。由图4a 可知, 与AA 模型组相比, 紫草素组和美洛昔康组小鼠组织肿胀度显著下降(P<0.05 或P<0.01)。由图4b 可知, 与AA 模型组相比, 紫草素组和美洛昔康组小鼠关节炎指数评分显著下降(P<0.05 或P<0.01)。紫草素可以减轻足跖肿胀, 降低关节炎指数评分, 表明对关节炎有一定的治疗作用。
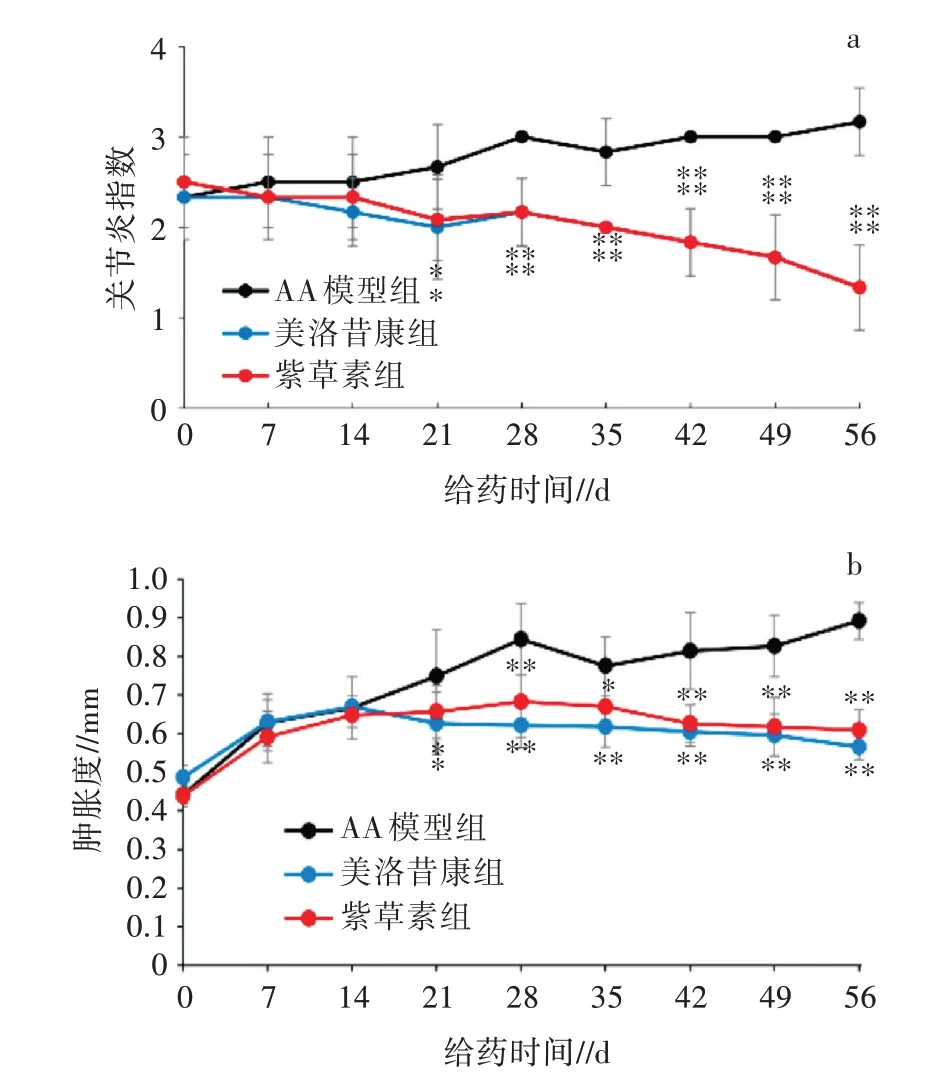
图4 紫草素对AA 模型小鼠足跖肿胀度、关节炎指数的影响(n=6, ±s)
2.5 紫草素对小鼠免疫器官指数的影响
通过测定免疫器官指数来判定小鼠的免疫程度。由图5a 可知, 与正常对照组相比, AA 模型组小鼠的胸腺指数明显增加。与AA 模型组相比, 紫草素组和美洛昔康组小鼠胸腺指数明显下降, 差异显著(P<0.05);由图5b 可知, 与正常对照组比较, AA模型组小鼠的脾脏指数显著增加。与AA 模型组相比, 紫草素组和美洛昔康组小鼠脾脏指数明显下降, 差异显著(P<0.05)。AA 模型组小鼠由于机体免疫过度表达导致免疫器官指数大幅增加, 而紫草素组和美洛昔康组显著降低了AA 模型组小鼠免疫器官指数, 并且和正常组相比, 免疫器官指数略有增加。紫草素对胸腺和脾脏促进恢复的作用, 降低脾脏及胸腺过度肿大, 减少适应性免疫细胞的过度增殖。
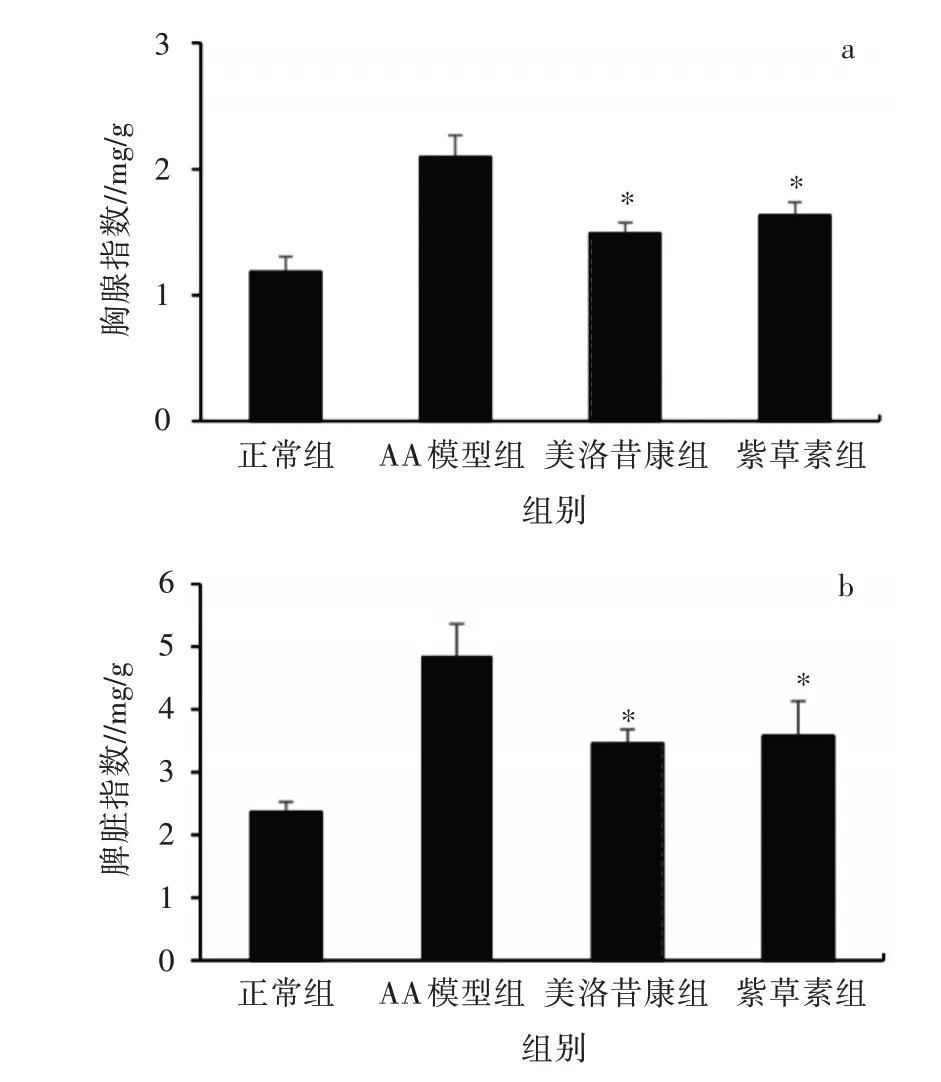
图5 紫草素对AA 模型小鼠免疫器官指数(脾脏、胸腺)的影响(n=6, ±s)
2.6 紫草素对AA 模型小鼠足踝关节组织病理学特征的影响
通过对AA 模型小鼠足踝关节组织HE 染色, 了解AA 模型所致关节炎的情况。由图6 可知, AA 模型组明显出现滑膜增生, 滑膜组织内出现炎性细胞浸润和细胞坏死情况, 关节处出现部分骨质破坏, 关节腔间隙减小。与AA 模型组相比, 紫草素组与美洛昔康组关节软骨破坏有明显改善, 炎性细胞浸润和滑膜增生也明显减少, 表明紫草素可以明显改善AA 模型小鼠的关节组织病理学损伤, 保护滑膜组织和细胞结构的完整性。
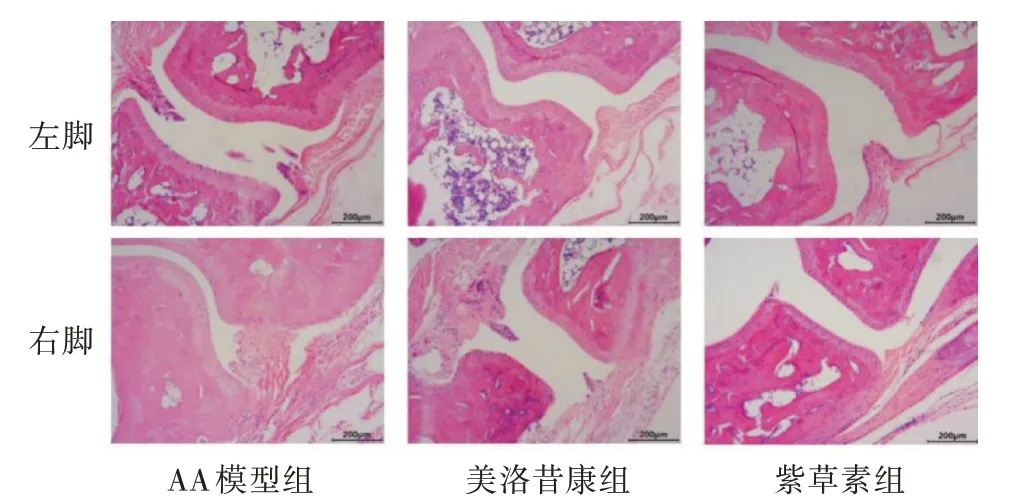
图6 紫草素对AA 模型小鼠足踝关节组织病理学特征的影响(400×)
2.7 紫草素对AA 模型小鼠血清中MDA 含量和SOD 酶活力的影响
测定了小鼠血清中MDA 含量和SOD 酶活力以评价紫草素的抗氧化效果。由图7 可知, 与正常对照组相比, AA 模型组小鼠血清中MDA 的含量明显增加, SOD 酶活力明显下降。而与AA 模型组相比, 紫草素组和美洛昔康组血清中MDA 含量显著减少, SOD 酶活力显著增加(P<0.05), 表明紫草素可以减少MDA 含量、增加SOD 酶活力, 从而减轻AA 模型所致RA 的氧化应激。
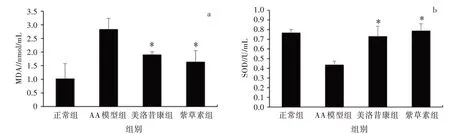
图7 紫草素对AA 模型小鼠血清中MDA 含量和SOD 酶活力的影响(n=6)
2.8 紫草素对AA 模型小鼠血清中炎症因子含量影响
测定了小鼠血清中NO、TNF-α、IL-6 和IL-1β的含量以评价紫草素的抗炎效果。从图8 可知, 与正常对照组相比, AA模型组血清中NO、TNF-α、IL-6和IL-1β 含量明显增加。而与AA 模型组相比, 紫草素组和美洛昔康组血清中NO、TNF-α、IL-6 和IL-1β 含量显著减少(P<0.05)。紫草素通过下调炎症因子表达来减轻RA 的炎症反应。
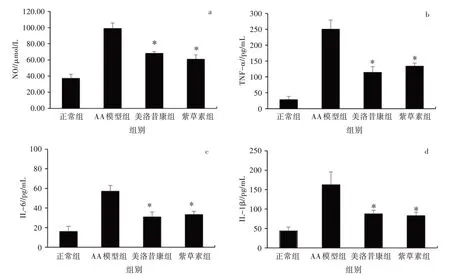
图8 紫草素对AA 模型小鼠血清中炎症因子含量的影响(n=6)
3 小结与讨论
关节内如果含有大量的氧自由基会抑制软骨细胞增殖, 并且会导致软骨细胞凋亡。MDA 是脂质过氧化产物, SOD 是超氧阴离子清除剂, 测定MDA 含量和SOD 活力可间接反映体内氧自由基的数目[17]。MDA 含量高低与机体抗氧化能力有关, 是反映机体组织过氧化损伤程度的重要参数之一。MDA 的产生会加剧细胞膜的损伤, 因此测定小鼠血清中MDA含量的高低可以反映机体脂质是否过氧化, 也可以进一步反映组织的损伤程度。MDA 含量越高, 表明组织损伤越严重, 炎症越严重。由MDA 含量和SOD活力测定结果可知, 紫草素对细胞和组织损伤有一定的恢复效果, 并且清除了体内过多的氧自由基。在抗氧化因子测定中, 紫草素可以降低MDA, 提高SOD 活力, 提高机体抗氧化能力, 降低AA 模型所致的氧化应激损伤的程度。王喜欢等[18]发现紫草素对高糖诱导的内皮细胞有抗氧化应激和抑制细胞凋亡作用, 通过升高MDA 和ROS, 降低SOD 和GSH-Px的活力来实现。并且紫草素可以提高高糖诱导的内皮细胞的细胞活力, 其作用机理为抑制Nrf2/HO-1通路的激活。杨登科等[19]发现紫草素对过氧化氢诱导的人黑素细胞有干预氧化应急作用, 紫草素可以增强细胞活力, 抑制细胞凋亡, 并且其作用效果跟浓度成正比。
NO 属于炎症介质, 会介导炎症因子的病理作用。炎症关节中NO 来源主要是软骨细胞和滑膜细胞。紫草素通过清除炎症关节中的NO 来达到治疗关节炎和保护细胞的效果。研究表明, TNF-α同样也会刺激黏附分子, 被刺激的黏附分子可以黏附越来越多的白细胞, 使炎症作用越来越强, 对巨噬细胞或者非双核细胞产生刺激, 可以分泌趋化性细胞因子。趋化性细胞因子可以使白细胞在炎症某一特定部位聚集。根据国内外已有研究显示RA 的发病机制主要和TNF-α、IL-1β 有关, 细胞活化能力强的T细胞对巨噬细胞和滑膜细胞有激活的作用, 并且可以释放IL-1β 和TNF-α[20-22]。RA 患者血清TNF-α、IL-1β 含量明显高于常人。紫草素具有抗炎作用, Fu 等[23]发现紫草素可以抑制雄性SD 大鼠骨关节炎模型中炎症因子(IL-1β、TNF-α 和iNOS)的升高, Yang 等[24]在LPS 诱导的乳腺炎模型中, 发现紫草素能降低组织上游促炎性细胞因子TNF-α、IL-6 和IL-1β 的水平。本研究表明紫草素对AA 模型小鼠模拟RA 有一定的治疗作用, 同时可以改善关节和滑膜组织病理损伤, 维持小鼠体重稳定。紫草素通过降低炎症因子IL-1β、IL-6、TNF-α 和NO 的含量, 减轻RA 的炎症反应达到治疗目的。
本研究利用完全弗氏佐剂进行二次免疫, 成功诱导小鼠AA 模型模拟人类风湿关节炎, 证明紫草素可以通过抗氧化应激和降低炎症反应来治疗AA小鼠, 但并未对其作用机制进行深入探讨。

