白芍总苷调控NF-κB/NLRP3 信号通路对急性痛风性关节炎大鼠的影响 机制研究①
畅秀丽 张安兵 (湖北文理学院附属医院,襄阳市中心医院风湿免疫科,襄阳 441021)
急性痛风性关节炎(acute gouty arthritis,AGA)是一种常见的炎症性关节炎,其主要特征为尿酸增加和关节内尿酸钠晶体(monosodium urate,MSU)积累,表现出强烈疼痛、关节肿胀及活动性炎症等症状,具有高发病率和致残率[1-2]。目前用于治疗AGA的药物会导致患者中枢神经系统、胃肠道、肝肾功能损伤,因此有必要寻找新的有效治疗药物,减少药物副作用[3]。白芍总苷(total glucosides of paeony,TGP)作为白芍提取物具有抗炎和免疫调节的作用,已被广泛用于治疗类风湿关节炎等自身免疫性疾病[4]。有研究表明TGP 可能通过抑制促炎因子水平,对MSU 诱导的AGA 大鼠具有治疗作用[5]。核因子-κB(nuclear factor-kappa B,NF-κB)/含NLR 家族Pyrin 域蛋白3(NLR family,Pyrin domain containing protein 3,NLRP3)信号通路与MSU 晶体诱导的炎症细胞因子释放有关[6]。研究发现,TGP 可通过抑制NLRP3 和NF-κB 表达抑制MSU 诱导的THP-1 巨噬细胞炎症[7]。目前,关于TGP 是否可通过调控NFκB/NLRP3通路影响AGA 模型大鼠炎症反应还未可知,因此本研究通过对其探究以期为TGP 在AGA 中的治疗机制研究提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 华中科技大学动物实验中心提供的60 只SPF 级SD 大鼠(245~290 g),许可证号:SCXK(鄂)2016-0009,适应性饲养于12 h/12 h 明暗交替的环境中1 周,期间自由饮水、采食,实验前禁食12 h。
1.1.2 主要试剂与仪器 TGP(南京景竹生物科技有限公司,货号:JZ20130101);秋水仙碱(上海宝曼生物科技有限公司,货号:D0123);尿酸钠(上海一研生物科技有限公司,货号:EY-5948);TNF-α、IL-6、IL-1β ELISA 试剂盒(武汉菲恩生物科技有限公司,货号:ER1393、ER0042、EH0185);HE 染色试剂盒(北京索莱宝科技有限公司,货号:G1120-100);蛋白提取试剂盒(武汉纯度生物科技有限公司,货号:CD-13559-ML);BCA 蛋白检测试剂盒、HRP 标记的山羊抗兔IgG 二抗抗体(北京百奥莱博科技有限公司,货号:HR0329-ZHV、JN0200-GLH);兔抗β-actin、p-NF-κB p65、NF-κB p65、p-IκBα、IκBα、NLRP3、Caspase-1 抗 体(Cell Signaling Technology,货 号:4970、3033、8242、2859、9242、15101、2225)。Invitrogen 凝胶成像系统购自赛默飞世尔;RT2100C 全自动酶标仪购自德国IFP公司。
1.2 方法
1.2.1 分组与模型构建 60只SD大鼠以每组10只随机分为对照组、AGA组、秋水仙碱组(0.65 mg/kg)、TGP-L 组(10 mg/kg)、TGP-M 组(20 mg/kg)、TGP-H组(40 mg/kg)[8-9]。对照组和AGA 组于每天9:00 灌胃生理盐水,秋水仙碱组、TGP-L组、TGP-M组、TGP-H组每天分别灌胃0.65 mg/kg 秋水仙碱及10、20、 40 mg/kg TGP,进行7 d,第5 天给药1 h 后,除对照 组外其余大鼠右侧踝关节背侧注射0.2 ml MSU (100 mg/ml),诱导AGA模型,肉眼可见关节处僵硬、红肿及行动受限则表明造模成功,对照组注射等量生理盐水,造模结束后,再灌胃2 d,观察大鼠一般情况[10]。
1.2.2 大鼠步态及关节炎症指数评价 造模24 h后进行大鼠步态分级:0 级,行走正常;1 级,下肢微弯、跛行;2 级,下肢仅接触地面、中度跛行;3 级, 三足行走,跛行严重。关节炎症指数评价:0 级,关节正常;1级,骨标志明显、关节轻度红肿;2级,骨标志不明显、关节红肿明显;3 级,出现关节外红肿 现象[11]。
1.2.3 大鼠关节肿胀程度检测 于造模前及造模后6 h、12 h、24 h、48 h检测大鼠右侧踝关节容积,肿胀程度(%)=(造模前关节容积-测试时间点关节容积)×100%。
1.2.4 HE 染色观察大鼠踝关节滑膜组织病理学变化 随机选取5 只大鼠,颈椎脱臼处死后于关节腔中注射生理盐水(1 ml),活动关节后收集关节液,随后取踝关节滑膜组织于多聚甲醛(4%)中固定24 h,乙醇脱水(5 min)、石蜡包埋后进行常规切片(4 µm)、二甲苯脱蜡、梯度乙醇水化、苏木精-伊红染色、梯度乙醇脱水,封片后显微镜观察(n=5)。
1.2.5 ELISA 法检测大鼠关节液中炎症因子水平 通过ELISA检测试剂盒检测所得关节液中肿瘤TNF-α、IL-1β、IL-6水平,按试剂盒说明书操作。
1.2.6 Western blot 检测大鼠踝关节滑膜组织各蛋白表达情况 取余下5 只大鼠踝关节滑膜组织,使用组织裂解液裂解组织后提取总蛋白,根据BCA 试剂盒说明书检测组织总蛋白含量;取上样缓冲液与蛋白混匀后100 ℃变性5 min,进行SDS-PAGE 凝胶电泳(40 µg/孔),低温转至PVDF膜,经过5%脱脂奶粉封闭1 h 后,加入兔抗β-actin、p-NF-κB p65、NFκB p65、p-IκBα、IκBα、NLRP3、Caspase-1(1∶1 000)一抗4 ℃孵育过夜,PBS 清洗3 次,添加HRP 标记的山羊抗兔IgG二抗(1∶3 000)孵育2 h,添加发光试剂(ECL Reagent)显色,蛋白凝胶成像仪观察后进行定量分析(n=5)。
1.3 统计学分析 SPSS20.0 统计学软件进行数据分析,以±s描述计量资料,采用单因素方差分析进行多组间比较,采用SNK-q检验多组间的两两比较,P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠一般情况比较 对照组大鼠关节无肿胀现象、皮毛光亮、运动灵活;AGA 组大鼠关节肿胀、跛行、皮毛无光泽、精神倦怠、活动量及进食量减少;秋水仙碱组、TGP-L 组、TGP-M 组、TGP-H 组大鼠关节肿胀、皮毛光泽度、饮食、精神状态及行动均得到有效改善。
2.2 TGP 对AGA 大鼠步态与关节炎症指数的影响 与对照组相比,AGA 组大鼠步态级别与关节炎症指数显著升高(P<0.05);与AGA 组相比,秋水仙碱组、TGP-L组、TGP-M组和TGP-H组大鼠步态级别与关节炎症指数显著降低,存在TGP剂量依赖性(P<0.05);与秋水仙碱组相比,TGP-H 组大鼠步态级别与关节炎症指数差异无统计学意义(P>0.05),见表1。
表1 TGP 对AGA 大鼠步态与关节炎症指数的影响(±s, n=10)Tab.1 Effects of TGP on gait and arthritis index of AGA rats (±s,n=10)

表1 TGP 对AGA 大鼠步态与关节炎症指数的影响(±s, n=10)Tab.1 Effects of TGP on gait and arthritis index of AGA rats (±s,n=10)
Note:Compared with control group, 1)P<0.05; compared with AGA group, 2)P<0.05; compared with TGP-L group, 3)P<0.05; compared with TGP-M group, 4)P<0.05.
2.3 TGP 对AGA 大鼠关节肿胀的影响 AGA 组、秋水仙碱组、TGP-L组、TGP-M组和TGP-H组大鼠关节肿胀程度在6 h 时最大,随着时间的增加,肿胀程度逐渐减轻;与对照组相比,AGA 组大鼠各时间点关节肿胀程度显著提高(P<0.05);与AGA 组相比,秋水仙碱组、TGP-L组、TGP-M组和TGP-H组各时间点大鼠关节肿胀程度显著降低,存在TGP 剂量依赖性(P<0.05);与秋水仙碱组相比,TGP-H 组各时间点大鼠关节肿胀程度差异无统计学意义(P>0.05),见图1。

图1 TGP对AGA大鼠关节肿胀的影响Fig.1 Effect of TGP on joint swelling in AGA rats
2.4 大鼠踝关节滑膜组织病理学观察 对照组大鼠关节滑膜结构正常,无炎症细胞浸润现象发生;AGA 组滑膜水肿、充血、增生现象明显,炎症细胞浸润严重;秋水仙碱组、TGP-L 组、TGP-M 组和TGP-H组滑膜水肿、增生现象减轻,炎症细胞浸润程度得到改善,见图2。

图2 大鼠踝关节滑膜组织病理学观察(HE,×200)Fig.2 Histopathological observation of synovium of ankle joint in rats (HE, ×200)
2.5 TGP 对AGA 大鼠膝关节腔冲洗液炎症因子 水平的影响 与对照组相比,AGA 组大鼠关节腔冲洗 液中TNF-α、IL-6 和IL-1β 水 平显 著 升 高(P<0.05);与AGA组相比,秋水仙碱组、TGP-L组、TGP-M组和TGP-H 组TNF-α、IL-6 和IL-1β 水平显著降低,存在TGP 剂量依赖性(P<0.05);与秋水仙碱组相比,TGP-H 组TNF-α、IL-6 和IL-1β 水平差异无统计学意义(P>0.05),见表2。
表2 TGP 对AGA 大鼠膝关节腔冲洗液炎症因子水平的 影响(±s,n=5,ng/L)Tab.2 Effect of TGP on inflammatory factors in knee joint irrigation fluid of AGA rats (±s,n=5,ng/L)

表2 TGP 对AGA 大鼠膝关节腔冲洗液炎症因子水平的 影响(±s,n=5,ng/L)Tab.2 Effect of TGP on inflammatory factors in knee joint irrigation fluid of AGA rats (±s,n=5,ng/L)
Note:Compared with control group, 1)P<0.05; compared with AGA group, 2)P<0.05; compared with TGP-L group, 3)P<0.05; compared with TGP-M group, 4)P<0.05.
2.6 TGP 对AGA 大鼠关节滑膜组织NF-κB/NLRP3通路相关蛋白表达的影响 与对照组相比,AGA 组大鼠关节滑膜组织p-NF-κB p65/NF-κB p65、NLRP3、Caspase-1 表达显著增加,而p-IκBα/IκBα 表达显著降低(P<0.05);与AGA 组相比,秋水仙碱组、TGP-L组、TGP-M 组和TGP-H 组p-NF-κB p65/NF-κB p65、NLRP3、Caspase-1 表达显著降低,p-IκBα/IκBα 表达显著增加,存在TGP剂量依赖性(P<0.05);与秋水仙碱组相比,TGP-H组p-NF-κB p65/NF-κB p65、p-IκBα/IκBα、NLRP3、Caspase-1 表达水平差异无统计学意义(P>0.05),见表3、图3。
表3 TGP 对AGA 大鼠关节滑膜组织NF-κB/NLRP3 通路相关蛋白表达的影响(±s,n=5)Tab.3 Effect of TGP on expression of NF-κB/NLRP3 pathway related proteins in synovial tissue of AGA rats (±s,n=5)

表3 TGP 对AGA 大鼠关节滑膜组织NF-κB/NLRP3 通路相关蛋白表达的影响(±s,n=5)Tab.3 Effect of TGP on expression of NF-κB/NLRP3 pathway related proteins in synovial tissue of AGA rats (±s,n=5)
Note:Compared with control group, 1)P<0.05; compared with AGA group, 2)P<0.05; compared with TGP-L group, 3)P<0.05; compared with TGP-M group, 4)P<0.05.
Caspase-1/β-actin 0.53±0.10 1.51±0.281)0.56±0.112)1.26±0.212)0.89±0.152)3)0.57±0.092)3)4)Groups Control AGA Colchicine TGP-L TGP-M TGP-H p-NF-κB p65/NF-κB p65 0.49±0.10 1.58±0.341)0.58±0.112)1.30±0.212)0.96±0.182)3)0.60±0.132)3)4)p-IκBα/IκBα 1.66±0.36 0.63±0.121)1.41±0.232)0.81±0.122)1.15±0.182)3)1.40±0.242)3)4)NLRP3/β-actin 0.70±0.12 1.45±0.241)0.78±0.142)1.24±0.212)1.01±0.192)3)0.80±0.162)3)4)
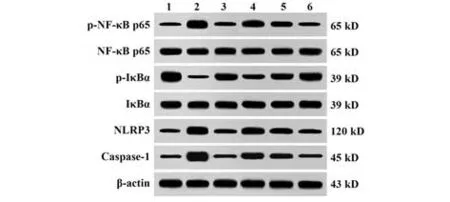
图3 TGP 对AGA 大鼠关节滑膜组织NF-κB/NLRP3 通路相关蛋白表达的影响Fig.3 Effect of TGP on expressions of NF-κB/NLRP3 pathway related proteins in synovial tissue of AGA rats way
3 讨论
AGA 是一种在男性中较为常见的炎症性关节炎,由高尿酸血症及MSU 晶体在关节和关节周围组织沉积所引起,且高尿酸血症作为AGA 发生的最主要因素,与心血管疾病、慢性肾脏病等多种合并症相关[6-12]。降低炎症反应是AGA 临床治疗的主要目的,目前用于治疗AGA 的常用药物秋水仙碱和非甾体抗炎药疗效有限,且长期使用可导致胃肠道出血、肾毒性等副作用[6-12]。由于天然中草药植物来源广泛、疗效好、副作用少,越来越多的研究人员将注意力逐渐集中到对其活性成分的研究中,以期寻找到有效替代药物,提高疗效,减少副作用发生[6]。
TGP作为白芍活性成分,具有镇痛、抗炎和免疫调节的作用,已被用于多种免疫性疾病的治疗[13]。TGP 通过抑制Ⅱ型胶原所诱导的关节炎模型小鼠STAT3信号通路抑制骨质破坏[13]。TGP在类风湿关节炎大鼠中可能通过下调Toll 样受体-2(Toll-like receptor-2,TLR-2)/TNF受体关联因子6(TNF receptor associated factor 6,TRAF6)/NF-κB 通路及调节T 细胞亚群发挥抗炎作用[14]。定痛汤合白芍总苷胶囊在痛风性关节炎中临床疗效甚佳,可缩短病程,改善疾病症状[15]。还有研究发现,TGP 可降低AGA 大鼠血清中TNF-α、IL-6 及IL-1β 水平,抑制炎症反应[5]。本研究发现,TGP 不仅可改善关节肿胀、跛行、皮毛无光泽、精神倦怠等症状,还可显著降低AGA 大鼠步态级别、关节炎症指数、关节肿胀程度、组织病理学程度,该结果表明,TGP 对AGA 大鼠不良症状及关节病理学程度具有改善作用。本研究还发现TGP 可显著降低TNF-α、IL-6、IL-1β 表达水平,与既往研究结果相一致,该结果表明,TGP 可有效抑制AGA大鼠关节炎症反应。
NF-κB 是炎症和能量衰竭的中介,控制促炎因子的产生[1]。IκBα 是NF-κB 抑制剂,在正常状态下,NF-κB 与IκBα 在胞质中相互结合,当炎症发生时,IκBα 快速降解并与NF-κB 分离,NF-κB 转位至胞核内调节促炎因子的转录,从而促进NLRP3 信号通路的激活[1]。NLRP3 是MSU 晶体所诱导的炎症反应的关键因素,因此,阻断其激活或影响其活性可抑制AGA的发生[6-16]。当MSU晶体在关节腔内沉积后,会引发强烈的炎症反应,激活NLRP3 炎症小体和Caspase-1,刺激IL-1β 等炎症体依赖性细胞因子的释放,从而进一步激活免疫细胞释放TNF-α、IL-6 等其他促炎症细胞因子,加重炎症反应[17-18]。NF-κB 信号通路及NLRP3 炎症体轴在AGA 中被激活[19]。研究发现,TGP可通过抑制人肺腺癌转移相关转录本1(metastasis associated in lung denocarcinoma transcript 1),MALAT1/微小RNA 876-5p(microRNA 876-5p,miR-876-5p/NLRP3 抑制MSU 诱导的THP-1巨噬细胞炎症[7]。本研究发现TGP 可显著降低 p-NF-κB p65/NF-κB p65、NLRP3 和Caspase-1 水平,显著提高p-IκBα/IκBα 水平。该结果表明,TGP 可能通过抑制NF-κB/NLRP3 信号通路激活从而降低炎症因子的表达,以此抑制AGA大鼠炎症反应。
综上所述,TGP 可能通过抑制NF-κB/NLRP3 信号通路达到改善AGA 大鼠炎症状态的效果。本研究为TGP 在AGA 疾病治疗机制中的研究提供参考,但关于TGP 在AGA 中是否还通过调控其他通路发挥治疗作用还需进一步探究。

