血管内皮生长因子对子宫内膜异位症大鼠缺氧及炎症微环境的作用机制
陈 慧 刘艳玲 郎茂竹 吴儒佳 (贵州医科大学附属医院妇产科,贵阳 550004)
子宫内膜异位症(endometriosis,EMs)又被称为内异症,是一种常见的妇科疾病,是子宫内膜出现在患者子宫以外的部位而导致的系统性疾病,以痛经、月经不调、性交疼痛、慢性盆腔痛等为主要临床表现,另外EMs 是导致现代女性不孕的重要原因之一,严重影响患者的生活质量、身心健康和家庭幸福[1]。目前该病的主要治疗方法为口服激素类药物和手术,但是长期的药物干预会影响患者的肝肾功能,以及导致患者出现更年期假绝经表现,而手术治疗后又极易复发[2]。因此深入揭示EMs的分子发展机制,寻找可靠的治疗靶点,开发新型药物或治疗措施,在EMs 的临床治疗上具有重要意义。已有研究证实EMs 患者的病灶部位处于持续性的局部性缺氧、缺血、炎症应激等微环境中,缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)和髓过氧化物酶(myeloperoxidase,MPO)等调节因子被激活,促进应激级联放大,最终导致异位内膜细胞的浸润以及增殖[3]。有研究证实EMs患者的病灶周围出现大量的新生腹膜血管,血管新生为异位内膜的黏附、定植以及生长提供足够的物质和能量[4]。血管内皮生长 蛋 白 因 子(vascular endothelial growth factor,VEGF)是机体内血管生成的关键调控因子。张科群等[5]临床研究结果显示,抑制EMs 患者血清中VEGF 的表达,能明显改善患者的临床症状,缓解患者的痛经情况。但是有关VEGF 对EMs缺氧以及炎症微环境影响的报道较少。本研究通过自体内膜移植构建大鼠EMs 模型,探讨VEGF 对疾病中缺氧以及炎症微环境的影响,以期为新药开发提供新的靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 40 只雌性未生育健康SD 大鼠, SPF 级,7~8 周龄,体质量180~220 g,由北京北方艾特生物科技有限公司提供,动物生产许可证号:SCXK(京)2020-0005。在贵州医科大学附属医院适应性喂养1周后用于实验。本研究已获得贵州医科大学附属医院动物伦理委员会批准。
1.1.2 主要试剂 RNA 干扰VEGF(VEGF-siRNA)以及阴性对照VEGF-siRNA-NC 购自北京三元基因工程有限公司;苯甲酸雌二醇(1 ml∶2 mg,上海通用药业股份有限公司,国药准字:H31021114);磷酸盐缓冲液(PBS)、组织裂解液(南京建成生物科技有限公司);兔抗大鼠VEGF、HIF-1α、MPO 抗体(美国 Abcam 公司);Western blot试剂盒、ELISA 试剂盒(北京中杉金桥有限公司)。
1.1.3 主要仪器 RM2235 超薄组织切片机(德国Leica 公司);组织匀浆仪(德国IKA 公司);超低温冰箱(日本SANYO 公司);光镜(上海普赫光电科技有限公司);JEOL-100CX透射电镜(日本电气公司)。
1.2 方法
1.2.1 EMs大鼠模型的复制[6]实验大鼠术前48 h皮下注射4 mg/2 ml 的苯甲酸雌二醇以确保大鼠处在相同的动情周期,禁食不禁水12 h,以戊巴比妥钠将大鼠麻醉后,于腹部行纵切口,暴露右侧子宫,结扎子宫两端血管,分离子宫内膜,将其修剪为4 mm×4 mm的片层结构,并将该片层结构缝合在左腹肠系膜血管丰富的部位,缝合伤口,腹腔注射硫酸庆大霉素,连续5 d 后,再次麻醉大鼠,在异位内膜处可观察到透明囊状结构,并且其表面有血管生成,内里能观察到积液,证明造模成功。
1.2.2 分组处理 实验动物随机分为假手术组、模型组、对照组和实验组,每组10只,假手术组大鼠在造模过程中只进行子宫内膜截取,但不进行内膜移植,每日尾静脉注射VEGF-siRNA-NC,模型组、对照组和实验组大鼠进行造模手术后,每组大鼠每日尾静脉注射VEGF-siRNA-NC,实验组大鼠每日尾静脉注射VEGF-siRNA,每天注射1次,连续注射28 d。
1.2.3 各组大鼠血清指标的检测 在干预处理结束后,麻醉大鼠,腹主动脉采血5 ml,ELISA 检测各组大鼠血清中TNF-α和IL-1β的含量。
1.2.4 各组大鼠异位内膜组织病理学损伤 采血完毕,处死大鼠测量各组大鼠异位内膜体积,无菌操作台上,依次取材,分离各组大鼠的异位内膜组织以及假手术组大鼠的在位内膜组织;经固定,脱水,包埋,切片,脱蜡,水化,苏木精-伊红染色(HE),镜检。
1.2.5 各组大鼠异位内膜组织超微结构改变 将各组大鼠的异位内膜组织以及假手术组大鼠的在位内膜组织于3%戊二醛中固定,1%锇酸固定120 min,无水乙醇、丙酮梯度逐级脱水,包埋,洗涤,超薄切片,铀-铅双染色,透射电镜检测。
1.2.6 样本中差异基因的高通量测序 将假手术组大鼠的在位内膜组织与模型组大鼠的异位内膜组织,对照组与实验组大鼠的异位内膜组织,分别进行高通量测序:提取样本中的总RNA,在测定其完整性后,逆转录合成cDNA,PCR 仪进行扩增,经HiseqTM仪进行测序,ASprofile、Blast、String Tie、DESeq 等软件统计分析差异表达的基因。采用Fold Change筛选差异表达的基因:当|log2(Fold Change)|>1,P<0.05,q<0.05时为差异表达的靶点基因。
1.2.7 PCR 验证各组样本组织中VEGF、HIF-1α、MPO mRNA 表达 取各组大鼠的异位内膜组织以及假手术组大鼠的在位内膜组织,提取样本中的RNA,按要求测定完整性和浓度后,逆转录试剂盒合成cDNA,PCR 仪进行扩增。以GAPDH 为参照物,目的基因相对表达以2-ΔΔCt进行表示。各基因序列见表1。

表1 各基因的引物序列Tab.1 Primer sequence of each gene
1.2.8 Western blot 验证各组样本组织中VEGF、HIF-1α、MPO 的表达 取各组大鼠的异位内膜组织以及假手术组大鼠的在位内膜组织,裂解,离心,常规提取总蛋白,上样,电泳后,经转膜,封闭,加入一抗(1∶1 000),二抗(1∶5 000)稀释后,室温孵育,显色30 min,以GAPDH 为参照,分析目标蛋白的灰度值。
1.3 统计学分析 实验所得数据采用SPSS23.0软件进行统计分析,采用Graphpad 8.0进行作图,对于各组大鼠血清中TNF-α 和IL-1β 含量等符合正态分布的数据采用±s表示,采用单因素方差进行统计分析,两两比较采用LSD 法,统计数据的差异分析通过SNK检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠动情周期的监测 每日上午9:00,通过阴道涂片法监测各组大鼠阴道分泌物的形态变化,观察其动情周期的变化。大鼠处于动情前期时,视野中多为椭圆形上皮细胞,少量白细胞和焦化细胞;大鼠处于动情期时,视野中多为片状上皮细胞,偶见白细胞;大鼠处于动情后期时,视野中出现白细胞、上皮细胞,片状角化细胞,且各细胞数量无明显差异;大鼠处于动情间期时,视野中多为白细胞,间或有少量黏液(图1);在实验过程中,按动情前期-动情期-动情后期-动情间期的顺序出现,顺序一旦紊乱,或大鼠长时间持续处于某一期,视为动情周期紊乱(动情周期紊乱的比例等于处于动情周期紊乱的大鼠的数量与总数量的比值)。
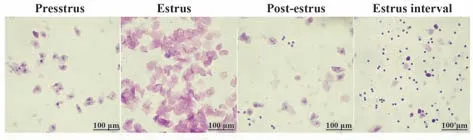
图1 正常动情周期中大鼠阴道分泌物观察(×200)Fig.1 Observation of rat vaginal secretions during normal estrus cycle (×200)
2.2 各组大鼠造模情况、动情周期以及异位内膜体积的比较 在实验过程中,未发生大鼠死亡的现象;假手术组大鼠毛发光亮整齐,精神状态良好,实验过程中,活动量、饮食与进水物未见明显异常,体质量增加明显;模型组与对照组大鼠皮毛杂乱,暗淡,精神倦怠,腹胀明显,双目无神,活动量明显减少,饮水与进食意愿不强烈,体质量增加不明显;实验组大鼠的临床症状较模型组有较大改善,大鼠皮毛较为整齐,精神较好,活动量明显增多。
对各组大鼠的动情周期的监测结果显示:与假手术组相比,在实验过程中,模型组、对照组、实验组大鼠中动情周期紊乱比例明显升高;与对照组相比,实验组大鼠中动情周期紊乱的比例明显降低,差异均具有统计学意义(均P<0.05);对照组与模型组相比,差异无统计学意义(P>0.05),见图2。
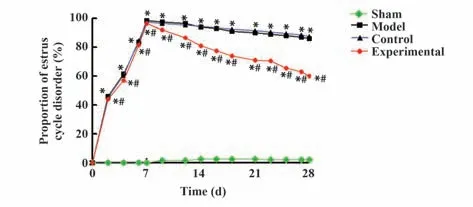
图2 各组大鼠动情周期紊乱情况比较Fig.2 Comparison of disorder of estrous cycle of rats in each group
各组大鼠异位内膜体积检测结果显示:假手术组未进行自体内膜移植,模型组大鼠的腹壁处可见明显的异位病灶,大多呈囊状,内含淡黄色囊液,囊泡表面可见丰富的微血管,病灶部位沿灶点蔓延生长,多为无色透明状,且与周边子宫、盆腔腹膜、卵巢或大网膜组织形成粘连,不易分离。与假手术组相比,模型组、对照组、实验组大鼠中异位内膜体积明显增大;与对照组相比,实验组大鼠中异位内膜体积明显减小,差异均具有统计学意义(均P<0.05);对照组与模型组相比,差异无统计学意义 (P>0.05),见图3。
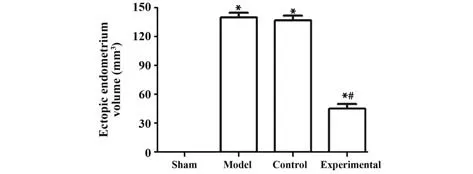
图3 各组大鼠异位内膜体积的比较Fig.3 Comparison of ectopic endometrium volume of rats in each group
2.3 各组大鼠异位内膜组织病理学损伤 HE 染色显示,假手术组大鼠子宫在位内膜组织的上皮细胞排列整齐,成规整的柱状,细胞连接紧密,微绒毛结构清晰可辨,数量丰富,间质以及腺体细胞未见异常;模型组和对照组大鼠的子宫异位内膜组织上皮细胞明显增生,排列松散,间质增生明显,炎症介质大量浸润,新生微血管数量骤增,腺体丢失,胞质内可观察到明显的空泡样变性,内膜变薄。实验组大鼠的子宫异位内膜组织中间质增生数量明显减少,炎症浸润以及血管新生的状况得到明显缓解,见图4。

图4 HE染色(×400)Fig.4 HE staining (×400)
2.4 各组大鼠异位内膜组织超微结构损伤 电镜观察结果显示:假手术组大鼠的在位内膜组织细胞的细胞器均规整地分布在胞浆中,微绒毛结构未见异常;模型组和对照组大鼠的异位内膜组织的上皮细胞具备微绒毛结构,胞浆中的细胞器趋于稳定;实验组大鼠的异位内膜组织的上皮萎缩明显,微绒毛或减少或丢失,胞核固缩,线粒体明显减少,嵴结构趋于模糊,或见凋亡的间质细胞,见图5。
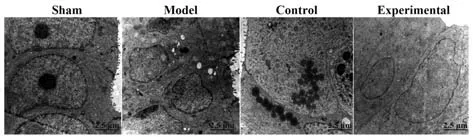
图5 电镜观察结果(×8 000)Fig.5 Results of electron microscope observation (×8 000)
2.5 各组大鼠血清指标的比较 ELISA 试剂盒检测结果显示,与假手术组相比,模型组、对照组、实验组大鼠血清中TNF-α 和IL-1β 含量明显升高;与对照组相比,实验组大鼠血清中TNF-α 和IL-1β 含量明显降低,差异均具有统计学意义(均P<0.05);对照组与模型组相比,差异无统计学意义(P>0.05),见图6。
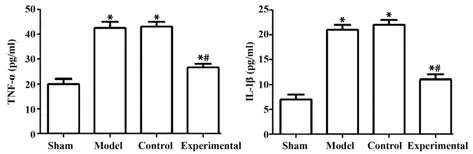
图6 各组大鼠血清中TNF-α和IL-1β的含量Fig.6 Contents of TNF-α and IL-1β in serum of rats in each group
2.6 样本组织中差异基因的高通量测序 高通量测序结果经标准化处理,假手术组与模型组,对照组与实验组数据分别进行比较,筛选出|log2(Fold Change)|>1,P<0.05,q<0.05的差异表达基因,如图7所示,假手术组和模型组之间获得2 487 个差异表达基因,其中413 个为下调基因,2 074 个为上调基因;对照组和实验组之间获得2 258 个差异表达基因,其中307 个为下调基因,1 951 个为上调基因;为找到与干预措施相关的靶点基因,将模型组对比假手术组上调并且实验组对比对照组下调的215个基因,以及模型组对比假手术组下调并且实验组对比对照组上调的193个基因(图8)进行统计分析,结果显示,与假手术组相比,模型组中HIF-1α、MPO 基因的表达明显升高,RNA干扰VEGF的表达后,与对照组相比,实验组中HIF-1α、MPO 基因的表达明显下降,见表2,因此以HIF-1α、MPO 基因作为后续研究的靶点基因。
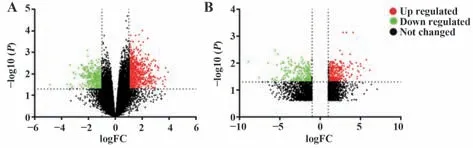
图7 差异表达基因的火山图Fig.7 Volcano map of differentially expressed genes
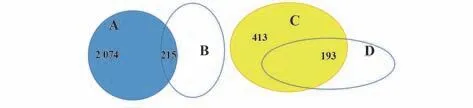
图8 各组交集基因的韦恩图Fig.8 Venn diagram of overlapping genes of each group
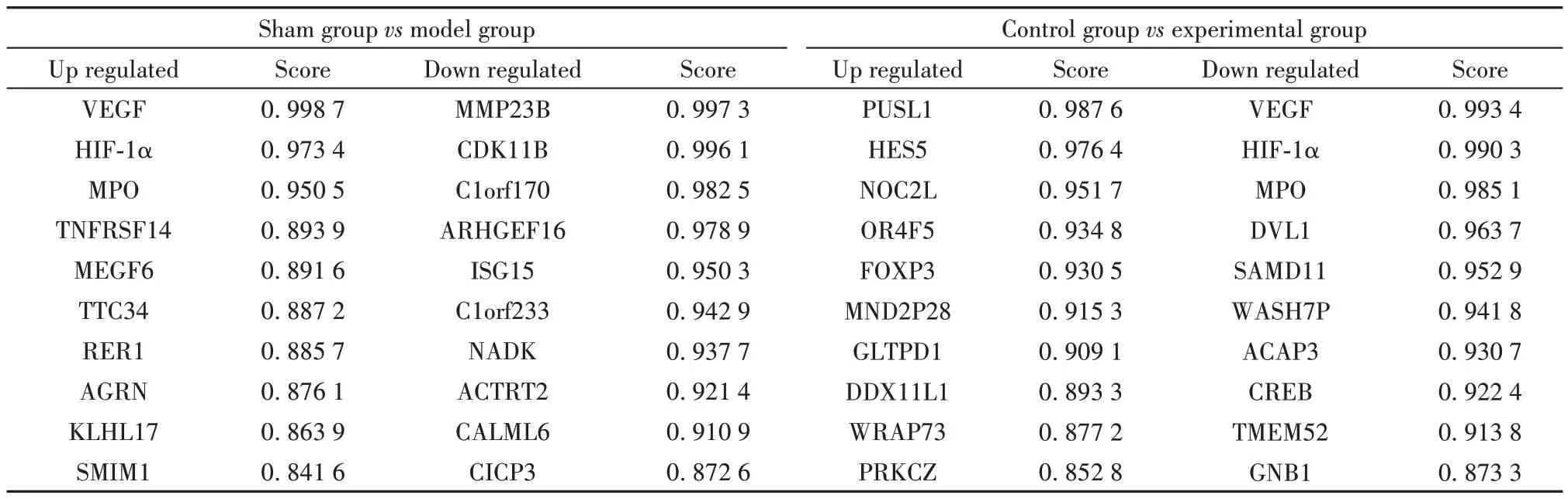
表2 Top 10基因(上调和下调表达)Tab.2 Top 10 genes (up-regulated and down-regulated)
2.7 各组样本组织中VEGF、HIF-1α、MPO mRNA表达 PCR 结果显示,与假手术组大鼠的在位内膜组织相比,模型组、对照组、实验组大鼠异位内膜组织中VEGF、HIF-1α、MPO mRNA 表达明显升高;与对照组相比,实验组大鼠异位内膜组织中VEGF、HIF-1α、MPO mRNA 表达明显降低,差异均具有统计学意义(均P<0.05);对照组与模型组相比,差异无统计学意义(P>0.05),见图9。
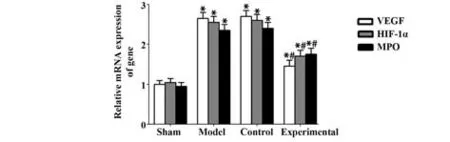
图9 样本组织中VEGF、HIF-1α、MPO mRNA表达Fig.9 mRNA expressions of VEGF, HIF-1α and MPO in sample tissues
2.8 各组样本组织中VEGF、HIF-1α、MPO 蛋白表达 Western blot 结果显示,与假手术组大鼠的在位内膜组织相比,模型组、对照组、实验组大鼠异位内膜组织中VEGF、HIF-1α、MPO 蛋白表达明显升高;与对照组相比,实验组大鼠异位内膜组织中VEGF、HIF-1α、MPO 蛋白表达明显降低,差异均具有统计学意义(均P<0.05);对照组与模型组相比,差异无统计学意义(P>0.05),见图10。

图10 样本组织中VEGF、HIF-1α、MPO的表达Fig.10 Expressions of VEGF,HIF-1α and MPO in sample tissues
3 讨论
近来随着人们生活方式的变化,宫腔镜、人工流产术、剖宫产术等技术的广泛应用,使具有生长性能的子宫内膜出现在子宫腺体以外部位的概率升高,EMs的发病率随之逐年升高,该病的临床表现呈现多样性,不具典型的复杂性,且极易反复发作,使其成为妇科领域的疑难病之一,给患者的健康生活带来严重挑战。该病的发病机制较为复杂,影响因素较多,分子机制尚处在实验研究阶段,临床上尚缺乏根治性的治疗措施[7]。因此从分子机制入手,探讨疾病的发生、发展,对于疾病的新药开发以个体化靶向干预具有重大意义。
子宫内膜异位定植于腹腔壁并进行增殖、生长的过程需要充足的营养物质保障,而营养物质以及能量的代谢与交换依赖于微血管的生成,因此血管新生是EMs 病程中关键事件,VEGF 是体内促血管新生的特异性最高的调控因子,VEGF 能较大幅度地增强血管内皮细胞的通透性,促进血管内皮细胞的增殖、黏附、运动等生物学行为,最终导致血管新生[8]。SONG 等[9]研究证明在乳腺癌细胞中抑制VEGF 的表达,能明显抑制肿瘤细胞血管新生的能力,下调癌细胞转移与侵袭的性能。WANG 等[10]临床研究发现在先兆性子痫的患者血清中,VEGF 的表达明显升高,细胞体外血管生成的能力随之升高。ARABLOU 等[11]研究表明VEGF 在EMs 中表达升高,下调VEGF 的表达能明显改善EMs的进展,但未探讨其中的作用机制。本研究构建EMs 大鼠模型后,采用RNA 干扰VEGF 的表达后,实验组大鼠的动情周期紊乱比例、异位内膜体积等临床症状明显下调,异位内膜组织的损伤以及超微结构的损伤明显加剧,证实这一干预技术对EMs的治疗效果。
EMs 的起病、发展与患者腹腔内的微环境密不可分。在正常状态下,经血逆流进入患者腹腔时会被即时清除,但是子宫内膜发生异位时,往往出现局部缺血、缺氧的状况形成其独特的微环境,并且异位子宫内膜细胞可激活腹腔内的靶细胞(如巨噬细胞、中性粒细胞以及树突状细胞等)分泌并释放TNF-α和IL-1β等促炎因子,以致患者腹腔内出现缺氧炎症性微环境[12]。HIF-1α 是机体内缺氧环境的关键调控因子,直接参与EMs 的深入浸润以及定植;MPO 是细胞进行炎症应激的关键调节酶,负责将EMs 的炎症应激级联放大[13]。高通量测序技术因其灵敏度高、特异性强的优势广泛用于疾病靶点基因的筛选中[14]。本研究的高通量测序结果显示HIF-1α、MPO 基因是进行RNA 干扰VEGF 后的靶点基因,Western blot 验证显示与假手术组大鼠的在位内膜组织相比,模型组、对照组、实验组大鼠异位内膜组织中HIF-1α、MPO 明显升高,与对照组相比,实验组大鼠异位内膜组织中HIF-1α、MPO 明显降低;ELISA 试剂盒检测结果显示RNA 干扰VEGF 后,患者血清中TNF-α和IL-1β含量明显下降。
综上所述,RNA 干扰VEGF 的表达后能明显抑制HIF-1α、MPO 的表达,改善EMs 大鼠腹腔的缺氧和炎症微环境,但是如何将这一发现用于临床上EMs 的治疗,仍需结合患者的个体状况进行更为深入、系统的研究。

