盐酸二甲双胍片体外溶出一致性评价
房 静,李志万
(1.天津生物工程职业技术学院,天津 300462;2.天津药业研究院股份有限公司,天津 300384)
降糖药盐酸二甲双胍,最初由百时美施贵宝开发,于1957年在法国首次上市,并将“格华止”作为其商品名。在此后的60余年里,二甲双胍始终作为治疗Ⅱ型糖尿病的经典用药。随着研究的不断深入,后续又研发出多种二甲双胍复方制剂,并在糖尿病的临床治疗上发挥着确切疗效。同时,二甲双胍还有一系列其他的治疗作用,如抗癌细胞增殖、改善记忆障碍、治疗DENV等[1-3]。20世纪90年代二甲双胍开始国产,目前国内厂家众多,有100多个批号,但产品质量参差不齐。本文建立了二甲双胍的体外溶出测定方法,采用 f2 相似因子法考察了自制盐酸二甲双胍片于参比制剂在不同 pH值溶出介质中的溶出行为,评价了二者的体外溶出一致性。
1 仪器与材料
1.1 仪器
LC-10AT型 、LC-2010A型、LC-20A型高效液相色谱仪(均为日本岛津);Shimadzu LC solution色谱工作站(日本岛津);Thermo BioBasic SCX 250×φ4.6 mm 色谱柱(Welch vitimate),4.6 mm×150 mm 的C18硅胶柱,5 μm;RD12AD溶出仪(天大天发);Tision®Elite 8 TM溶出仪(美国Hanson);UV-2401紫外分光光度计(日本岛津); AE240电子天平(梅特勒-托利);PHS-3E pH酸度计(上海奥豪斯)
1.2 材料
磷酸二氢铵、磷酸(分析纯,天津市风船化学试剂),十二烷基硫酸钠(化学纯,天津市永大化学试剂),乙腈(色谱纯,天津市康科德科),盐酸二甲双胍仿制片(规格:250 mg,天津康瑞药业有限公司提供),纯化水,盐酸二甲双胍片参比制剂(规格:250 mg,日本新药株式会社)。
2 方法与结果
2.1 溶液制备
对照品溶液制备:取盐酸二甲双胍的对照品,精密称定后,用溶出介质溶解并定量稀释制成 30 μg/mL 的溶液。
供试品溶液制备:取自制片,按照制定的溶出方法,经 15 min 后,取适量溶液,过滤,弃去初滤液 10 mL,精密量取续滤液适量,定量稀释制成 5 μg/mL 的溶液。
空白溶液制备:取不同 pH 值溶出介质的相应样品溶液作为空白溶液。
2.2 溶出条件选择
2.2.1 测定方法选择
参考日本橙皮书《普通口服固体制剂溶出曲线测定与比较指导原则》中盐酸二甲双胍片的溶出度方法和中国药典2020版中盐酸二甲双胍片项下溶出度的方法,结合本品的特点进行方法学试验。
任取各批片剂12片,取溶出介质 1000 mL,设转速为 50 r/min,依法操作,经5、10、15、20、30、45 min 分别取样 10 mL,过滤,取续滤液备用,同时向溶出杯中补充 10 mL 溶剂。精密量取续滤液适量,用溶出介质定量稀释制成 5 μg/mL 的溶液,采用紫外-可见分光光度法,在 233 nm 的波长处测定吸光度;另取对照品,精密称定,加溶出介质制成 5 μg/mL 的溶液,同法测定,计算每片在各点溶出量[4-6]。
2.2.2 溶出方法选择
对比《中国药典》2020年版溶出度与释放度测定的第一法和第二法,采用 1000 mL pH4.0 醋酸缓冲液为溶出介质,转速:桨法 50 r/min,篮法 100 r/min。取样点为:5、10、15、30 min;篮法和浆法在各取样点的溶出度分别如表1所示。参考上述结果,同时考虑参比制剂也是采用桨法,所以采用桨法能更好地控制质量[5-7]。

表1 不同溶出方法的释放度测定结果 %
2.2.3 溶出介质的选择
参考日本溶出度橙皮书中的方法,分别以盐酸溶液(pH1.2)、醋酸盐缓冲液(pH4.0)、磷酸盐缓冲液(pH6.8),以及水为介质进行比较,转速设为 50 r/min,溶剂 1000 mL 进行试验。结果见表2。

表2 4种不同pH介质中的溶出度测定结果 %
综上,4种溶出介质都可以在 15 min 达到溶出度在85%以上,故采用检测成本比较低的水比较合适。
2.3 方法学考察
线性关系考察:以pH4.0、pH6.8两种缓冲液和水为溶出介质,称取对照品约 5 mg,置于 100 mL 容量瓶中,超声溶解稀释摇匀得对照品溶液。分别量取1、1、1、1、2 mL 溶液至100、50、25、10、10 mL 的容量瓶中,加溶出介质稀释定容,在 233 nm 紫外测定,记录谱图,以样品的质量浓度为横坐标(X,μg/mL),峰面积为纵坐标(Y)做线性回归,分别得到回归方程Y=0.078X-0.004,r=0.9995(n=5),Y=0.080x+0.003,R=0.9995(n=5)和Y=0.080X+0.005,r=0.9995。结果表明,在0.553~11.06 μg/mL 之间,盐酸二甲双胍的质量浓度与峰面积二者之间线性关系良好。
当溶出介质为pH1.2盐酸缓冲液时,称取对照品约 10 mg,置 100 mL 容量瓶中,制成对照品溶液。分别量取1、1、1、3、5 mL 至100、25、10、10、10 mL 的容量瓶中,同法操作,得到回归方程为Y=0.017X+0.009,r=0.9995(n=5)。由结果可知,在1.099~54.95 μg/mL 之间,盐酸二甲双胍质量浓度与峰面积二者之间线性关系良好。
2.4 稳定性试验
分别以水、pH1.2、pH4.0、pH6.8的4种溶出介质,取溶出度测定项下的样品溶液分别放置 24 h,定时取样测定,RSD分别为0.38%、0.326%、0.99%和1.16%。由结果可知,溶液在 24 h 内稳定。
2.5 加样回收试验
精密称取质量62.5、100和 125 mg 的原料(标示量50%、80%和100%),分别置于 500 mL 容量瓶之中,加入 18 mg 处方辅料药,加水超声溶解并稀释摇匀、滤过,精密量取续滤液 1 mL 置 50 mL 的容量瓶之中稀释摇匀,经 0.45 μm 滤膜过滤,233 nm 紫外测定。在四种溶出介质中测得的回收率(RSD)分别为99.70%(0.79%)、99.32%(0.36%)、100.17%(0.50%)、100.22%(0.92%),表明该方法回收率符合要求。
2. 6 溶出一致性评价
仿制和原研药溶出曲线相似性的比较本文采用相似因子(f2)法。将两者平均溶出量与进行比较,当f2值高于50,或受试与参比制剂在 15 min 内的溶出量≥85%时,可判定为两者溶出行为相似。平均溶出量为12片(粒)的均值,结果如表3所示。
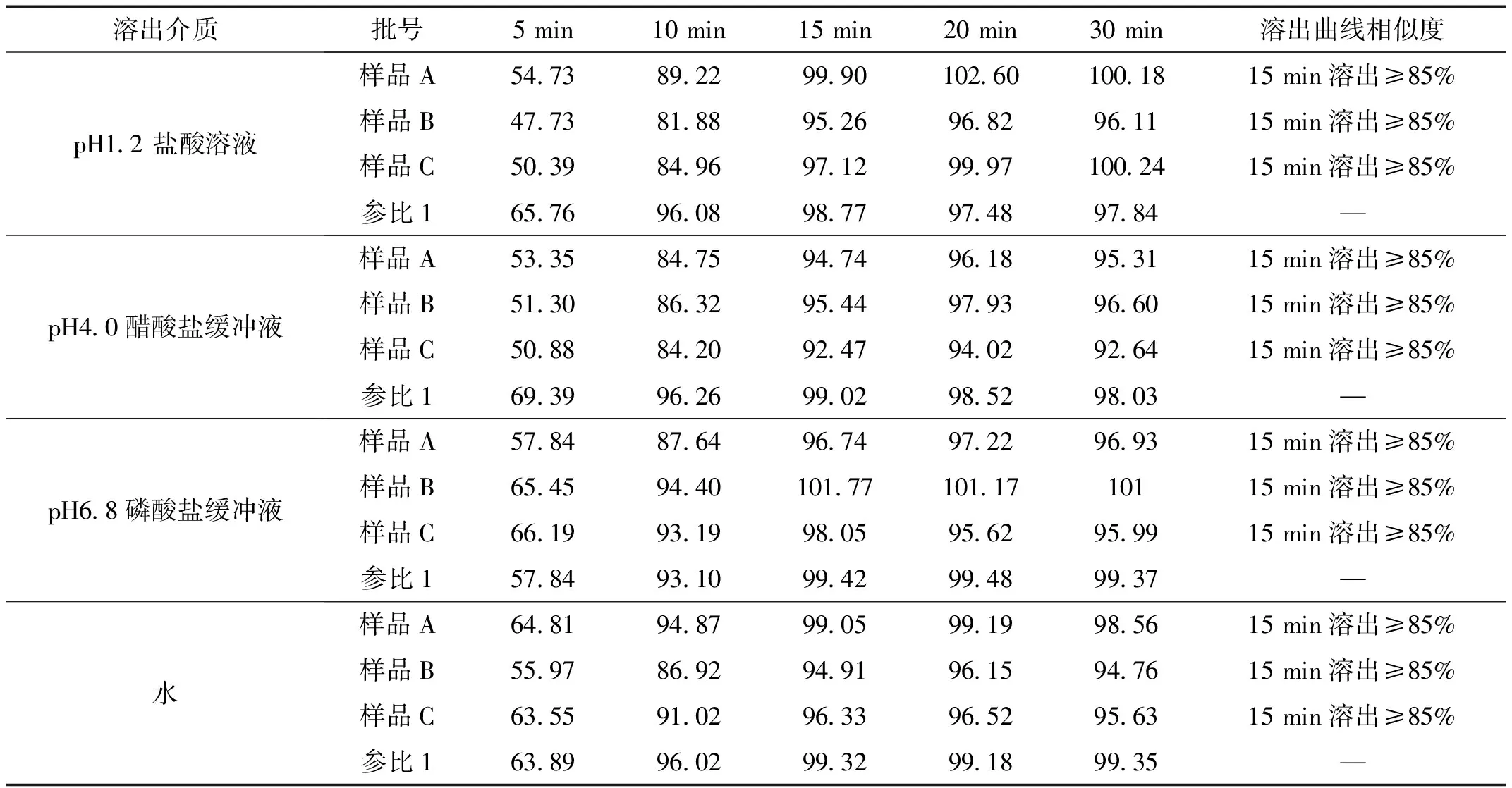
表3 仿制制剂与参比制剂溶出曲线相似性比较结果
从表3可知,在4种不同pH值溶出介质中,三批次仿制片与参比制剂的溶出量RSD在第一个取样时间点均≤20%,在其余取样时间点均≤10%,且两者在 15 min 内的溶出量均≥85%,可以做出两者溶出行为相似的判断,两者具有体外溶出曲线一致性[10-12]。4种溶出介质中的溶出曲线比较如图1所示。

图1 仿制制剂和原研制剂在4种溶出介质中的溶出曲线
2.7 有关物质检查
有关物质的测定根据中国药典2020版盐酸二甲双胍片项下关物质的色谱条件和系统适应性试验进行。利用高效液相色谱法分别测定三批参比制剂及自制制剂的有关物质,结果如表4。表4表明,有关物质测定结果符合规定,其分离度和理论塔板数均能达到要求[13-15]。

表4 盐酸二甲双胍仿制药与原研药有关物质含量测定结果
2.8 含量测定
参考日本药局方2017版盐酸二甲双胍项下含量测定的方法,采用HPLC法对样品进行含量测定。测定结果如表5所示,均符合质量标准的要求。

表5 含量测定结果
3 结论
溶出曲线的相似性并不能代表仿制与原研药之间一定生物等效,但能降低临床疗效差异出现的风险,为二甲双胍片的安全性、有效性提供一定保证。本文选择了3批原研盐酸二甲双胍片和三批仿制片, 在pH1.2、pH4.0、pH 6.8和水4种不同溶出介质进行溶出试验,并考察建立适合的溶出曲线测定方法,从相似性评价结果得出,仿制药盐酸二甲双胍片样品(0.25 g)与日本新药株式会社生产的盐酸二甲双胍片(250 mg)具有体外质量一致性。

