基于UPLC-MS 法及网络药理学预测紫红参质量标志物
林 源,朱雪艳,黄豆豆,黄宝康,王宏瑞,卜其涛*,张成中*
(1.温岭市中医院,浙江 温岭 317500; 2.中国人民解放军海军军医大学药学系,上海 200433; 3.上海中医药大学中药研究所,上海 201203)
人参Panax ginsengC.A.Meyer 是传统的名贵补益中药,始载于《神农本草经》,其炮制方法及炮制工艺众多,形成生晒参、红参、糖参等。紫红参又称黑参,其制备工艺主要有生物发酵法和多次蒸晒法[1-2],在加工炮制过程中,其有效成分人参皂苷等发生水解、脱羧、异构化等[3]变化。经测定,生人参中含量较高的人参皂苷Rb1、Rg1、Re 等在紫红参中无法检出或含量降低[4],稀有皂苷如人参皂苷Rg3、Rg5、Rg6 等含量升高[5-7]。研究发现,紫红参相比生晒参、红参具有更好的降血糖[8]、降血脂[9]、减肥[10]、抗癌[11]、保肝[12]、抗病毒[13]等作用。中药炮制“生熟异用”,紫红参与生晒参、红参在化学成分及药理作用上具有差异,其质量控制、药理作用也应有别于红参等。目前,紫红参的炮制工艺尚无统一标准,质量控制、活性成分、药理作用等方面尚有较大的研究空间[14]。刘昌孝院士提出中药质量标志物(Q-marker)的新概念[15],中药Qmarker 从生源途径、化学物质基础、炮制加工过程、药效研究、中医理论等层面,将中药物质基础、有效性、质量控制密切关联。本实验采用UPLC-Q/TOF-MS 法测定紫红参及其原料药人参之间的化合物差异,通过多元统计分析解析炮制对人参皂苷种类的影响,鉴定紫红参中差异性稀有皂苷,基于网络药理学[16]与分子对接[17]技术对所鉴定的差异化合物进行验证,研究紫红参差异化合物的药理活性及其作用机制,预测紫红参潜在Q-marker,以期为紫红参后续研究奠定基础。
1 材料
1.1 仪器 1290 UPLC 型液相色谱仪串联6530 Q/TOF 型高分辨质谱(美国安捷伦公司);SK7200H 型超声波清洗器(上海科导超声仪器有限公司);RH-600A 型高速多功能粉碎机(江苏荣洁医疗科技有限公司);XS105DU 型电子天平(瑞士梅特勒-托利多公司);Centrifuge5810R 型高速台式冷冻离心机(德国Eppendorf 公司);电蒸锅(浙江苏泊尔股份有限公司);鼓风式干燥箱(上海般诺生物科技有限公司)。
1.2 试剂与药物 人参购于亳州市药材市场,经海军军医大学生药学教研室黄宝康教授鉴定为正品。乙腈、甲醇为色谱纯,购自德国Merck 公司;甲酸为色谱纯,购自美国Thermo Fisher 公司;水为蒸馏水,购自广州屈臣氏食品饮料有限公司。
2 方法
2.1 紫红参炮制前后成分差异分析
2.1.1 UPLC-MS 条件
2.1.1.1 色谱 Acquity UPLCBEH-C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相0.1%甲酸(A)-0.1%甲酸乙腈(B),梯度洗脱(0~5 min,5%~23% B;5~9 min,23%~30% B;9~13 min,30% B;13~13.55 min,30%~35%B;13.5~17 min,35%B;17~17.5 min,35%~39%B;17.5~20 min,39% B;20~26 min,39%~95% B);柱温35 ℃;体积流量0.3 mL/min;进样量2 μL。
2.1.1.2 质谱 电喷雾离子源(ESI),正、负离子模式扫描;毛细管电压4 000 V(正离子模式)、3 500 V(负离子模式);锥孔电压65 V;脱溶剂气体氮气;气体体积流量11 L/min;脱溶剂温度350 ℃;离子源温度150 ℃;扫描范围m/z100~1 700;扫描时间3.00 spectra/s;碰撞能量30 eV;碰撞气体氮气;扫描方式allionfragment 模式。质谱数据采集及处理软件Masshunter 工作站。
2.1.2 供试品制备 取人参6 批,各分成2 份,1 份净制,另1 份经九蒸九晒制成紫红参。各取人参、紫红参粉碎,过三号筛,精密称取粉末50 mg,置于5 mL EP 管中,加入2 mL 80%甲醇,常温下超声处理(50 kHz,760 W)30 min,放冷,14 000 r/min 离心15 min,取上清液,即得。
2.1.3 多元统计分析 查阅并整理归纳国内外文献关于人参化学成分的信息,包括名称、分子式、结构式,并将所有信息导入Masshunter 软件中,创建人参专属数据库。将allionfragment 模式下采集的原始质谱数据导入Masshunter软件中,用所建立的分析方法对人参化学成分进行自动识别,得到初步的化合物鉴定结果,进一步运用Masshunter软件对正离子与负离子模式下的总离子流(TIC)进行处理,结合目标化合物特征离子的精确质量数、相对保留时间、分子式、对照品信息以及相关报道的文献,进行人工识别并确定。
将采集的原始质谱数据进行格式转化(RAW 格式转化成ABF 格式),MS-DIAL 软件可以基于转化后的ABF 格式进行数据的预处理,参数设置为保留时间0.5~25 min;扫描范围m/z100~1 700;MS1 质量误差0.01 Da;MS2 质量误差0.02 Da;最低峰高5 000。采用SIMCA-p14.1 软件对数据进行多元变量统计分析。将MS-DIAL 软件处理后得到的归一化数据,以Excel 格式导入SIMCA-p14.1 软件中,依次进行主成分分析(PCA)、偏最小二乘法判别分析(PLS-DA);根据两组之间t检验得出的P值(P<0.05)进行差异化合物筛选。
2.2 质量标志物作用靶标及网络药理学预测 根据UPLCMS 分析结果选择紫红参中特有而人参中不具有的化合物,再通过PubChem 数据库查询相关化合物Canonical SMILES编号,输入Swiss Target Prediction 数据库(http:/ /www.swisstargetprediction.ch/)获取化合物所对应的靶标蛋白的Uniprot ID。再将其导入在线STRING 11.0 数据库软件(https:/ /string-db.org/cgi/input.pl)进行PPI 网络分析。利用Metascape 数据库(https:/ /metascape.org/gp/index.html)对潜在的靶点进行基因本体(GO)功能和基因组百科全书(KEGG)通路富集分析。最后通过Cytoscape 3.8.2软件,筛选核心靶标,并构建“成分-靶标-通路” 网络关系综合分析结果。
2.3 差异成分-靶标分子对接 通过PubChem 数据库选取人参皂苷Rg3、Rg5、Rh3、Rk1、compound K 等成分化合物结构,选取“成分-靶点-通路” 网络中自由度前3 的靶标为对接靶标,检索PDB 数据库(http:/ /www.rcsb.org/)获得靶标的蛋白结构,将上述蛋白与化合物结构文件导入pymol 软件进行去水、加氢、删除重复链等预处理,最后模拟靶标和作用的化学成分结合模式,计算结合能,结合能小于0 表明可以自由结合[17]。
3 结果
3.1 基于UPLC-MS 的紫红参特有成分分析
3.1.1 多元统计分析炮制对成分的影响 取“2.1.2” 项下人参及其炮制品紫红参供试品溶液,在“2.1.1” 项条件下进样测定,得到正、负离子模式下人参及其炮制品紫红参代表性样品总离子流图(图1)。结果显示,紫红参相对于其原药材人参,成分变化较明显,在长时间段出现新的化合物峰。进一步比较人参生品与紫红参炮制品之间的区别,通过无监督PCA 分析和有监督PLS-DA 分析,得分散点图见图2,结果显示,生品、炮制品能得到较好的分离趋势,说明人参经九蒸九晒制成紫红参后其化学成分发生显著变化。

图1 人参、紫红参UPLC-MS 检测总离子流图(TIC)

图2 炮制前后人参药材的PCA 得分图
3.1.2 紫红参差异化合物鉴定 共鉴定10 个差异性化合物,包括稀有皂苷人参皂苷Rg5、人参皂苷Rk1、compound K、人参皂苷Rh3 等,见表1。

表1 紫红参差异性化合物鉴定
3.2 基于网络药理学的紫红参质量标准物预测
3.2.1 紫红参潜在质量标志物作用靶标筛选 根据
“3.1.2” 项下化合物鉴定结果,结合紫红参中英文文献研究,选择紫红参中含有而其原料药人参中所不具有或含量甚微的化合物人参皂苷Ra1、人参皂苷Rg3、人参皂苷Rg5、人参皂苷Rk1、姜状三七苷R1、compound K、人参皂苷Rh3、人参皂苷Rs5[7]等,获取其所对应的靶标蛋白的Uniprot ID,去除重复,共得到158 个潜在靶点。“紫红参-成分-潜在靶点” 可视化网络图见图3,网络中包括167个节点和262 条边,平均节点度值3.138。节点的度值代表与该节点相连的边的数量,节点的度值越大,该节点在图中的大小也就越大,颜色也越深。

图3 基于潜在质量标志物构建的“紫红参-成分-靶点” 网络图
3.2.2 化合物蛋白-蛋白相互作用网络构建 将8 个化合物筛选出的158 个靶点进行PPI 网络分析,选择物种为“Homo sapiens”,蛋白交互参数评分值为“high confidence>0.9”,隐藏网络中无联系的节点,其余参数设置不变,获得化合物靶点PPI 网络图(图4),共获得91 个节点,347条边,平均节点度为7.63,预期边数117,PPI 富集P值<1.0×10-16。再对PPI 网络进行拓扑属性分析,计算选取间隔度、亲密度、自由度值3 个重要拓扑参数,共筛选24 个网络参数大于均值(218.8、0.003、7.93)的核心靶标(图5),包括原癌基因(JUN)、信号传导与转录激活因子3(STAT3)、血管内皮生长因子A(VEGFA)、表皮生长因子R(EGFR)、基质金属蛋白酶2(MMP2)、丝裂原活化蛋白激酶1、3、8(MAPK1、MAPK3、MAPK8)等。
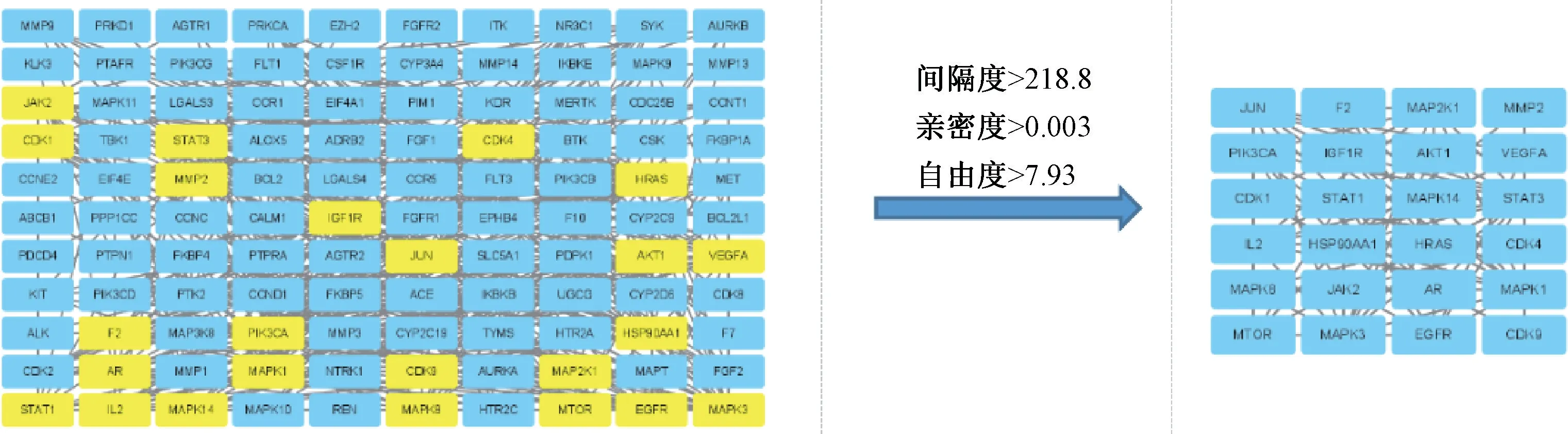
图5 核心靶点筛选
3.2.3 GO 功能和KEGG 通路富集分析 根据错误发现率(FDR)<0.05,共筛选出2 973 条GO 本体条目,其中靶点经生物过程相关条目2 464 条,主要涉及转移酶活性的正调控、蛋白质磷酸化的正调控、细胞对有机氮化合物的反应等;细胞组分有233 个条目,主要涉及膜筏、膜微区、细胞-基底连接等;分子功能有276 个条目,主要涉及蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性、蛋白激酶活性、磷酸转移酶活性、激酶活性等,各选取显著性前10 条目展示,见图6。KEGG 通路富集分析得到247 个条目,结果仅显示显著性前20 的条目,主要涉及癌症通路、糖尿病并发症中的AGE-RAGE 信号通路、癌症中的PD-L1 表达和PD-1 检查点通路、催乳素信号通路、ErbB 信号通路、胰腺癌、乳腺癌、乙肝等,见图7。

图6 GO 富集分析
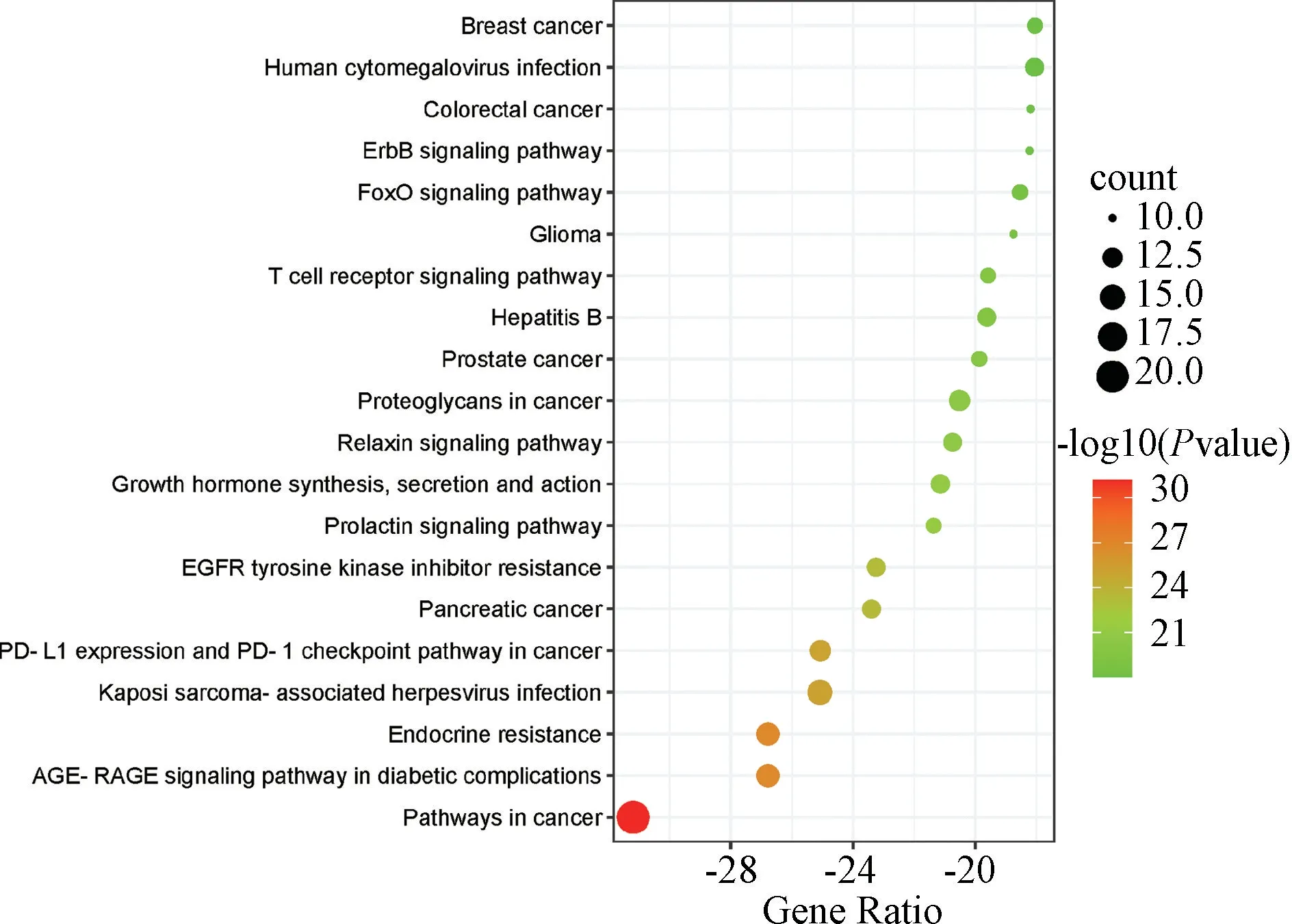
图7 KEGG 富集分析
3.2.4 构建“紫红参-成分-靶标-通路” 关联网络 根据筛选所得紫红参中8 个潜在质量标志物作用与疾病相关的24个关键靶标及20 个关键通路见表2,“紫红参-成分-靶标-通路” 的关联网络图见图8,其中包括53 个节点和472 边,平均节点度值17.8。节点的度值代表与该节点相连的边的数量,节点的度值值越大,该节点在图中的大小也就越大,颜色也越深。由图 8 可知,STAT3、Akt1、MAPK1、MAPK3、EGFR、HRAS、PIK3CA 等靶点的连接度较高,可能是紫红参发挥作用的关键靶点;癌症通路、糖尿病并发症中的AGE-RAGE 信号通路、癌症中的PD-L1 表达和PD-1检查点通路、催乳素信号通路、ErbB 信号通路等20 条信号通路可能是紫红参发挥药理活性的关键信号通路。

图8 “紫红参-成分-核心靶点-通路” 网络图

表2 紫红参网络预测关键信号通路
3.3 成分-靶标的分子对接 选择度值排名前3 的核心靶点(STAT3、PTAFR、FGF1)与主要差异性化合物进行分子对接,以厄达替尼Erdafitinib 为阳性对照药,选取最低结合能组合,见表3。结果表明,人参皂苷Rg3、Rg5、Rh3 等与3个靶蛋白具有较强的结合能力,见图9,其中结合能越小,则结构稳定性越强,对接的活性越好。
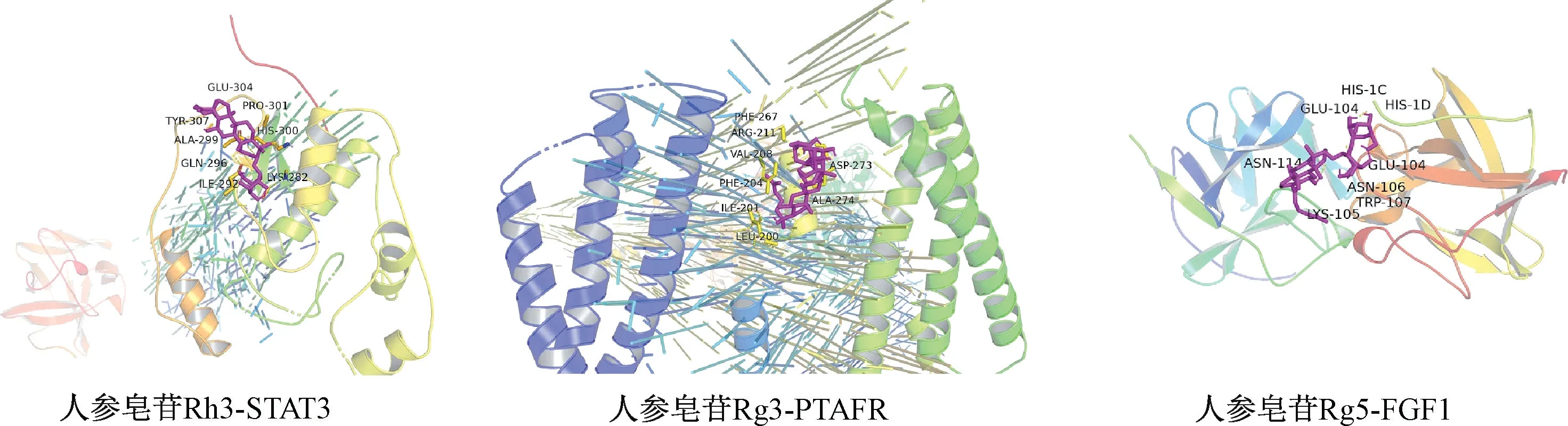
图9 差异成分-关键靶标分子对接可视化
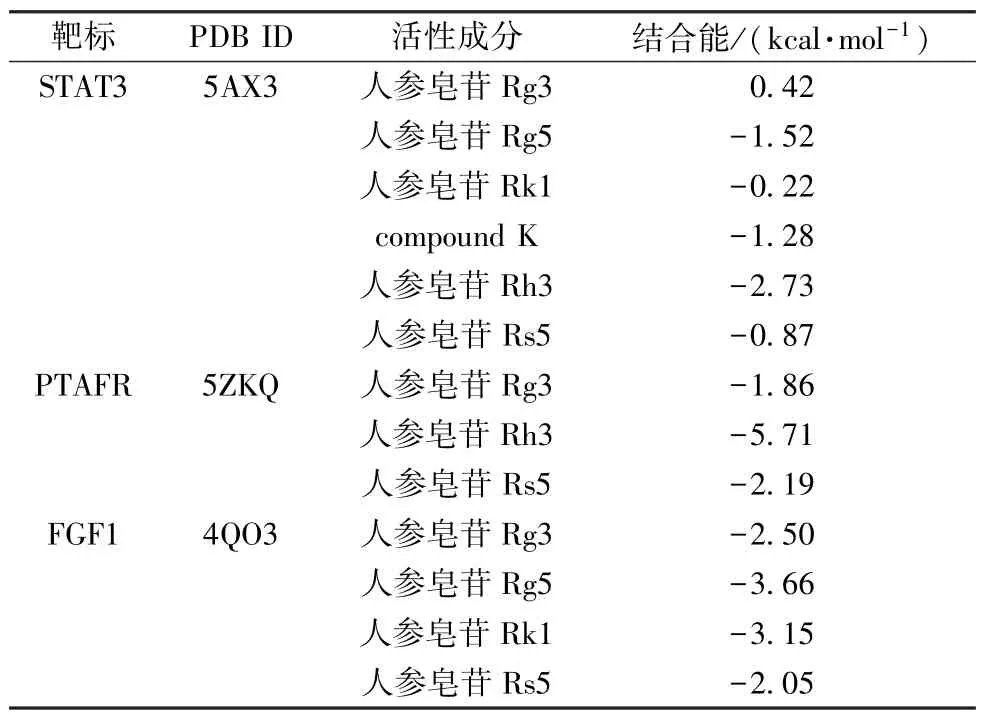
表3 成分-靶标分子对接结果
4 讨论与结论
经UPLC-Q/TOF-MS 检测及多元统计分析解析发现,紫红参中人参皂苷Ra1、人参皂苷Rg3、人参皂苷Rg5、人参皂苷Rk1、姜状三七苷R1、compound K、人参皂苷Rh3 等为其原料药人参中所不具有或含量甚微的稀有皂苷类成分。人参经反复蒸晒,人参皂苷发生水解、脱羧、异构化等复杂的化学变化后,转化或产生新的人参皂苷,如Rg3、Rg5、Rs4、Rs5、Rh2、Rh3、Rk1、Rk3、CK、F1 等[7,18],其中人参皂苷Rg3[19]、Rg5[20]、Rk1[21]、Rh2[22]、Rh3[23]、CK[24]等具有显著药理活性。结合网络药理学及分子对接技术预测紫红参潜在的Q-Marker,将中药Q-Marker 的研究思路与紫红参的炮制相结合,阐明炮制过程中化学成分的变化及其对炮制前后药理活性差异的影响,揭示紫红参炮制对Q-Marker 的影响,探寻紫红参潜在的Q-Marker[25]。
本实验在UPLC-MS 鉴定的基础上选择差异性化合物人参皂苷Rg3、Rg5、Rh3 等,分别构建“紫红参-成分-靶点”及“紫红参-成分-核心靶点-通路” 关系网,经GO、KFGG富集分析,发现紫红参可通过调控相关靶点,包括STAT1、VEGF、EGFR、MAPK1、磷脂酰肌醇-3-激酶亚基(PIK3CA)、蛋白激酶(Akt1)、雷帕霉素机械靶蛋白(MTOR)等24 个核心靶点,作用于癌症通路、内分泌抵抗糖尿病并发症中的AGE-RAGE 信号通路、催乳素信号通路等。
有研究发现,人参皂苷Rg3 可能通过抑制PI3K-Akt 信号通路,调控其下游相关增殖和凋亡蛋白的表达,抑制宫颈癌HeLa 细胞增殖并促进其凋亡[26]。人参皂苷Rh2 可以通过竞争性结合EGFR 而阻止受体磷酸化,从而抑制PI3KAkt-mTOR 信号通路,并最终抑制胶质细胞瘤生长[27]。人参皂苷Rg5 可通过抑制Akt 信号通路的活化,抑制癌细胞增殖、侵袭、迁移并诱导细胞周期阻滞和凋亡,进而发挥抗肿瘤作用[28-29]。同样,人参皂苷Rk1 能够通过抑制ROSPI3K-Akt 信号通路诱导乳腺癌细胞死亡[30];人参皂苷CK的抗癌及降糖作用也与PI3K-Akt 信号通路有关[24]。本研究表明,紫红参中差异性人参皂苷Rg3、Rg5、Rk1、Ck 等对Akt、EGFR、PI3K、mTOR、STAT 等蛋白产生作用,通过PI3K-Akt-mTOR 信号通路、癌症通路等表现出抗乳腺癌、结肠癌、胰腺癌、肝癌等药理活性,与本实验中网络药理学及分子对接的预测相符合,人参皂苷Rg3、Rg5 等具有紫红参潜在质量标志物的特性。
本研究所筛选差异性化合物可以作为紫红参潜在的QMarker,可为紫红参后续药理作用及质量控制研究提供基础,有助于提高人参炮制产业的发展。

