2023年高考化学模拟试题A卷
■江西师范大学附属中学 徐 丹
可能用到的相对原子质量:H 1 Li 7 O 16 C 12 Cl 35.5 Co 59
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与科技、生活密切相关。下列说法正确的是( )。
A.医用消毒酒精能氧化新型冠状病毒中的蛋白质
B.向河水中投入明矾,可除去许多杂质并杀灭有害细菌
C.高纯硅可以用于制作光感电池
D.石墨烯是一种二维碳纳米材料,属于有机高分子材料
2.NA代表阿伏加德罗常数的值,下列叙述正确的是( )。
A.2.6g Na3H与足量1H2O反应,生成的氢气中含有的中子数为0.1NA
B.含有0.1NA个阴离子的Na2O2和CO2完全反应转移0.1 mol电子
C.2 mol NO与O2在密闭容器中充分反应后分子数为2NA
D.标准状况下,4.48 L新戊烷中所含C—H键的数目为2.4NA
3.下列离子方程式书写正确的是( )。
A.漂白粉溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O══CaSO4↓+Cl-+2HClO
B.饱和Na2CO3溶液与CaSO4固体反应
C.FeCl3溶液与足量H2S溶液反应:2Fe3++3H2S══2FeS↓+S↓+6H+
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使沉淀完全:3Ba2++6OH-+2Al3++══3BaSO4↓+2Al(OH)3↓
4.X、Y、Z、W为短周期主族元素,原子序数依次增大,其中X为形成化合物种类最多的元素,Y原子核外有3个未成对的电子,Z形成的一种氧化物的结构如图1所示,且Z在足量W中燃烧产生大量的白色烟雾。下列说法正确的是( )。

图1
A.氢化物的沸点:X>Y
B.X、Y、Z、W四种元素中,非金属最强的是Z
C.四种元素的简单离子半径:Z>W>Y>X
D.由X与W组成的化合物曾用于灭火
5.根据实验操作,现象、结论都正确的是( )。

选项 实验操作 现象 结论A将甲醇与过量酸性高锰酸钾溶液混合紫红色褪去或变浅甲醇被氧化成甲酸B向两支盛有KI3的溶液(含I-)的试管中,分别滴加淀粉溶液和AgNO3溶液前者溶液变蓝,后者有黄色沉淀I-3溶液中存在平衡:I-3images/BZ_21_1113_668_1182_703.pngI2+I-C向Na2Cr2O7溶液中缓慢滴加浓硫酸溶液橙色变浅Cr2O2-7 转化为CrO2-4 D向10 mL浓度均为0.01 mol·L-1的MgCl2和CuCl2混合液中加入10mL 1.0 mol·L-1的氨水只产生了白色沉淀Ksp[Cu(OH)2]>Ksp([Mg(OH)2]
6.某全固态薄膜锂离子电池截面结构如下页图2所示,电极A为石墨薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。下列说法不正确的是( )。

图2
A.充电时,集流体B与外接电源的正极相连
B.充电时,若转移1 mol电子,电极A将增重7g
C.放电时,外电路通过a mol电子时,LiPON薄膜电解质损失a mol Li+
D.电池总反应可表示为LixC+Li1-xCoO2C+LiCoO2
7.25 ℃时,用0.10 mol·L-1的氨水滴定10.00 mL 0.05 mol·L-1H2A溶液,加入氨水的体积(V)与溶液中的关系如图3所示(忽略溶液体积变化)。下列说法不正确的是( )。

图3
A.A点溶液的pH等于1 B.A、B、C三点的水的电离程度:B>C>A C.B点水电离出的H+浓度为1.0×10-6mol·L-1
D.C点溶液中c(NH3·H2O)>c()>c(A2-)>c(OH-)>c(H+)
二、非选择题(共4道题,共58分)
8.(14分)水合肼(N2H4·H2O)又称水合联氨,沸点约118 ℃,具有强还原性,是一种重要的化工原料,现以Cl2、NaOH和CO(NH2)2(尿素)为原料制备水合肼(N2H4·H2O)。
ⅰ.制备NaClO溶液,装置如图4所示。

图4
(1)锥形瓶中不用冰水浴降温会发生副反应生成NaClO3,该副反应的离子方程式为_____。
(2)配置30% NaOH溶液,所需的玻璃仪器有烧杯、量筒、玻璃棒和____
ⅱ.尿素氧化法制备水合肼的装置如图5所示,NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。
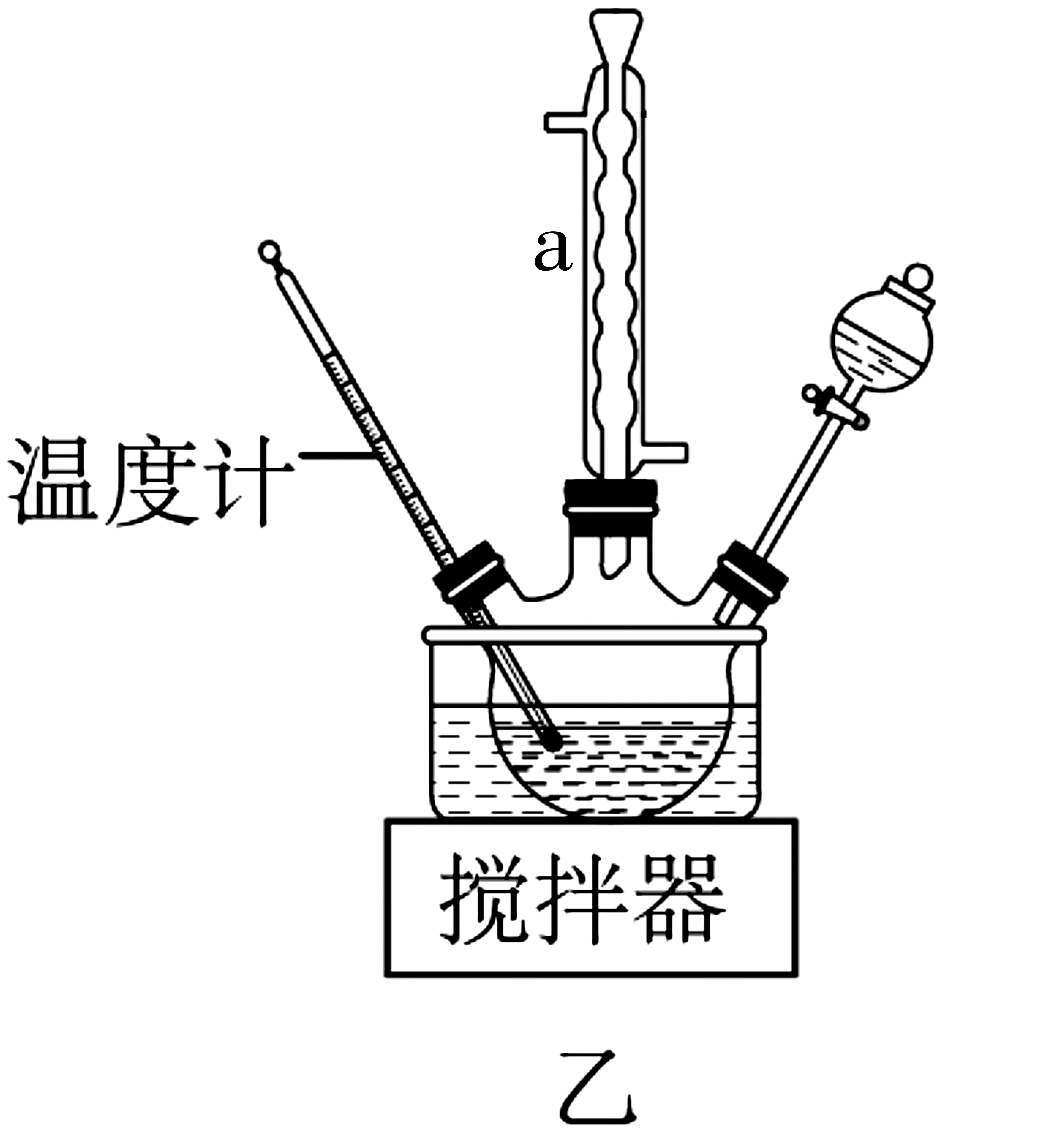
图5
(3)仪器a的名称为____,目的是_____。
(4)尿素法生产水合肼的原理是NaClO碱性溶液与尿素水溶液反应,写出反应的化学方程式:____。
ⅲ.测定肼的含量。
称取水合肼的粗产品2.0g,加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,滴加2~3滴淀粉溶液,用0.3 mol·L-1的碘的标准液进行滴定。
已知:N2H4·H2O+2I2══N2+4HI+H2O
(5)滴定时,碘的标准溶液盛放在____(填“酸式”或“碱式”)滴定管中,达到滴定终点的现象是____。
(6)实验消耗碘标准液的体积为20 mL,粗产品中水合肼的质量分数为_____。
(7)判断下列操作对测定结果偏低的是_____。
A.配置碘标准液时,烧杯中的溶液有少量溅出
B.滴定终点读取滴定管刻度时,开始仰视读数,滴定结束时俯视读数
C.滴定结束后,滴定管尖嘴处有一悬挂液滴
D.滴定管在滴定前有气泡,滴定后气泡消失
E.滴定管未用碘标准溶液润洗就直接注入碘液
9.(15分)氯化钴(水合)是粉红色至红色结晶,无水物为蓝色,常用于制造隐显墨水、氯化钴试纸、变色硅胶等。现利用一种水钴矿(主要成分为Co2O3,还含有少量的CaO、Fe2O3、MgO、SiO2等)制取氯化钴,酸浸时加入Na2S2O3,工艺流程如下:

已知:

沉淀物Fe(OH)3 Fe(OH)2 Ca(OH)2 Al(OH)3 Mg(OH)2开始沉淀 2.3 7.6 7.6 3.7 10.8完全沉淀 4.3 9.2 9.2 5.2 12.4
(1)浸出过程中Co2O3溶解的离子方程式为____,滤渣Ⅰ的主要成分为____。
(2)加入适量的NaClO的主要目的是_____。
(3)加Na2CO3调节pH至5.2后,产生沉淀的离子方程式为____。
(4)加入NaF除钙、镁过程中,当CaF2开始沉淀时,溶液中(已知Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11)
(5)操作Ⅰ中包含的基本实验操作依次是_____,冷却和过滤。
(6)CoCl2·6H2O晶体受热分解后,剩余固体的质量随温度变化的曲线如图6所示,物质B的化学式是_____。

图6
10.(14分)化石燃料的燃烧是造成雾霾天气的重要原因之一,雾霾的主要成分有可吸入颗粒物、SO2、CO等。甲醇可补充和部分代替化石燃料的燃烧,缓解能源紧张。
(1)已知:a.CH3OH(l)+O2(g)══CO(g)+2H2O(g) ΔH1=-443.64 kJ·mol-1
b.2CO(g)+O2(g)══2CO2(g)ΔH2=-566.0 kJ·mol-1
c.H2O(g)══H2O(l) ΔH3=-44 kJ·mol-1
①甲醇完全燃烧生成液态水时的热化学方程式为_____。
②若完全燃烧10g甲醇,此时放出的热量为_____。
(2)低碳减排CO2的一种方法是CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH<0。
①在300 ℃、2 L的密闭容器中进行此反应,该温度下测得K=3.25,则该温度下某时刻H2、CO2、CH3OH、H2O的物质的量分别为4 mol、2 mol、5 mol、5 mol,此时v(正)_____v(逆)(填“>”“<”或“=”)。
②反应达到平衡后,保存其他条件不变,若只把容器的体积缩小一半,平衡_____(填“正向”“逆向”或“不”)移动,平衡常数____(填“增大”“减小”或“不变”)。
③此法制甲醇的优点是____(至少写一个)。
(3)氢气燃料电池能大幅度提高能量的转化率。相同条件下,甲醇燃料电池与氢气燃料电池的能量密度之比为____(能量密度,能量密度之比等于单位质量的燃料转移电子数之比)。
(4)运用电解法可消除甲醇对水质造成的污染,原理是Ni2+氧化成Ni3+,然后Ni3+将甲醇氧化成CO2和H+。先用如图7所示装置模拟上述过程,则Ni2+在阳极的电极反应式为_____,除去甲醇的离子方程式为____。

图7
11.[选修5:有机化学基础](15分)
有机物I(C13H14O4)n是一种香料,其合成路线如下所示:
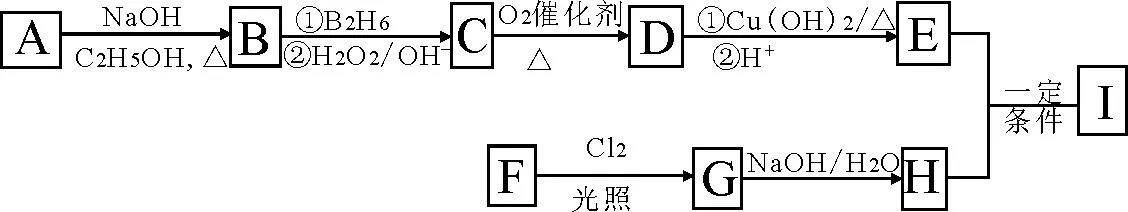
其中A的分子式为C5H10Cl2,核磁共振氢谱显示只有三组峰且峰面积比为6∶1∶3,B为合成天然橡胶的单体,F的分子量为106且一取代物只有两种。
回答下列问题:
(1)A的化学名称为_____。
(2)D与新制Cu(OH)2悬浊液反应的化学方程式为____。
(3)F的分子式为____。
(4)E和H反应的方程式为____。
(5)苯环上只有三个取代基,且显弱酸性的H的同分异构体共有____种,其中三个取代基互不相邻的有机物的结构简式为____。
——以“NaOH标准溶液的标定”微课教学为例

