几种常见微藻在尾水中生长差异及其产油潜力分析
谭静雯 田为一 高 睿 盛嘉棋 任雨杰 甄树聪
(盐城工学院土木学院,江苏盐城 224001)
近年来,如何处理好水资源与能源危机一直是一个居高不下的热点问题,显然污水再生利用是一个极为重要的途径[1-3]。在运用不同方法对污水进行再生利用的过程中,发现相比于常规的污水生物处理工艺技术,运用微藻深度处理污水是一个较为可取的方法,不仅因为可以利用菌藻共生系统中微藻在生长过程中可以吸收污水中氮、磷等营养物质并将其转化为有机物或沉淀这一特性,还因为可以利用其细胞中含油量较高这一优点,萃取油脂并转化成生物柴油,真正做到处理水厂尾水的同时缓解部分的能源匮乏问题[4-7]。本研究通过观察几种常见微藻在尾水中的生长差异并萃取油脂,对藻种的产油性能进行评价,为日后研究尾水可持续培养微藻并将其作为生物柴油奠定基础。
1 材料与方法
1.1 试验材料和仪器
1.1.1 试验仪器。紫外分光光度计、显微镜、培养箱、离心机等。
1.1.2 试验材料。试验水样来自盐城市城东污水厂尾水。试验所用藻种均由指导老师提供,分别为铜绿微囊藻(藻种编号PCC-7806)、铜绿微囊藻(藻种编号FACHB-469)、有毒铜绿微囊藻(藻种编号PCC-7820)、蛋白核小球藻(藻种编号FACHB-5)。
1.1.3 试验试剂。氨氮标准溶液、纳氏试剂、酒石酸钾钠溶液、磷标准使用溶液、抗坏血酸溶液、钼酸盐溶液、无水乙醇。
1.2 试验方法
1.2.1 试验设置与接种。选用容积为1 L的锥形瓶作为培养容器,用江苏省盐城市城东污水厂的尾水作培养基,分别培养4种不同藻类,记为4组。A组为PCC-7806,B组为PCC-7820,C组为FACHB-469,D组为FACHB-5。污水厂尾水中的氨氮浓度和总磷浓度为TN=2.41 mg/L、TP=8.12 mg/L。
试验前用离心机将4种藻类以5 000 r/min的速度离心15 min,弃去上清液,再用无菌水洗涤3次,分别接入已灭菌的4组培养基中,放置在培养箱中培养,采用双侧可调光源,光强控制在4 500~5 000 lx,进行24 h光照,温度控制在25.0~26.5℃[8],每日手动对其进行摇晃2~3次,使得营养均衡。A组初始藻密度约为3.32×106个/mL,B组初始藻密度约为2.12×106个/mL,C组初始藻密度约为3.51×106个/mL,D组初始藻密度约为2.88×106个/mL。并分别在培养过程中的第1、3、5、7、9、11、13和15天对其数量及尾水中氮磷的含量进行检测。
1.2.2 微藻的生长曲线。4种不同微囊藻的细胞密度采用血球计数板计数的方法进行计数,并绘制微囊藻的生长曲线图。
1.2.3 微藻氨氮浓度变化的测定。采用纳氏试剂分光光度法测定[9]。在8个50 mL比色管中,先配置好氨氮含量分别为0、5.0、10.0、20.0、40.0、60.0、80.0和100μg的溶液并加蒸馏水至标线。再先后加入1 mL的酒石酸钾钠溶液和1 mL的纳氏试剂摇匀。静置10 min后,在波长为420 nm下,用20 mm比色皿,以零浓度溶液为参比,测量吸光度,并绘制出校准曲线。再将4种待测液体各取50 mL按照和校准曲线相同的步骤测量4种微囊藻的吸光度,并得到其氨氮浓度的数值。
1.2.4 微藻总磷浓度变化的测定。采用钼酸铵分光光度法测定[10]。在7个50 mL比色管中,分别加入0.00、0.50、1.00、3.00、5.00、10.0、15.0 mL的磷酸盐标准溶液并加蒸馏水至50mL标线。向比色管中加入1 mL 10%抗坏血酸溶液,混匀。30 s后加2 mL钼酸盐溶液充分混匀,放置15 min。用30 mm比色皿于700 nm波长处,以零浓度溶液为参比,测量吸光度,并绘制出校准曲线。再将4种待测液体取适量经消解后分别加入50 mL比色管中,用水稀释至标线。按照和校准曲线相同的步骤测量4种微囊藻的吸光度,并得到其总磷浓度的数值。
1.2.5 微藻比生长速率的测定。在藻种培养的第1天和最后1天分别取少量藻液,用分光光度计测量4种藻液在波长680 nm下的吸光度值,平行测量5次取平均。按以下公式计算4种藻种的比生长速率(d-1):
式中,A1为接种培养第1天的吸光光度值OD680,A2为培养最后1天的吸光光度值OD680,T1和T2分别表示培养开始和结束的时间。
1.2.6 微藻生物量的测定。采用水厂尾水作培养基培养微藻,待其生长到指数生长末期收获,将离心管在90℃烘箱中烘干至恒重(M1),取100 mL均匀藻液置于上述离心管中经离心机4000 r/min离心5 min。后用灭菌的蒸馏水清洗3次,清洗后经-20℃冰箱内冷冻2 h,然后将产物放置于烘箱中烘干至恒重(M2)。最后经过研磨,得到干藻粉。置于-20℃冰箱中冻存备用[11]。按以下公式计算生物量:
生物量(g/L)=(M2-M1)×10
1.2.7 微藻油脂含量的测定。参考文献[12]中的乙醇法,将其略微改动,用来提取4种微藻中的油脂。取培养至指数生长末期的一定量干藻体,充分研磨后每克加入5 mL 96%的乙醇,振荡摇匀。将混合溶液放入离心管在4 000 r/min的转速下离心5 min,吸取上清液于已恒重的烧杯内,剩余的残渣再加入5 mL 96%的乙醇离心吸取上清液于之前的烧杯里。将烧杯放置于水浴锅中快速去除多余溶剂,取出后再放置于90℃的烘箱中干燥2 h,取出烧杯至冷却后再称重。按以下公式计算藻种油脂质量分数(%):
油脂含量分数(%)=(油脂质量/干藻体质量)×100
1.2.8 微藻油脂产率的计算。单位时间的油脂产率(mg/(L·d))可由下式计算[13]:
油脂产率=干藻体质量×油脂含量/培养时间
2 结果与分析
2.1 微藻的生长曲线
根据所测数据,A组(PCC-7806)初始藻密度约为3.32×106个/mL,B组(PCC-7820)初始藻密度约为2.12×106个/mL,C组(FACHB-469)初始藻密度约为3.51×106个/mL,D组(FACHB-5)初始藻密度约为2.88×106个/mL。可知在最初培养时C组的藻数量最多,其次是A组,接着是D组,而数量最少的则是B组。根据数据绘制出如下4种微囊藻生长曲线图(图1)。
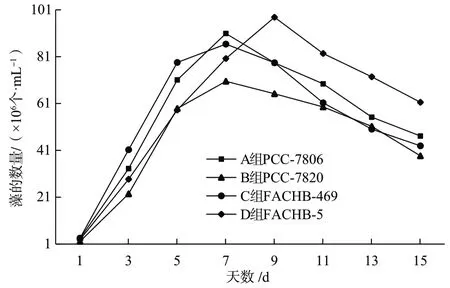
图1 4种微藻生长曲线
由图1可知,在最初的几天培养过程中,这4种藻类均是呈指数生长的趋势,在第5天之前,这4种藻的数量关系仍保持着C组最多,B组最少的关系。在第5天的时候,B组藻的数量超过了D组藻的数量,但这2种藻的数量仍均小于A组和C组的数量,C组仍是最多的。到了第7天,A、B、C组达到了藻数量的最大值,A组藻数量最多,C组次之,其次是D组,最后是B组。到第9天,D组藻的数量达到了最大值,且其最大值大于A组在第7天时的最大值。在之后的几天里,4种藻类的数量均呈现出下降趋势,在第15天时,最终测出A组藻密度约为47.12×106个/mL,B组藻密度约为38.66×106个/mL,C组藻密度约为42.93×106个/mL,D组藻密度约为61.52×106个/mL。
最终是D组藻的数量最多,其余依次是A组、C组、B组。
2.2 微藻氮磷浓度变化情况
根据所测数据制作出如下4种微囊藻在尾水中氨氮、总磷浓度变化表。如表1、表2所示。
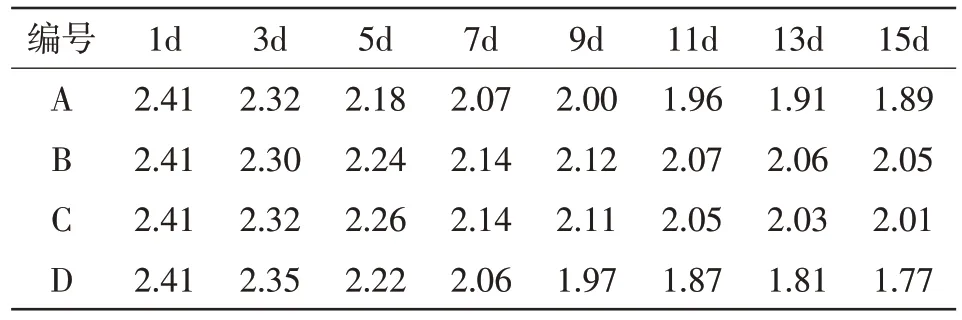
表1 4种微藻在尾水中氨氮浓度变化 单位:mg/L
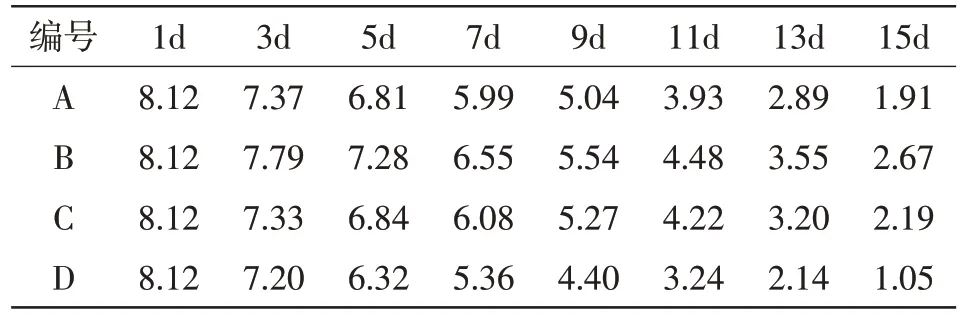
表2 4种微藻在尾水中总磷浓度变化 单位:mg/L
由表1可以看出,4种微藻在最初时氨氮浓度相等,均为2.41 mg/L。在第3天的时候B组消耗的氨氮最多,其次是A组和C组,最后是D组。到达第5天时,D组的消耗超过了B组和C组,仅次于A组。在接下来的几天中,水中氨氮含量持续下降,但下降趋势明显缓慢于前7天,且逐渐趋于平缓。最终在第15天时,水中氨氮含量最多的是B组,接着是C组,其次是A组,最后是D组,也就是说D组消耗的氨氮最多,B组消耗的氨氮含量最少。具体变化趋势见图2。
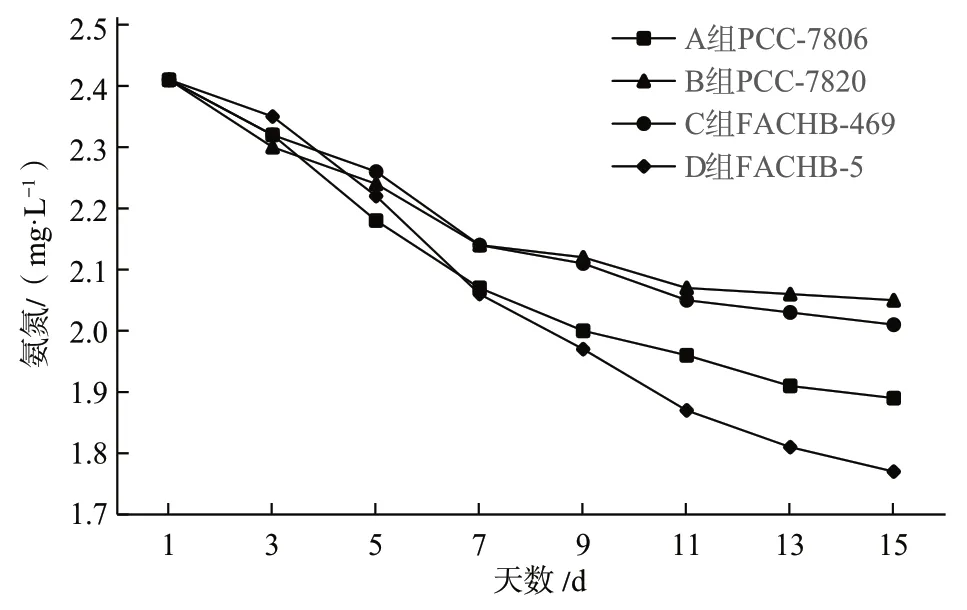
图2 4种微藻在尾水中氨氮浓度变化
由表2可以看出,4种微囊藻在最初时总磷浓度相等,均为8.12 mg/L。在第3天的时候可知D组消耗的磷最多,其次是C组和A组,最后是B组。到达第5天时,A组的消耗超过了C组,仅次于D组。在接下来的几天中,水中磷的含量持续下降,下降趋势总体上较为接近,并无很明显的波动,最终在第15天时,水中磷含量最多的是B组,接着是C组,其次是A组,最后是D组,可知D组消耗的磷最多,B组消耗的磷含量最少。具体变化趋势可见图3。
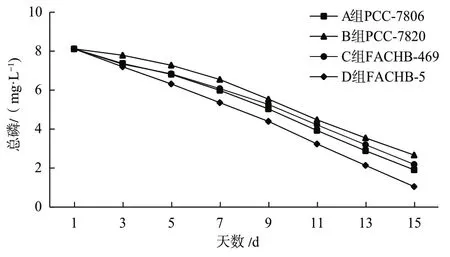
图3 4种微藻在尾水中总磷浓度变化
2.3 微藻生长速率、生物量以及油脂含量的分析
藻种的生物量以及油脂含量是分析藻种产油高低的重要指标,在相同的培养条件下,藻种的生物量与油脂含量并非呈正相关的趋势。离心收集100 mL藻液得到的湿藻体,通过冷冻干燥、研磨的干藻利用乙醇法提取其油脂,每组数据平行测定5次求其平均,得到其油脂含量。藻种生长速率、生物量和油脂含量的比较结果如表3所示。
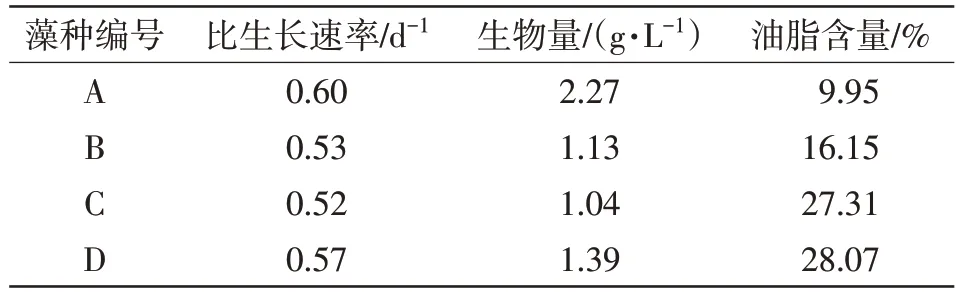
表3 4种微藻的比生长速率、生物量以及油脂含量的比较
由表3可知,比生长速率最高的藻种是A组PCC-7806,为0.60 d-1。其次是D组和B组,分别为0.57 d-1和0.53 d-1。最低的则是C组,为0.52 d-1,所有藻种的比生长速率都大于0.5 d-1。4种微藻的生物量在1.04~2.27 g/L,其中最大的是A组,为2.27 g/L,其他藻种的生物量从大到小依次为D组1.39 g/L,B组1.13 g/L,C组1.04 g/L。
通过比较比生长速率与生物量的数据可知,生长速率高的藻种,生物量也高。因此,比生长速率最快的是A组,而它的生物量也是最高的。其他依次为D组、B组,而比生长速率最慢的是C组,它的生物量也是最低的。由此可见,它们的生物量都与比生长速率成正比。
而在相同培养条件下各个藻种油脂的含量累积都不同,即使是相同属的藻种也不一样。由表3可知,4种微藻的油脂含量最高的是D组,为28.07%,比最低的A组油脂含量9.95%高出了18.12个百分点。而C组和B组的油脂含量也较高,分别为27.31%和16.15%。
通过比较生物量以及油脂含量的数据可以发现:在培养藻种的过程当中,A组的生物量最高,是最低的C组的2.18倍,油脂含量却是最低的,仅有9.95%。而生物量最低的C组,油脂含量却很高,达到了27.31%,与油脂含量最高的D组仅相差0.76%。此现象表明仅从藻种的生物量与油脂含量来判断4种藻种油脂累积的情况还不够,需要引进综合指数更高的油脂产率,才能更好地对藻种的产油情况进行评价。
2.4 微藻产油潜力评价
评价微藻的产油潜力,微藻的油脂产率是很重要的一个性能指标,它是微藻的生长情况、生物产率与油脂含量的综合反映。为此观察4种微藻在培养时间为15 d的油脂积累情况,4种微藻油脂产率的比较结果如图4所示。

图4 4种微藻的油脂产率比较
由图4可知,D组油脂产率最高,为27.79 mg(/L·d)。A组和C组也有较高的油脂产率,分别为16.14 mg(/L·d)和20.29 mg(/L·d),最低的是B组,只有13.07 mg(/L·d)。由此可知,D组FACHB-5最适合作产油藻的候选藻种,研究价值较高。
3 结论
(1)选取4种微藻,考察其在污水厂尾水的培养条件下的生长情况、对氨氮和磷的去除效果进行研究,结果表明:D组蛋白核小球藻的密度最大,生长速率最快,其余依次是A组PCC-7806、C组FACHB-469,最小的是B组PCC-7820。4种藻类在污水中对TN的去除效果一般,对TP的去除比较理想,其中蛋白核小球藻对磷的去除率是最高的,达到了87.1%,这也与藻种在污水中的生长速率一致。由此可见,此藻种对于污水的耐受性较高,采用污水厂尾水培养藻类以治理市政污水的方法可行。
(2)4种藻类中,蛋白核小球藻的油脂含量是最高的,达到了28.07%。而根据其余藻类的生物量和油脂含量分析:微藻的生物量高,油脂含量却不高。例如A组PCC-7806的生物量最高,是生物量最低的C组FACHB-469的2.18倍,而它的油脂含量却是最低的,仅有9.95%。而生物量最低的C组FACHB-469,油脂含量却很高,达到了27.31%。最后由4种藻的油脂产率来看,D组蛋白核小球藻的油脂产率最高,达到了27.79 mg/(L·d)。其余油脂产率从高到低依次为20.29、16.14、13.07 mg/(L·d)。
(3)综合研究所得的各项指标来分析,蛋白核小球藻(FACHB-5)的生长情况、对于污水的处理效果以及油脂含量与产率均最好。因此,可选其为优势藻种,对其优化培养条件以期为生产市政污水处理的新能源作原料。
4 展望
在全球经济高速发展的今天,水污染、能源严重短缺等问题越来越突出,开发可持续的绿色能源成为当前解决这些问题的重要途经。由于微藻产油的效率高、含量高等优点,产油微藻成为了当前比较理想的生物质原料。但目前发展微藻产油还存在着许多难题,例如微藻培养的成本过高效率低下、微藻回收的成本过高等问题[14-15]。由此可见,如将产油微藻的培养和市政污水处理相耦合,不仅可以降低微藻培养的成本过高问题,还可以实现污水的治理和回收再利用;再通过研究新的光生物反应器,可以更好地优化产油微藻的培养条件,提高培养效率,增加微藻的生物量;针对微藻的回收问题,还可以深入研究更好地回收方法,对后续的回收再利用具有重要意义。将以上方面深入研究,可以促进微藻低成本高效率的培养与回收,推动微藻制油的产业化发展,为全球的能源短缺以及环境污染等问题贡献力量。

