小麦条锈菌效应蛋白Hasp83在条锈菌致病性中的功能分析
王建锋,成嘉欣,舒伟学,张艳茹,王晓杰,康振生,汤春蕾
小麦条锈菌效应蛋白Hasp83在条锈菌致病性中的功能分析
王建锋,成嘉欣,舒伟学,张艳茹,王晓杰,康振生,汤春蕾
西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100
【背景】条锈病是小麦上的重大病害,由条形柄锈菌小麦专化型(f. sp.,)侵染引起。条锈菌是活体营养型寄生真菌,在侵染过程中形成吸器,通过吸器从寄主植物汲取营养。同时,吸器分泌效应蛋白调控寄主免疫,促进侵染过程。【目的】明确条锈菌效应蛋白的功能及其作用机理,为揭示条锈菌的致病机制打下基础。【方法】比较分析条锈菌夏孢子、芽管和吸器转录组,获得在吸器诱导表达的分泌蛋白基因,在本氏烟叶片细胞中瞬时表达观察是否能抑制由BAX引起的细胞坏死;利用qRT-PCR分析该基因在条锈菌侵染小麦不同阶段的表达水平。借助荧光假单胞菌Ⅲ型分泌系统和寄主诱导的基因沉默(host-induced gene silencing,HIGS)分析在条锈菌侵染过程中的功能。利用酵母双杂交系统筛选小麦中与Hasp83互作的蛋白,免疫共沉淀技术进一步在烟草细胞中共表达验证Hasp83及其候选靶标蛋白的互作。【结果】开放阅读框全长522 bp,编码173个氨基酸,蛋白N端1—29位氨基酸为信号肽,无保守结构域,在本氏烟叶片细胞中瞬时表达能抑制由BAX引起的细胞坏死。qRT-PCR分析显示,在条锈菌侵染时期上调表达;利用细菌Ⅲ型分泌系统在小麦水源11品种中瞬时表达Hasp83能够抑制荧光假单胞菌引起的胼胝质积累,在接种条锈菌无毒性小种CYR23后,瞬时表达Hasp83株系产生的活性氧积累面积和过敏性坏死面积相比对照减少19.35%—38.62%;利用HIGS技术在接种条锈菌毒性小种CYR31的小麦水源11中沉默,发现条锈菌的产孢量、菌丝长度、菌丝扩展面积和吸器数目减少,致病力降低。酵母双杂交结果表明,效应蛋白Hasp83与其小麦中候选靶标过敏性坏死诱导蛋白Tahir1互作。免疫共沉淀进一步证明Hasp83及其候选靶标Tahir1存在互作。【结论】条锈菌效应蛋白Hasp83可抑制寄主由非致病细菌和无毒性条锈菌生理小种引起的小麦防卫反应,增强病原菌的致病力。
小麦条锈病;吸器;效应蛋白;转录组分析;靶标蛋白鉴定
0 引言
【研究意义】由条形柄锈菌小麦专化型(f. sp.,)引起的小麦条锈病严重危害我国小麦的安全生产,病害严重流行年份可导致小麦减产10%—30%,甚至绝收[1]。小麦条锈病在全球小麦种植区均有发生,我国是发生面积最大、造成经济损失最重的国家[2-4]。种植抗病小麦品种是防控小麦条锈病的主要策略[5]。然而由于小麦条锈菌的毒性变异频繁,高温适应性增强,病原菌新小种不断产生[6],导致绝大多数生产品种抗锈性丧失,致使小麦条锈病在我国连年流行成灾[7]。目前,对小麦条锈菌侵染致病的机理认识不够,缺乏有效的防控措施。因此,挖掘病菌关键的致病因子,解析其调控寄主促进病菌致病的作用机理,开发病害防控新策略,对持续有效防控小麦条锈病具有重要意义。【前人研究进展】植物在与病原菌的长期进化过程中,形成了复杂的免疫系统,包括细胞膜上的模式识别受体(pattern recognition receptor,PRR)识别病原菌相关分子模式(pathogen associated molecular pattern,PAMP)激发的PTI(PAMP-triggered immunity),及植物抗病蛋白(resistance protein,R)识别病菌无毒基因编码产物(avirulence protein,Avr)激发的ETI(effector-triggered immunity)[8-9]。为克服植物的免疫反应,病原菌分泌效应蛋白抑制寄主的PTI和ETI,促进侵染与定殖[10]。小麦条锈菌为活体营养型寄生真菌,在侵染小麦的过程中,会产生吸器这一高度分化的侵染结构,从寄主细胞源源不断地汲取营养物质维持自身生长发育与繁殖[11]。另外,条锈菌通过吸器向寄主细胞中分泌大量的效应蛋白(effector),调控寄主的免疫反应,促进条锈菌的侵染与定殖[12-14]。通过小麦条锈菌全基因组测序与吸器转录组测序,分析获得了大量候选效应蛋白[15-16]。目前已鉴定到一些条锈菌效应蛋白,发现它们靶定寄主细胞不同区室,通过多元化策略调控寄主免疫。Pst_13661编码多糖去乙酰化酶,分泌到植物细胞间质,对病菌细胞壁的几丁质脱乙酰化,避免寄主几丁质酶识别,降低寄主对几丁质应答产生的免疫反应,从而帮助病菌致病[17]。Pst_12806定位到寄主植物叶绿体,抑制细胞色素b6/f复合体铁硫亚基TaISP的功能,削弱叶绿体介导的防卫反应,促进病菌定殖[18]。细胞质效应蛋白Pst_4/5则通过劫持并阻止光合电子传递链关键蛋白TaISP进入叶绿体,干扰叶绿体免疫[19]。Pst_A23位于植物细胞核斑点,结合小麦pre-mRNA调控寄主可变剪接抑制免疫[20]。胞质效应蛋白Hasp98通过抑制寄主免疫途径关键组分TaMAPK4的激酶活性,调控寄主免疫[21]。PsSpg1与Pst27791分别通过靶向小麦感病基因增强其激酶活性,磷酸化下游转录因子,进而改变其转录调控活性,抑制防御相关基因表达,促进小麦感病[22-23]。在解析条锈菌效应蛋白作用机理的基础上,利用RNAi技术操纵效应蛋白基因表达,过表达或编辑其小麦靶标基因,创制了小麦抗病新材料,显著提高了小麦抗锈性。【本研究切入点】效应蛋白具有抑制植物免疫系统的功能,但条锈菌大部分效应蛋白的基本功能以及分子机制依然不清楚,因此解析效应蛋白调控植物免疫分子机制,可为进一步了解条锈菌的致病机制并开发防控新途径提供依据。【拟解决的关键问题】明确候选效应蛋白Hasp83调控条锈菌的毒性功能,筛选鉴定其在寄主小麦的互作蛋白,为揭示效应蛋白Hasp83的致病机理及深入研究条锈菌-小麦互作机制打下基础。
1 材料与方法
试验于2016—2020年在西北农林科技大学植物保护学院植物免疫实验室完成。
1.1 材料
1.1.1 菌株、质粒与植物材料 大肠杆菌菌株DH5和JM109、酵母菌菌株AH109由本实验室提供;荧光假单胞菌菌株Ethan,由美国华盛顿州立大学Scot Hulbert教授馈赠;农杆菌菌株GV3101(含P19),购自上海唯地生物技术有限公司;马铃薯X病毒(PVX)病毒载体pGR106,用于农杆菌侵染本氏烟,由南京农业大学窦道龙教授馈赠;pEDV6载体,用于细菌Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)在小麦中瞬时表达,由美国华盛顿州立大学Scot Hulbert教授馈赠;大麦条纹花叶病毒(BSMV)、、链的载体,用于寄主诱导的基因沉默(host-induced gene silencing,HIGS)试验,由本实验室保存;pGBKT7载体和pGADT7载体,用于酵母双杂交(yeast two-hybrid,Y2H)筛选系统,由本实验室提供;pBinGFP2和pICH86988载体,用于免疫共沉淀(co-immunoprecipitation,Co-IP)试验中效应蛋白和候选靶标在烟草中表达,由南京农业大学王源超教授馈赠。
小麦品种水源11(携带抗病基因)和铭贤169(不携带任何抗病基因)由本实验室保存。将水源11和铭贤169的种子均匀播种在直径9 cm塑料花盆中,16℃光照16 h,13℃黑暗8 h培养,相对湿度70%,待幼苗第二叶片展开备用。水源11用于小麦条锈菌小种CYR31的繁殖、表达谱分析、T3SS效应蛋白的瞬时表达和HIGS试验,铭贤169用于小麦条锈菌小种CYR23的繁殖。
供试烟草为本氏烟(),由本实验室保存。将培育好的烟草幼苗移栽至直径9 cm塑料花盆中,25℃光照16 h,黑暗8 h培养,相对湿度75%,待其培养至4叶期备用。
供试小麦条锈菌生理小种CYR23和CYR31在本实验室低温窑洞进行繁殖。其中,水源11接种生理小种CYR31表现为完全产孢的感病反应,接种CYR23诱发过敏性坏死的抗病反应;生理小种CYR23和CYR31在铭贤169上均完全产孢。
1.1.2 试剂和引物 T4 DNA连接酶、T-simple vector(Takara,北京宝日医生物技术有限公司);各种限制性内切酶、Taq Polymorase、Pfu DNA Polymerase、RevertAid Master Mix with DNase I(Thermo Fisher,赛默飞世尔科技有限公司);2×Taq MasterMix(含染料)、DL2000 Marker(康为世纪公司);质粒小提试剂盒(Omega,北京诺博莱德科技有限公司);琼脂糖凝胶DNA回收试剂盒(BioTeke,北京百泰克生物技术有限公司);快速通用RNA提取试剂盒(北京华越洋生物科技有限公司);RiboMAXTMLarge Scale RNA Production System-T7试剂盒(Promega公司);胰蛋白胨、酵母提取物(OXOID,北京拜尔迪生物技术有限公司);Amp、Kana、利福平等抗生素、DMSO、葡萄糖(MP,北京伊诺凯科技有限公司);真菌DNA提取试剂盒(BIOMIGA公司);DAB、WGA、苯胺蓝、蛋白胨、YNB(BD公司);酵母生长所需各种氨基酸(Clontech公司);PEG3350(Spectrum,上海斯百全化学有限公司);LiAc(Sigma,默克科技公司);NP-40裂解液(上海碧云天生物技术有限公司);GFP-Trap琼脂糖凝胶珠(Chromo Tek公司)。引物和测序由生工生物工程(上海)股份有限公司完成。本研究所用引物及其序列见表1。
1.2 Hasp83生物信息学分析
运用SignalP 5.0在线软件(https://services.healthtech. dtu.dk/service.php?SignalP-5.0)预测Hasp83的信号肽;利用SMART在线软件(http://smart.embl-heidelberg. de/smart/set_mode.cgi?NORMAL=1)分析Hasp83保守结构域;利用Ensembl Fungi(http://www.fungi.ensembl. org/)网站查找Hasp83的特异沉默片段。
1.3 Hasp83的获取与重组载体构建
在小麦条锈菌吸器转录组中获得的ORF序列[16]。利用Primer Premier 5设计特异引物,以CYR31侵染水源11小麦叶片的cDNA为模板扩增得到目的基因。采用一步克隆法将扩增得到的去信号肽基因序列连接到Ⅰ和Ⅰ酶切的pGR106载体,获得重组载体pGR106-Hasp83Δsp。

表1 本研究所用引物序列
扩增编码去信号肽基因序列,利用BP酶(Gateway® BP Clonase®,Invitrogen)构建到含有attP位点的pDONRTM221中间载体,阳性质粒pDONRTM221- Hasp83Δsp通过LR酶(GatewayTMLR ClonaseTM,Invitrogen)反应获得重组载体pEDV6-Hasp83Δsp。
设计的特异沉默片段和,用特异引物扩增沉默片段,利用T4 DNA连接酶连接到Ⅰ和Ⅰ酶切的BSMV::(BSMV::00)载体,获得BSMV::和BSMV::重组载体。
扩增编码去信号肽基因序列,连接到RⅠ和HⅠ酶切的pGBKT7载体,获得重组载体pGBKT7-Hasp83Δsp。将去信号肽基因序列构建到Ⅰ和HⅠ双酶切的pBinGFP2载体,获得重组载体pBinGFP2-Hasp83Δsp;此外,采用扩增含HA标签的候选靶标基因序列,利用一步克隆法连接到Ⅰ单酶切的pICH86988载体,构建重组载体pICH86988-Tahir1-HA。
1.4 接种与qRT-PCR检测分析
小麦水源11和铭贤169生长至一叶一心期时,脱去叶片表面蜡质,将条锈菌CYR31和CYR23夏孢子分别用ddH2O稀释制成孢子悬液,毛笔蘸取孢子悬液均匀接种于叶片正面,水源11接种条锈菌小种CYR31,铭贤169接种条锈菌小种CYR23,黑暗保湿24 h后转移至16℃温室进行培养,14 d后即可收集新鲜夏孢子。
采集小麦条锈菌夏孢子、萌发芽管和接种条锈菌CYR31后24、48、72、120和168 h的小麦水源11叶片,用华越洋公司快速通用RNA提取试剂盒提取RNA,使用RevertAid Master Mix with DNase I试剂盒反转录合成cDNA。采用Primer Premier 5设计效应蛋白基因特异引物,利用qRT-PCR技术分析其在小麦侵染不同阶段的表达情况。以小麦条锈菌为内参,采用2-∆∆Ct法[24]计算基因的相对表达量,进行3次生物学重复。
1.5 农杆菌侵染本氏烟瞬时表达Hasp83
将构建好的重组质粒pGR106-Hasp83Δsp通过电击转化法转入GV3101感受态细胞,挑取阳性菌落在含有卡那霉素(50 μg·mL-1)和利福平(50 μg·mL-1)的LB培养基中28℃培养36 h。5 000 r/min离心10 min,收集菌体,10 mmol·L-1MgCl2清洗两次,乙酰丁香酮(As)缓冲液(1 mL 1 mol·L-1KOH-MES、100 μL 150 mmol·L-1As、1 mL 1 mol·L-1MgCl2定容至100 mL)悬浮菌体,稀释至OD600=0.3,黑暗静置2 h后注射烟草叶片背面。24 h后,在同一位置注射携带pGR106-Bax的农杆菌菌液,4 d后观察表型并拍照。本试验阳性和阴性对照分别为含重组载体pGR106-Avr1b和pGR106-eGFP的农杆菌菌液,进行3次生物学重复。
1.6 细菌Ⅲ型分泌系统在小麦水源11上瞬时表达Hasp83
将构建好的pEDV6-Hasp83Δsp载体通过电击转化法导入荧光假单胞菌EtHan感受态细胞中,挑取阳性菌落在含有氯霉素(30 μg·mL-1)和庆大霉素(25 μg·mL-1)的LB培养基中28℃培养48 h。4 500 r/min离心1 min收集菌体,用10 mmol·L-1MgCl2清洗3次后重悬菌体至OD600=1.0,注射二叶期小麦水源11第2叶,24 h后采集注射叶段,经冰醋酸﹕无水乙醇=1﹕1脱色、水合氯醛固定后,用0.05%苯胺蓝染液过夜避光处理。染色样本于荧光显微镜UV Light通道下观察胼胝质,每个样品随机选取50个1 mm2的视野统计胼胝质数量,进行3次生物学重复。以携带有pEDV6-dsReD的EtHan悬浮液注射叶片为阴性对照,细菌无毒效应基因在小麦叶片瞬时表达激发免疫反应,监测试验系统是否成功。含有pEDV6-Hasp83Δsp的EtHan菌液注射小麦叶片24 h后,接种条锈菌无毒生理小种CYR23,采集接菌后24和48 h的样品,分别进行3, 3’-二氨基联苯(3, 3’-diaminobenzidine,DAB)和小麦胚凝集素(wheat germ agglutinin,WGA)染色,接菌后120 h采集叶片,用于生物量检测。
DAB染色:采集对应时间点叶片,在200 μL DAB(1 mg·mL-1)中光照反应3—4 h,叶片剪成2 cm叶段经过(冰醋酸﹕无水乙醇=1﹕1)脱色、水合氯醛过夜固定,于荧光显微镜下统计活性氧面积及过敏性坏死面积(激发波长488 nm)。每次统计30个侵染点,进行3次生物学重复。
WGA染色:将经过脱色固定后的叶片放置于含1.5 mL 1 mol·L-1KOH溶液的2 mL离心管中,高压灭菌121℃,5 min,弃去离心管中的KOH溶液,50 mmol·L-1Tris-HCl浸泡30 min,重复浸泡2次后,用0.1% WGA荧光染液避光处理30 min。染色叶片在荧光显微镜(激发波长488 nm)下观察统计菌落面积、菌丝长度、吸器数目。
生物量检测:利用真菌DNA提取试剂盒提取接菌的小麦总DNA,将DNA样品分别稀释至10-1、10-2、10-3、10-4、10-5、10-6和10-7,以小麦和条锈菌为内参基因制作双标准曲线。通过双标准曲线计算瞬时表达样品中条锈菌的相对生物量,进行3次生物学重复。
1.7 寄主诱导的基因沉默
利用Ⅰ内切酶线性化BSMV和空载体,Ⅰ内切酶线性化载体,重组载体BSMV::及BSMV::重组载体用HⅡ内切酶线性化。采用RiboMAXTMLarge Scale RNA Production System-T7(Promega)将线性化DNA片段进行体外转录。参照Holzberg等[25]的方法,将BSMV::(、、:Hasp83)的体外转录产物按1﹕1﹕1比例混合(各10 μL),加入200—300 μL FES缓冲液(2.613 g磷酸氢二钾、1.877 g甘氨酸、0.5 g焦磷酸钠、0.5 g硅藻土、0.5 g斑脱土,定容至50 mL,高压灭菌20 min)中,充分混匀,摩擦接种小麦第2叶。BSMV::为阴性对照,BSMV::用于监测BSMV系统。接种病毒后25℃培养10 d,待出现病毒症状,于第4叶接种条锈菌CYR31,分别于接菌后24、48和120 h采集接菌叶片进行DAB与WGA染色,同时提取样品RNA,观察统计活性氧过敏性坏死面积,菌丝生长发育情况,分析沉默效率。
1.8 酵母双杂交筛选候选靶标
将重组诱饵质粒pGBKT7-Hasp83Δsp利用PEG/ LiAC法转化至酵母AH109中,筛选条锈菌侵染的小麦cDNA文库,挑取在三缺培养基(SD-Trp-Leu-His)上生长的酵母单菌落,无菌水稀释后在四缺培养基(SD-Trp-Leu-His-Ade)划线,30℃培养,5 d后挑取单菌落转移到含有X--gal的四缺培养基培养。利用AD-F和AD-R引物扩增四缺培养基上显蓝的菌落,产物送至公司进行测序。测序结果在NCBI 数据库中BlastX比对,获得候选基因序列。
酵母双杂交验证效应蛋白和候选靶标互作:利用Primer Premier 5设计候选基因引物,以CYR31侵染小麦叶片的cDNA为模板进行扩增,将其产物构建至pGADT7载体。将含候选基因的重组载体与pGBKT7-Hasp83Δsp质粒共转入酵母AH109菌株中,分别涂布于二缺培养基(SD-Trp-Leu)和三缺培养基(SD-Trp-Leu-His),30℃培养3 d。挑取SD-Trp-Leu上的阳性单菌落,以106、105、104、103梯度稀释,在SD-Trp-Leu、SD-Trp-Leu-His和四缺培养基(SD-Trp-Leu-His-Ade)点斑,培养基倒置放于30℃培养3 d。
1.9 免疫共沉淀验证效应蛋白和候选靶标互作
将重组质粒pBinGFP2-Hasp83Δsp和pICH86988- Tahir1-HA转入GV3101感受态细胞,选取阳性菌落在含有卡那霉素(50 μg·mL-1)和利福平(50 μg·mL-1)的LB培养基中28℃培养36 h。农杆菌菌液的处理见1.5。将含有pBinGFP2-Hasp83Δsp和pICH86988-Tahir1的农杆菌菌液(各组分OD600终浓度均为0.5)注射烟草,25℃培养48 h后采样。采集叶片于研钵中液氮速冻并充分研磨,研磨好的粉末置于2 mL离心管中加入预冷的NP-40裂解液进行涡旋,12 000 r/min 4℃离心10 min。将上清转移至含50 μL预处理GFP-Trap琼脂糖凝胶珠的离心管中,4℃孵育2 h。1 000 r/min离心1 min,弃上清。用NP-40 裂解液洗涤凝珠3次,向离心管中加入1×SDS蛋白上样缓冲液,沸水浴10 min。煮沸样品在10%聚丙烯酰胺凝胶中电泳,利用转膜仪将蛋白转移至PVDF膜上,随后将膜置于含5%脱脂奶粉的TBST缓冲液内室温封闭1 h,在含anti-GFP抗体的TBST缓冲液(抗体比例1﹕1 000)中4℃过夜孵育;TBST缓冲液清洗3次后,置于含辣根过氧化物酶交联二抗的TBST缓冲液中室温孵育1 h。TBST缓冲液清洗3次后,在化学发光成像仪下进行曝光。
2 结果
2.1 Hasp83在条锈菌侵染小麦中上调表达
比较分析小麦条锈菌生理小种CYR31的夏孢子、芽管与吸器转录组,发现在吸器阶段显著上调表达(图1)。(GenBank:KI516380.1)全长522 bp,编码173个氨基酸,SignalP 5.0预测N端1—29位氨基酸为信号肽,SMART预测没有明显的结构域。qRT-PCR分析结果显示,在条锈菌夏孢子、芽管表达量较低,在条锈菌侵染的小麦叶片中诱导表达,24、72、和168 h表达量显著升高,72 h达到峰值,表达量为在夏孢子中的308倍,随后下降(图2)。
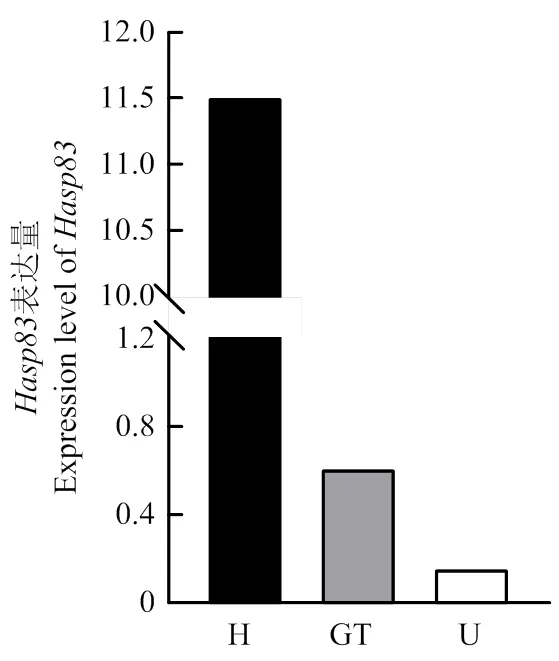
H:吸器haustorium;GT:芽管germinated tube;U:夏孢子urediospore

U:夏孢子urediospore;GT:芽管germinated tube。 **:P<0.01
2.2 Hasp83抑制Bax诱导的细胞坏死
Bax是一种小鼠促细胞凋亡蛋白,其在本氏烟中表达诱导产生细胞坏死,与病原菌诱导产生的过敏性坏死反应具有相似的生理特性[26]。因此,能否抑制由Bax引起的细胞坏死成为初步筛选和检验效应蛋白毒性功能的有效方法[27-28]。通过农杆菌侵染在本氏烟中瞬时表达Hasp83Δsp,24 h后注射含Bax的农杆菌菌液,观察本氏烟叶片的坏死情况。结果表明,单独注射含pGR106-eGFP的农杆菌菌液不能引起本氏烟细胞坏死,24 h后在原位置注射含Bax的农杆菌菌液细胞坏死明显;单独注射含重组质粒pGR106- Hasp83Δsp的农杆菌菌液没有出现坏死反应,原位点注射含Bax的农杆菌菌液后也未观察到明显坏死现象出现,与对照Avr1b表型一致(图3)。Hasp83能抑制由Bax引发的细胞坏死。
2.3 Hasp83抑制小麦的基础免疫反应
含荧光假单胞菌EtHan注射小麦叶片能够引起胼胝质积累[29-30],为明确Hasp83抑制小麦的基础免疫作用,利用荧光假单胞菌EtHan的Ⅲ型分泌系统在小麦叶片瞬时表达Hasp83Δsp,检测胼胝质。注射携带有pEDV6-dsRed的荧光假单胞菌能激发小麦产生胼胝质,表达阳性对照AvrRpt2诱导胼胝质积累显著增多,瞬时表达Hasp83的小麦叶片中胼胝质数目较对照叶片dsRed相比显著减少(图4-A),进一步统计分析显示,瞬时表达Hasp83的小麦叶片中胼胝质数目较pEDV6-dsRed表达叶片相比降低44.53%(图4-B),说明Hasp83可以抑制由荧光假单胞菌EtHan激发的小麦基础免疫反应。

A:携带有pGR106-Hasp83Δsp、pGR106-eGFP或 pGR106-Avr1b的农杆菌侵染烟草叶片,24 h后注射含有pGR106-Bax的农杆菌,5 d后观察表型N. benthamiana leaves were infiltrated with A. tumefaciens containing pGR106-Hasp83Δsp, pGR106-eGFP, or pGR106-Avr1b, either alone or with A. tumefaciens cells carrying pGR106-Bax, which were infiltrated 24 h later. At 5 d post infiltration, the phenotypes were observed and photographed。B:农杆菌侵染烟草叶片示意图Schematic diagram of A. tumefaciens infiltrating N. benthamiana leaves
2.4 Hasp83抑制小麦抗条锈病反应并促进病原菌生长
为进一步明确Hasp83能否抑制寄主小麦对条锈菌的抗性,在瞬时表达Hasp83的小麦叶片上接种条锈菌无毒小种CYR23,观察统计接菌后24和48 h的活性氧与细胞坏死。结果显示,与瞬时表达dsRed的叶片相比,表达Hasp83的小麦叶片中活性氧积累和细胞坏死面积在24和48 h均有不同程度减小(图5-A),活性氧积累面积在24和48 h分别下降34.47%和38.62%(图5-B),细胞坏死面积在24和48 h分别减少19.35%和25.58%(图5-C),表明Hasp83能抑制由无毒条锈菌生理小种引起的小麦抗病反应。

A:苯胺蓝染色观察瞬时表达Hasp83小麦叶片中胼胝质Observation of callose deposition stained by aniline blue in wheat leaves transiently expressing Hasp83。dsRed:阴性对照negative control;AvrRpt2能诱导胼胝质产生bacterial AvrRpt2 could induce callose production in wheat。标尺Scale=200 μm。
利用WGA染色条锈菌侵染结构,观察并统计菌丝长度和菌落扩展面积。结果显示,与对照叶片相比,表达Hasp83的小麦叶片接种条锈菌24和48 h后,条锈菌菌丝长度增长,菌落面积增大(图6-A、6-B),瞬时表达Hasp83的小麦叶片接种条锈菌120 h后,条锈菌生物量显著增加(图6-C)。以上结果说明瞬时表达Hasp83抑制小麦免疫,促进条锈菌生长发育。
2.5 HIGS沉默Hasp83减弱条锈菌致病力
为进一步解析Hasp83在条锈菌致病性中的功能,设计的两个特异片段,分别命名为和。其中,片段长为107 bp,片段为244 bp(图7-A)。利用HIGS在小麦水源11与条锈菌CYR31亲和互作体系中沉默,接种条锈菌14 d观察侵染表型。沉默植株(BSMV::和BSMV::)中,条锈菌夏孢子堆数目与对照叶片BSMV::相比明显减少(图7-B)。qRT-PCR检测沉默效率,结果显示,在24 hpi的沉默叶片中表达量较对照BSMV::分别下降50%和44%,在48 hpi分别下降55%和39%,在120 hpi后分别下降60%和66%(图7-C)。组织学观察显示,与BSMV::对照相比,在24和48 hpi沉默叶片中条锈菌的菌丝长度变短,侵染面积变小,形成的吸器数目变少;120 hpi菌落侵染面积也显著减小(图7-E、7-F、7-G)。以上结果说明,瞬时沉默降低条锈菌毒力,抑制了条锈菌生长发育。
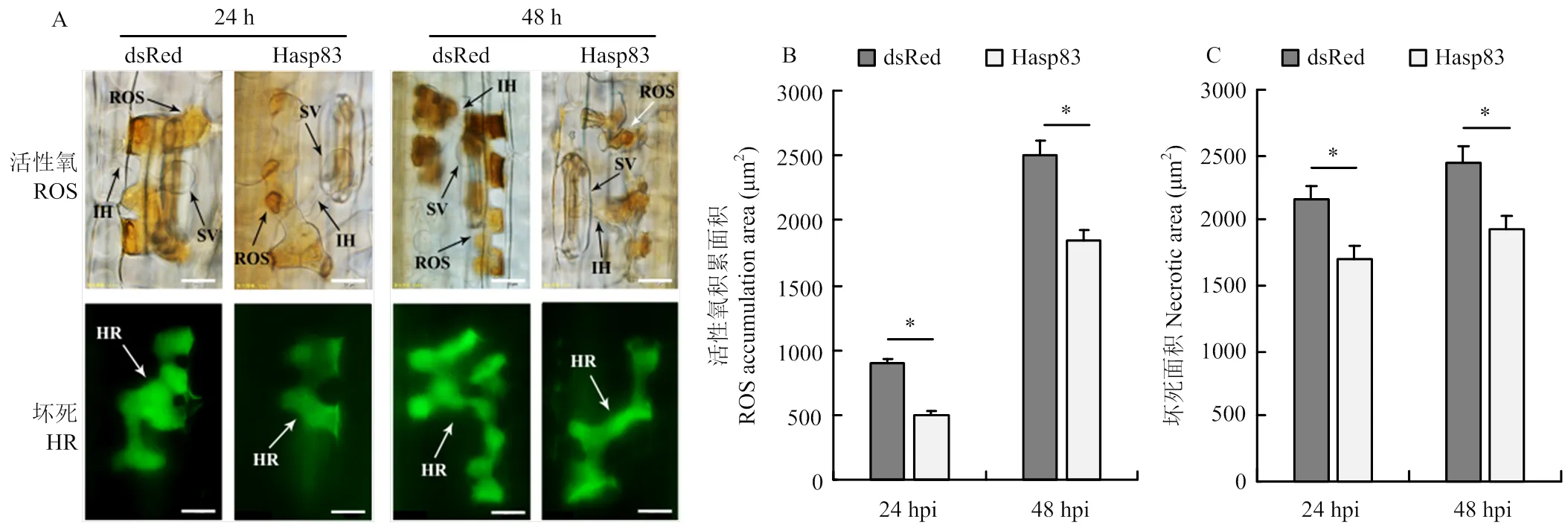
A:组织学观察瞬时表达Hasp83小麦叶片接种条锈菌无毒生理小种CYR23 24和48 h的活性氧(ROS)积累及过敏性坏死反应(HR),标尺Scale =20 μm Histological observation of ROS accumulation and hypersensitive response (HR) in wheat leaves transiently expressing Hasp83 at 24 and 48 h post inoculation (hpi) of avirulent Pst CYR23。SV:气孔下囊Sub-stomatal vesicle;IH:侵染菌丝Infection hyphae。B、C:条锈菌侵染小麦24和48 h ROS积累及细胞过敏性坏死反应面积统计。3次生物学重复,每次统计30个侵染点。*:P<0.05 Statistical analysis of ROS accumulation and HR per infection site at 24 and 48 hpi. The experiments were repeated for three biological replications with 30 infection sites for each replication

A、B:瞬时表达Hasp83小麦叶片中,条锈菌侵染24和48 h后菌丝长度及侵染面积统计。3次生物学重复,每次统计30个侵染点。*:P<0.05 Statistical analysis of Pst hyphal length and infection area per infection site at 24 and 48 hpi. The experiments were repeated for three biological replications with 30 infection sites for each replication。C:条锈菌侵染小麦120 h的相对生物量,**:P<0.01 Relative fungal biomass of Pst at 120 hpi in wheat leaves expressing Hasp83 calculated by qPCR
2.6 Hasp83与小麦Tahir1互作
以Hasp83作为诱饵蛋白,在条锈菌与小麦亲和互作的酵母双杂交cDNA文库筛选其互作蛋白。经过两次重复,共获得52个候选互作蛋白。对其中在两次筛选结果中均出现的4个蛋白进行验证,发现其中过敏性坏死诱导蛋白(hypersensitive induced reaction protein 1,Tahir1)在两次筛选结果中均有出现。(GenBank:AFD54041.1)全长840 bp,编码279个氨基酸。为了验证二者是否存在互作关系,以CYR31侵染小麦叶片的cDNA为模板扩增,测序正确后构建至pGADT7载体进行酵母双杂交互作验证。结果显示,共表达pGBKT7-Hasp83Δsp和pGADT7-Tahir1的酵母在四缺培养基(SD-Trp-Leu-His-Ade)上生长(图8),表明Hasp83与Tahir1在酵母中存在互作。进一步利用Co-IP验证Hasp83与Tahir1的互作。在烟草中将Tahir1-HA分别与Hasp83-GFP和GFP(阴性对照)共表达,提取烟草叶片总蛋白进行Western blot检测,结果显示,烟草总蛋白中均能检测到Hasp83-GFP,GFP与Tahir1-HA,表明蛋白均表达成功;利用GFP-Trap富集总蛋白,沉淀产物中可以同时检测到Hasp83-GFP及Tahir1-HA,而阴性对照GFP中则不能检测到Tahir1-HA(图9),表明Hasp83与Tahir1在植物体内存在互作关系。
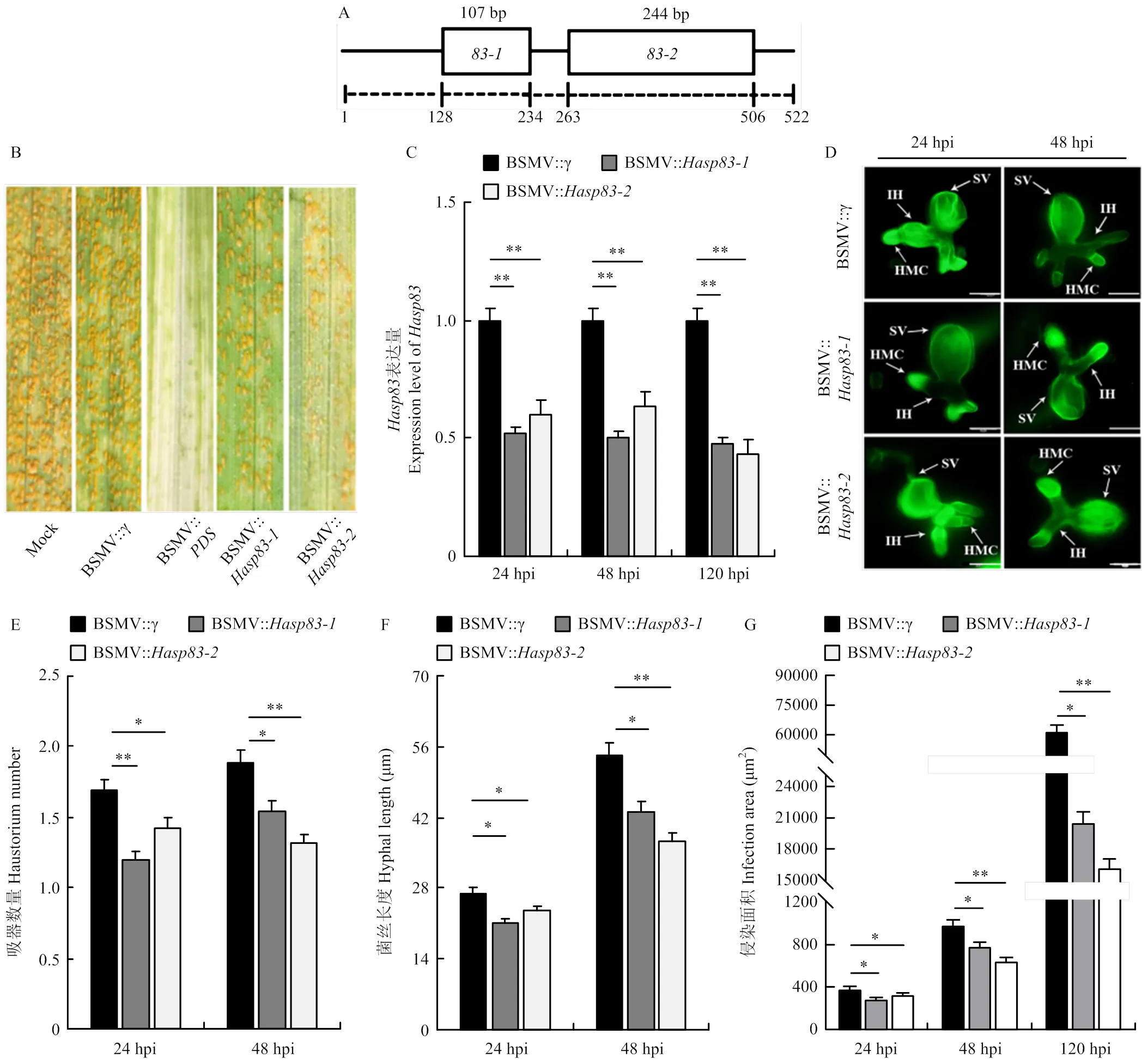
A:Hasp83特异沉默片段示意图Schematic diagram of the specific silencing fragment of Hasp83。B:利用HIGS技术沉默Hasp83,接种条锈菌CYR31,14 d后观察表型Disease phenotypes of Hasp83-silencing wheat plants inoculated with Pst CYR31 observed at 14 d post inoculation。C:qRT-PCR分析24、48和120 hpi Hasp83的沉默效率Silencing efficiency of Hasp83 at 24, 48 and 120 hpi assessed using qRT-PCR。BSMV::γ:阴性对照negative control。D:组织学观察Hasp83沉默叶片接种CYR31 24和48 h的条锈菌生长发育(标尺Scale=20 μm)Histological observation of fungal growth in Hasp83-silencing wheat plants infected with CYR31。SV:气孔下囊Sub-stomatal vesicle;IH:侵染菌丝Infection hyphae;HMC:吸器母细胞Haustorial mother cell。E—G:Hasp83沉默叶片中,接种条锈菌24、48和120 h后吸器数量、菌丝长度及侵染面积统计。3次生物学重复,每次重复统计30个侵染点。*:P<0.05,**:P<0.01 Statistical analysis of Pst haustorium number, hyphal length and infection area per infection site in Hasp83-silencing plants. The experiments were repeated for three biological replications, with 30 infection sites for each replication

图8 酵母双杂交验证Hasp83与候选小麦蛋白Tahir1互作

图9 免疫共沉淀胞外验证Hasp83与靶标蛋白Tahir1的互作
3 讨论
3.1 小麦条锈菌效应蛋白的研究方法
条锈菌侵染小麦时通过吸器向寄主分泌效应蛋白调控植物的免疫与代谢,促进寄主植物感病[11]。鉴定小麦条锈菌的关键效应蛋白,对揭示其致病机理具有重要意义。近年来,通过生物信息学分析从小麦条锈菌全基因组与吸器转录组中获得大量分泌蛋白基因[15-16],为鉴定小麦条锈菌效应蛋白提供了丰富的基因资源。然而,小麦条锈菌为活体营养寄生真菌,缺乏稳定的遗传转化体系,极大限制了效应蛋白基因的功能研究。寄主诱导的基因沉默(HIGS)技术通过在寄主细胞内表达靶向病原菌效应蛋白基因的干扰片段,在小麦条锈菌侵染过程中通过吸器跨界转运到病原菌,从而特异沉默病原菌靶标基因[31-33]。利用细菌Ⅲ型分泌系统(T3SS)可将病原菌效应蛋白直接转入寄主细胞,为在小麦中瞬时表达条锈菌基因提供了技术支持[29]。这些技术的发展,为解析活体营养专性寄生真菌的基因功能奠定了基础,并促进了小麦条锈菌效应蛋白的鉴定与功能研究。
通过HIGS瞬时沉默及T3SS介导的瞬时表达技术,鉴定到一批显著影响条锈菌致病力的效应蛋白,如Hasp68、Hasp2和Hasp98[21,34-35]。研究表明这些效应蛋白基因沉默后均显著降低条锈菌致病力,瞬时表达抑制小麦的PTI和ETI。本研究鉴定并克隆了一个在吸器阶段诱导表达的条锈菌效应蛋白基因,小麦上瞬时表达效应蛋白能够抑制小麦PTI相关胼胝质积累及无毒条锈菌生理小种诱导的免疫反应,促进条锈菌生长发育,瞬时沉默则显著降低条锈菌致病力,表明Hasp83为影响条锈菌致病力的关键效应蛋白。不同于Hasp8[36]在条锈菌侵染前期诱导表达,在条锈菌侵染小麦早期及后期均诱导表达,特别在72 h达到表达高峰,表明在条锈菌侵染早期与寄主建立寄生关系及后期在小麦叶肉细胞间的扩展中均发挥功能。
3.2 小麦条锈菌效应蛋白调控寄主免疫的作用机制
小麦条锈菌效应蛋白能够通过多种作用途径调控寄主的免疫反应。Pst_12806、Pst_4和Pst_5通过干扰叶绿体光合作用抑制叶绿体介导免疫,促进致病[18-19]。富含甘氨酸和丝氨酸效应蛋白PstGSRE1及细胞核效应蛋白Pst_A23分别通过干扰转录因子TaLOL2入核或寄主pre-mRNA可变剪接,在转录水平和转录后水平调节寄主基因转录,促进病菌侵染[20,37]。Pst18363和Pst27791增强免疫负调控因子Nudix水解酶23(TaNUDX23)及TaRaf46蛋白稳定[23,38],PsSpg1则通过提高感病基因激酶活性抑制寄主抗病性[22]。这类效应蛋白操纵寄主感病基因介导小麦感病性,另外一类效应蛋白则通过抑制免疫正调控因子的活性,抑制寄主免疫。Hasp98和 PstGSRE4分别抑制寄主免疫正调控激酶TaMAPK4的活性,铜锌超氧化物歧化酶TaCZSOD2活性,导致寄主活性氧积累减少,介导条锈菌致病力[21,39]。本研究中,Hasp83与小麦过敏性坏死(HR)诱导蛋白Tahir1互作。在玉米与大麦中,的表达与寄主植物局部细胞坏死及抗病反应相关[40-41]。Athir1和Athir2能够与NB-LRR类抗病蛋白RPS2形成复合体激活植物的ETI,在拟南芥中过表达和显著减弱丁香假单胞菌DC3000生长与侵染[42]。水稻Oshir1蛋白定位在细胞质膜上,与LRR类抗性蛋白Oslrr1互作,促进植物的过敏性坏死,以阻止丁香假单胞菌DC3000的进一步侵染与扩展[43]。研究表明Hir蛋白通常与R蛋白互作,介导植物抗病HR。鉴于过敏性坏死诱导蛋白在植物抗病HR的重要作用[40-41],推测效应蛋白Hasp83通过与Tahir1互作,影响Tahir1功能抑制HR反应,可能通过干扰Tahir1与R蛋白的互作,影响Tahir1稳定或活性等作用机制。后续对Tahir1在小麦抗条锈病及HR反应中的功能,及Hasp83调控Tahir1抑制小麦HR,降低抗病性的作用机制需进一步研究。在深入揭示作用机理的基础上,有望通过沉默创制RNAi小麦,精准编辑Tahir1与Hasp83互作位点打破二者互作,创制抗病小麦材料。
4 结论
Hasp83可作为小麦条锈菌的重要效应蛋白,具有抑制寄主免疫增强病原菌致病力的毒性功能,效应蛋白Hasp83与小麦过敏性坏死诱导蛋白Tahir1互作。
[1] 陈万权, 徐世昌, 吴立人. 中国小麦条锈病流行体系与持续治理研究回顾与展望. 中国农业科学, 2007, 40(增刊1): 177-183.
Chen W Q, Xu S C, Wu L R. Epidemiology and sustainable management of wheat stripe rust caused byWest. in China: A historical retrospect and prospect.Scientia Agricultura Sinica, 2007, 40 (Suppl. 1): 177-183. (in Chinese)
[2] 陈万权, 康振生, 马占鸿, 徐世昌, 金社林, 姜玉英. 中国小麦条锈病综合治理理论与实践. 中国农业科学, 2013, 46(20): 4254-4262.
CHEN W Q, KANG Z S, MA Z H, Xu S C, Jin S L, JIANG Y Y. Integrated management of wheat stripe rust caused byf. sp.in China. Scientia Agricultura Sinica, 2013, 46(20): 4254-4262. (in Chinese)
[3] WAN A M, ZHAO Z H, CHEN X M, HE Z H, JIN S L, JIA Q Z, YAO G, YANG J X, WANG B T, LI G B, BI Y Q, YUAN Z Y. Wheat stripe rust epidemic and virulence off. sp.in China in 2002. Plant Disease, 2004, 88(8): 896-904.
[4] CHEN W Q, WU L R, LIU T G, XU S C, JIN S L, PENG Y L, WANG B T. Race dynamics, diversity, and virulence evolution inf. sp., the causal agent of wheat stripe rust in China from 2003 to 2007. Plant Disease, 2009, 93(11): 1093-1101.
[5] WAN A M, CHEN X M, HE Z H. Wheat stripe rust in China. Australian Journal of Agricultural Research, 2007, 58(6): 605-619.
[6] LINE R F. Stripe rust of wheat and barley in North America: a retrospective historical review. Annual Review of Phytopathology, 2002, 40: 75-118.
[7] FISHER M C, HENK D A, BRIGGS C J, BROWNSTEIN J S, MADOFF L C, MCCRAW S L, GURR S J. Emerging fungal threats to animal, plant and ecosystem health. Nature, 2012, 484(7393): 186-194.
[8] JONES J D G, DANGL J L. The plant immune system. Nature, 2006, 444(7117): 323-329.
[9] YU X, FENG B M, HE P, SHAN L B. From chaos to harmony: Responses and signaling upon microbial pattern recognition. Annual Review of Phytopathology, 2017, 55: 109-137.
[10] HE Q, MCLELLAN H, BOEVINK P C, BIRCH P R J. All roads lead to susceptibility: The many modes of action of fungal and oomycete intracellular effectors. Plant Communications, 2020, 1(4): 100050.
[11] STAPLES R C. Nutrients for a rust fungus: the role of haustoria. Trends in Plant Science, 2001, 6(11): 496-498.
[12] GIRALDO M C, VALENT B. Filamentous plant pathogen effectors in action. Nature Reviews. Microbiology, 2013, 11(11): 800-814.
[13] CATANZARITI A M, DODDS P N, ELLIS J G. Avirulence proteins from haustoria-forming pathogens. FEMS Microbiology Letters, 2007, 269(2): 181-188.
[14] GARNICA D P, NEMRI A, UPADHYAYA N M, RATHJEN J P, DODDS P N. The ins and outs of rust haustoria. PLoS pathogens, 2014, 10(9): e1004329.
[15] ZHENG W M, HUANG L L, HUANG J Q, WANG X J, CHEN X M, ZHAO J, GUO J, ZHUANG H, QIU C Z, LIU J,. High genome heterozygosity and endemic genetic recombination in the wheat stripe rust fungus. Nature Communications, 2013, 4: 2673.
[16] XU Q, TANG C L, WANG L K, ZHAO C C, KANG Z S, WANG X J. Haustoria-arsenals during the interaction between wheat andf. sp.. Molecular Plant Pathology, 2020, 21(1): 83-94.
[17] XU Q, WANG J F, ZHAO J R, XU J H, SUN S T, ZHANG H F, WU J J, TANG C L, KANG Z S, WANG X J. A polysaccharide deacetylase fromf. sp.is an important pathogenicity gene that suppresses plant immunity. Plant Biotechnology Journal, 2020, 18(8): 1830-1842.
[18] XU Q, TANG C L, WANG X D, SUN S T, ZHAO J R, KANG Z S, WANG X J. An effector protein of the wheat stripe rust fungus targets chloroplasts and suppresses chloroplast function. Nature Communications, 2019, 10(1): 5571.
[19] WANG X D, ZHAI T, ZHANG X M, TANG C L, ZHUANG R, ZHAO H B, XU Q, CHENG Y L, WANG J F, DUPLESSIS S, KANG Z S, WANG X J. Two stripe rust effectors impair wheat resistance by suppressing import of host Fe-S protein into chloroplasts. Plant Physiology, 2021, 187(4): 2530-2543.
[20] 许强. 小麦条锈菌效应蛋白Pst_A23调控植物pre-mRNA可变剪切抑制植物免疫[D]. 杨凌: 西北农林科技大学, 2020.
XU Q. Pre-mRNA regulation mediated byeffector Pst_A23 suppresses plant immunity[D]. Yangling: Northwest A&F University, 2020. (in Chinese)
[21] WEI J P, WANG X D, HU Z Y, WANG X J, WANG J L, WANG J F, HUANG X L, KANG Z S, TANG C L. Theeffector Hasp98 facilitates pathogenicity by blocking the kinase activity of wheat TaMAPK4. Journal of integrative plant biology, 2023, 65(1): 249-264.
[22] WANG N, TANG C L, FAN X, HE M Y, GAN P F, ZHANG S, HU Z Y, WANG X D, YAN T, SHU W X,. Inactivation of a wheat protein kinase gene confers broad-spectrum resistance to rust fungi. Cell, 2022, 185(16): 2961-2974.
[23] WAN C P, LIU Y, TIAN S X, GUO J, BAI X X, ZHU H C, KANG Z S, GUO J. A serine-rich effector from the stripe rust pathogen targets a Raf-like kinase to suppress host immunity.Plant Physiology, 2022, 190(1): 762-778.
[24] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research, 2001, 29(9): 2002-2007.
[25] HOLZBERG S, BROSIO P, GROSS C, POGUE G P. Barley stripe mosaic virus-induced gene silencing in a monocot plant. The Plant Journal, 2002, 30(3): 315-327.
[26] LACOMME C, CRUZ S S. Bax-induced cell death in tobacco is similar to the hypersensitive response. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(14): 7956-7961.
[27] ABRAMOVITCH R B, KIM Y J, Chen S R, DICKMAN M B, MARTIN G B.type III effector AvrPtoB induces plant disease susceptibility by inhibition of host programmed cell death. The EMBO Journal, 2003, 22(1): 60-69.
[28] JAMIR Y, GUO M, OH H S, PETNICKI-OCWIEJA T, CHEN S R, TANG X Y, DICKMAN M B, COLLMER A, ALFANO J R. Identification oftype III effectors that can suppress programmed cell death in plants and yeast. The Plant Journal, 2004, 37(4): 554-565.
[29] YIN C T, HULBERT S. Prospects for functional analysis of effectors from cereal rust fungi. Euphytica, 2011, 179(1): 57-67.
[30] XIN X F, HE S Y.pv.DC3000: a model pathogen for probing disease susceptibility and hormone signaling in plants. Annual Review of Phytopathology, 2013, 51: 473-498.
[31] QI T, GUO J, PENG H, LIU P, KANG Z S, GUO J. Host-induced gene silencing: A powerful strategy to control diseases of wheat and barley. International Journal of Molecular Sciences, 2019, 20(1): 206.
[32] KOCH A, WASSENEGGER M. Host-induced gene silencing— mechanisms and applications. New Phytologist, 2021, 231(1): 54-59.
[33] NOWARA D, GAY A, LACOMME C, SHAW J, RIDOUT C, DOUCHKOV D, HENSEL G, KUMLEHN J, SCHWEIZER P. HIGS: Host-induced gene silencing in the obligate biotrophic fungal pathogen. The Plant Cell, 2010, 22(9): 3130-3141.
[34] 於立刚, 齐晓晚, 魏晋萍, 王婷, 王晓杰, 康振生, 汤春蕾. 条形柄锈菌吸器特异效应蛋白Hasp68抑制寄主免疫并与小麦组织蛋白酶B互作. 菌物学报, 2020, 39(10): 1905-1919.
YU L G, QI X W, WEI J P, WANG T, WANG X J, KANG Z S, TANG C L. A haustorium-specific effector protein Hasp68 ofsuppresses wheat immunity by targeting wheat cathepsin B TaCTSB. Mycosystema, 2020, 39(10): 1905-1919. (in Chinese)
[35] 季森, 赵梦鑫, 徐静华, 汤春蕾, 康振生, 王晓杰. 小麦条锈菌效应蛋白HASP2抑制寄主免疫反应. 植物病理学报, 2019, 49(3): 326-333.
JI S, ZHAO M X, XU J H, TANG C L, KANG Z S, WANG X J. Wheat stripe rust effector HASP2 inhibits host immune response. Acta Phytopathologica Sinica, 2019, 49(3): 326-333. (in Chinese)
[36] 赵聪聪, 盛丽梅, 许强, 汤春蕾, 康振生, 王晓杰. 小麦条锈菌细胞质效应子Hasp8抑制植物基础免疫. 植物保护学报, 2020, 47(3): 537-545.
ZHAO C C, SHENG L M, XU Q, TANG C L, KANG Z S, WANG X J. Cytoplasmic effector Hasp8 off. sp.inhibits plant immunity. Journal of Plant Protection, 2020, 47(3): 537-545. (in Chinese)
[37] QI T, GUO J, LIU P, HE F X, WAN C P, Islam M A, TYLER B M, KANG Z S, GUO J. Stripe rust effector PstGSRE1 disrupts nuclear localization of ROS-promoting transcription factor TaLOL2 to defeat ROS-induced defense in wheat. Molecular Plant, 2019, 12(12): 1624-1638.
[38] YANG Q, HUAI B Y, LU Y X, CAI K Y, GUO J, ZHU X G, KANG Z S, GUO J. A stripe rust effector Pst18363 targets and stabilises TaNUDX23 that promotes stripe rust disease. New Phytologist, 2020, 225(2): 880-895.
[39] LIU C, WANG Y Q, WANG Y F, DU Y Y, SONG C, SONG P, YANG Q, HE F X, BAI X X, HUANG L L, GUO J, KANG Z S, GUO J. Glycine-serine-rich effector PstGSRE4 inf. sp.inhibits the activity of copper zinc superoxide dismutase to modulate immunity in wheat. PLoS pathogens, 2022, 18(7): e1010702.
[40] NADIMPALLI R, YALPANI N, JOHAL G S, SIMMONS C R. Prohibitins, stomatins, and plant disease response genes compose a protein superfamily that controls cell proliferation, ion channel regulation, and death. The Journal of Biological Chemistry, 2000, 275(38): 29579-29586.
[41] ROSTOKS N, SCHMIERER D, KUDRNA D, KLEINHOFS A. Barley putative hypersensitive induced reaction genes: genetic mapping, sequence analyses and differential expression in disease lesion mimic mutants. Theoretical and Applied Genetics, 2003, 107(6): 1094-1101.
[42] QI Y P, TSUDA K, NGUYEN L V, WANG X, LIN J S, MURPHY A S, GLAZEBROOK J, Thordal-CHRISTENSEN H, KATAGIRI F. Physical association ofhypersensitive induced reaction proteins (HIRs) with the immune receptor RPS2. The Journal of Biological Chemistry, 2011, 286(36): 31297-31307.
[43] ZHOU L, CHEUNG M Y, LI M W, FU Y P, SUN Z X, SUN S M, LAM H M. Rice hypersensitive induced reaction protein 1 (OsHIR1) associates with plasma membrane and triggers hypersensitive cell death. BMC Plant Biology, 2010, 10: 290.
Functional Analysis of Effector Hasp83 in the Pathogenicity off. sp.
WANG JianFeng, Cheng JiaXin, Shu WeiXue, Zhang YanRu, WANG XiaoJie, KANG ZhenSheng, TANG ChunLei
College of Plant Protection, Northwest A&F University/State Key Laboratory of Crop Stress Biology for Arid Areas, Yangling 712100, Shaanxi
【Background】Wheat stripe rust is a serious disease on wheat, which is caused byf. sp.().is an obligate biotrophic fungus, which can form haustorium during infection and absorb nutrients from the host plants via haustorium. Moreover,secretes effectors through haustorium to regulate host immunity and promotes the infection process.【Objective】The objective of this study is to clarify the function and mechanism ofeffectors, and to reveal the pathogenicity mechanism of.【Method】By comparing the transcriptome ofurediospore, germinated tube and haustorium,encoding secreted protein was identified to be significantly induced in haustorium, and whether it could inhibit the cell death caused by BAX onleaves was observed through-mediated transient expression. qRT-PCR was used to detect the expression level ofduring differentinfection stages in wheat. The type Ⅲ secretion system (T3SS) ofEtHan and host induced gene silencing (HIGS) were carried out to investigate the function ofduringinfection. The yeast two-hybrid (Y2H) system was used to screen the proteins interacting with Hasp83 in wheat, and co-inmunoprecipitation (Co-IP) assay was used to further verify the interaction by co-expressing Hasp83 and its candidate target proteins incells.【Result】The open reading frame (ORF) ofis 522 bp, encoding 173 amino acids. Hasp83 contains no conserved domain, and the N-terminal 1-29 amino acids encode a signal peptide, which could inhibit the cell death caused by BAX onleaves through-mediated transient expression. qRT-PCR analysis revealed thatwas up-regulated duringinfection in wheat. Transient expression of, and lead to 19.35%-38.62% decrease of reactive oxygen species (ROS) accumulation area and necrotic cell area caused by the avirulentrace CYR23 in wheat. Silencing ofby HIGS in Suwon11 wheat leaves infected with the virulentrace CYR31 significantly reduced pathogenicity ofcompared to controls, resulting in less urediospore sporulation, shorter infection hyphal length, smaller infection area, and decreased haustorium number. Y2H result showed that the effector Hasp83 interacted with wheat hypersensitive-induced reaction (HIR) protein, Tahir1. The interaction between Hasp83 and Tahir1 was further confirmed by Co-IP assay in.【Conclusion】effector Hasp83 can suppress wheat immunity caused by the non-pathogenic bacteria and avirulent, and enhance the pathogenicity of.
wheat stripe rust; haustorium; effector; transcriptome analysis; identification of target protein

10.3864/j.issn.0578-1752.2023.05.005
2022-10-31;
2022-12-19
国家重点研发计划(2021YFD1401000)、国家小麦产业技术体系(CARS-03)、中央高校基本科研业务费专项(2452020223)
王建锋,E-mail:ipp@nwsuaf.edu.cn。通信作者汤春蕾,E-mail:tclbad@163.com
(责任编辑 岳梅)

