基于ACE2受体探讨玉屏风散预防新型冠状病毒肺炎的网络药理学机制∗
王 登,王 娣,曹 青,闫抗抗△
1 西北大学附属医院/西安市第三医院,陕西 西安 710018; 2 陕西省中医药研究院,陕西 西安 710016
中医药学是一个动态辨证论治和整体观念指导的医学体系,抗击疫病具有上千年的临床经验,在各个时期都发挥着无法替代的积极作用。“治未病”是中医药预防疫病的特色,新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)疫情发生后,各地根据“三因制宜”相继出台了多个中药预防方案。本课题组前期通过对各地诊疗方案用药规律进行数据挖掘,发现各地发布的预防类处方中,玉屏风散的使用频次最高[1]。《新型冠状病毒肺炎中医诊疗手册》也提到对于未能明确诊断的轻型患者,时邪犯表证使用葱豉汤合玉屏风散加味[2]。可见玉屏风散对COVID-19具有一定的预防作用。
血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)受体在肺组织中主要分布于Ⅱ型肺泡细胞,严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)可能利用宿主细胞ACE2受体,使用其刺突蛋白进入靶细胞,从而感染宿主[3]。所以ACE2相关基因是干预COVID-19的重要靶点。已有研究证实,玉屏风散的主要成分黄芪,对代谢综合征大鼠肾脏ACE2 mRNA的表达具有一定调节作用[4]。提示玉屏风散可能介导ACE2受体预防COVID-19,但是鉴于中药复方多成分、多靶点、多通路等作用特点,目前玉屏风散预防COVID-19的作用机制尚未完全阐明。本研究借助网络药理学的研究方法,对玉屏风散介导ACE2受体预防COVID-19的有效成分、作用靶点及信号通路进行探索,利用GO(gene ontology)和KEGG(kyoto encyclopedia of genes and genomes)信号通路富集分析其潜在作用机制,以期为其临床应用提供新的依据。
1 资料与方法
1.1 玉屏风散活性成分的筛选及靶点基因预测玉屏风散由黄芪、白术、防风3味中药组成。利用中药系统药理数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)数据库(http://tcmspw.com/tcmsp.php)检索3味药材所有活性成分,并利用口服生物利用度(oral bioavailability,OB)和类药性(drug likeness,DL)两个药物动力学参数对所有活性成分进行筛选,设置条件为OB≥30%和DL≥0.18,将筛选后的化合物作为候选成分。采用TCMSP数据库检索玉屏风散所有活性成分潜在的蛋白靶点,并使用Uniprot数据库(https://www.uniprot.org)中的UniprotKB搜索功能,通过输入查询到的靶蛋白名称,并限定物种为“Homo sapiens”,剔除非人源靶点,获取活性成分靶点的标准基因名称。
1.2 COVID-19靶点的检索及相互靶点Venn分析本研究利用WANG等[5]对结肠上皮细胞测序结果识别到的与ACE2共表达的5556个基因,与玉屏风散活性成分对应的基因进行Venn分析,得到共同的交集基因。
1.3 构建 “中药-活性成分-靶点-疾病”网络图将交集基因采用网络图像化软件Cytoscape 3.7.2构建“中药-活性成分-靶点-疾病”网络图。“中药-活性成分-靶点-疾病”网络图的核心架构是网络,每个节点(node)是基因、蛋白质或分子等,节点与节点之间的连接(edge)代表这些生物分子之间的相互作用[6]。本次网络中节点(node)表示中药、活性成分、基因靶点、疾病。
1.4 蛋白质-蛋白质相互作用关系(proteinprotein interaction,PPI)网络图构建将交集基因在线导入STRING数据库(https://string-db.org),限定物种人,进行蛋白相互作用分析,设置交互作用可信度等级为高可信度(≥0.7),构建蛋白质-蛋白质相互作用关系网络图,寻找靶点和靶点间的作用关系。并将结果导入Cytoscape软件进行网络图优化,其中节点大小和颜色设置用于反映度值的大小,边的粗细和颜色设置用于反映结合率评分的大小[6]。使用度值、介数中心性筛选关键靶点。
1.5 GO与KEGG通路富集分析使用DAVID生物学信息注释数据库(https://david.ncifcrf.gov)对网络合并后获得的交集基因进行GO富集分析和KEGG信号通路富集分析。将交集靶点导入DAVID数据库,Select identifier设置为OFFICIAL GENE SYMBOL,List Type设置为GeneList,限定物种为人,对作用靶点进行基因本体(gene ontology,GO)分析和KEGG通路分析,P<0.05为差异有统计学意义。富集分析GO生物学过程包括:生物过程、分子功能、细胞组成分3个模块绘制条形图[7],KEGG分析结果做气泡图。
2 结果
2.1 玉屏风散活性成分的筛选及靶点基因预测从TCMSP数据库中搜索组成玉屏风散的3味中药的化合物成分,得到结果:黄芪87个,白术55个,防风173个。根据OB>30%及DL≥0.18要求,删去重复的化合物,最终选定44个化合物,其中白术7个,黄芪20个,防风18个,白术与黄芪有1个共同成分。通过TCMSP数据库检索得到黄芪对应的蛋白靶点218个,白术19个,防风70个,删去重复靶点,并在Uniprot数据库检索其对应“人”的基因名称,最终得到基因靶点197个。
2.2 COVID-19靶点的搜集及靶点Venn分析通过文献获得与ACE2共表达的5556个基因,将ACE2相关靶点基因与活性成分对应的靶点基因取交集进行韦恩分析,共得到56个靶点。表明这56个靶点可能是玉屏风散介导ACE2预防COVID-19的关键靶点。基因维恩分析如图1所示,交集基因靶点如表1所示。

表1 玉屏风散介导ACE2预防COVID-19的关键靶点
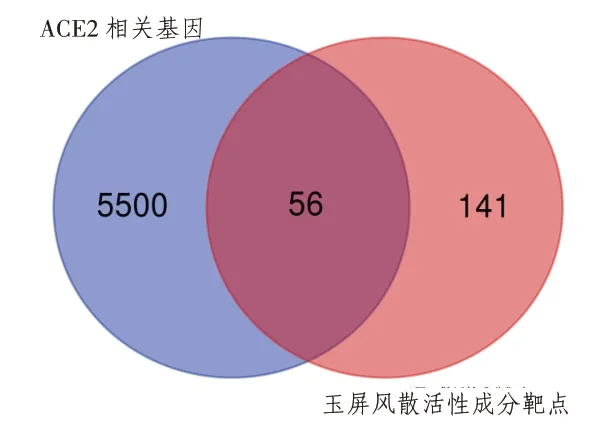
图1 玉屏风散成分靶基因与ACE2相关靶点基因维恩分析图
2.3 构建“中药-活性成分-靶点-疾病”网络图将获得的56个关键靶基因映射所属成分,发现44种有效成分中有26种成分参与对关键靶基因的调控,构建成分靶点关系对文件,使用Cytoscape 3.7.2软件构建“中药-成分-靶点-疾病”网络关系图,网络关系图见图2。

图2 玉屏风散“中药-活性成分-靶点-疾病”网络
2.4 PPI网络构建采用STRING数据库构建蛋白相互作用网络,结果导入Cytoscape 3.7.2软件构建可视化网络关系图,见图3。结果共涉及65个节点,78条边。选择度值≥5,介数中心性≥0.1的节点作为主要靶点,则相互作用的主要靶点为天冬氨酸特异性酶切半胱氨酸蛋白酶3(Caspase-3,CASP3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、β型蛋白激酶C(protein kinase C beta type,PRKCB)、雌激素受体(estrogen receptor,ER)、表皮生长因子前体(proepidermal growth factor,EGF)等相互作用。
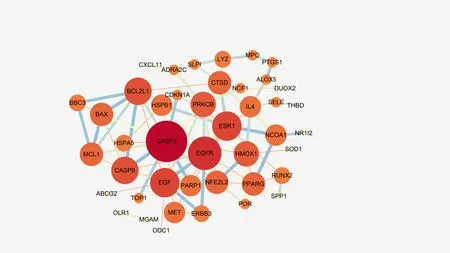
图3 玉屏风散介导ACE2受体预防COVID-19靶标蛋白互作网络图
2.5 关键基因靶点Go富集分析对筛选得到的56个关键靶点进行GO分析,设定阈值P<0.05,共富集到156条生物学过程,其中生物过程(biological process,BP)条目105个,细胞组成(cellular component,CC)条目20个,分子功能(molecular function,MF)条目31个,分别占67.31%、12.82%、19.87%。筛选P值较小的生物学过程绘图,见图4—6。BP主要涉及缺乏配体时的体外凋亡信号通路、凋亡过程负调控、凋亡线粒体的变化、药物反应、氧化还原过程等。CC涉及细胞外间隙、Bcl-2家族蛋白复合物、膜筏、线粒体外膜、细胞外外泌体、胞质等。MF涉及蛋白结合、酶结合、蛋白质同源二聚化活性、BH3域结合、RNA聚合酶Ⅱ转录因子活性等。
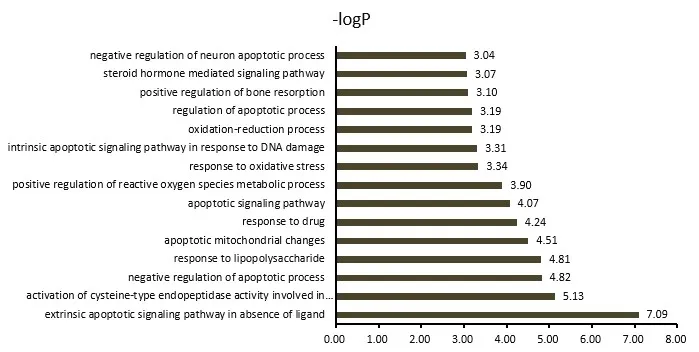
图4 玉屏风散介导ACE2受体预防COVID-19关键靶点的BP富集分析
2.6 通路KEGG富集分析KEGG富集分析筛选到27条通路,其中18条具有显著意义(P≤0.05),结果见表2。KEGG功能注释富集分析提示,玉屏风散可能作用包括癌症通路、HIF-1信号通路、癌症中的转录失调、p53信号通路、PI3K-Akt信号通路、细胞凋亡等通路。这些表明玉屏风散可通过多个通路介导ACE2受体发挥预防COVID-19的作用。进一步对KEGG富集分析结果进行可视化处理,图形化结果见图7。

表2 玉屏风散介导ACE2关键靶点KEGG富集信号通路
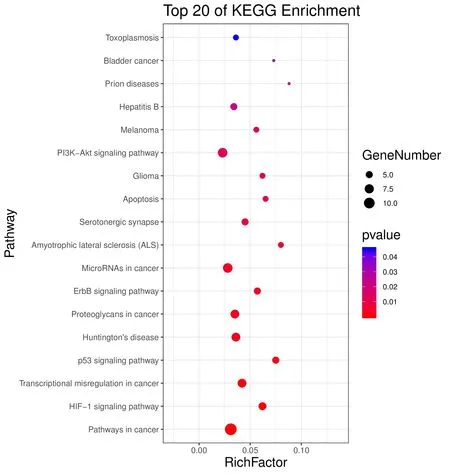
图7 玉屏风散介导ACE2预防COVID-19潜在核心靶点的KEGG富集分析

图5 玉屏风散介导ACE2受体预防COVID-19关键靶点的CC富集分析
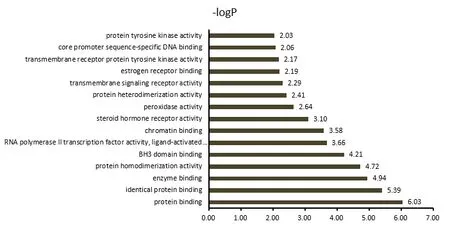
图6 玉屏风散介导ACE2受体预防COVID-19关键靶点的MF富集分析
3 讨论
玉屏风散具有益气固表止汗的功用,用于治疗表虚自汗[8]。临床广泛用于呼吸道疾病,如反复上呼吸道感染、流行性感冒、难治性支原体肺炎、支气管哮喘等[9]。最新研究发现,玉屏风散发酵多糖具有双向免疫调节作用,可增强进淋巴细胞增殖[10]。另外,研究发现玉屏风散具有抑制病毒复制的作用。动物实验研究发现,加味玉屏风散可抑制预处理小鼠病毒融合受体ICAM-1的表达,抑制病毒附着、病毒渗透,降低细胞对病毒入侵的敏感性,可以预防流感病毒和人呼吸道合胞病毒引起的呼吸道病毒感染[11]。在2003年非典型肺炎流行期间,北京中医药大学东直门医院姜良铎、周平安教授推荐的预防处方和上海汉殷药业生产的扶正祛邪口服液中均包含玉屏风散[12]。本次疫情期间中医药防治方案中也大多推荐玉屏风散加减方作为预防用药[13]。可见,玉屏风散对COVID-19具有一定的预防作用,但其具体作用机制尚不明确。
研究发现,ACE2受体蛋白是SARS-Cov-2入侵人体细胞的关键,SARS-Cov-2表面的S蛋白与人体细胞表面的ACE2蛋白结合,再通过细胞的胞吞作用进入细胞,感染组织。所以,若能阻断SARSCov-2与ACE2的结合,便可能阻止病毒感染[13]。黄芪是玉屏风散的重要组成药物,研究发现黄芪对代谢综合征大鼠肾脏ACE2 mRNA的表达具有一定调节作用[4]。黄芪的水和甲醇提取物对禽流感H9病毒具有一定的抑制作用[14]。所以,玉屏风散可能通过调控ACE2相关靶点,而发挥预防COVID-19的作用。网络分析的结果显示,玉屏风散的3味药物共含44种不同的化合物,对应197个靶点,其中56个靶点为ACE2相关基因的交集靶点。可见,玉屏风散可能对机体ACE2受体相关表达具有一定的调控作用。
蛋白质相互作用结果显示玉屏风散的有效成分可能是通过CASP3、EGFR、PRKCB、ESR1、EGF等药物-疾病共有靶点网络起作用。研究发现,ACE2与Caspase家族密切相关,ACE2基因敲除小鼠主动脉血管平滑肌细胞活性氧和凋亡明显增加,同时裂解caspase-3和裂解caspase-8水平升高[15]。病毒感染机体除引起氧化应激损伤和炎症反应外,还可诱导宿主细胞发生凋亡,凋亡信号传导以Caspase激活开始,其中Caspase-3是Caspase家族中最重要的凋亡执行者,是引发细胞凋亡的关键酶,可降解细胞内的结构蛋白及维持基因组稳定和对细胞周期起调控作用,导致细胞发生凋亡[16]。所以,CASP3可能通过与ACE2相互影响而作用于病毒感染。在呼吸道,EGFR广泛表达于上皮细胞,EGFR活化后能够募集中性粒细胞,产生黏蛋白,促进分泌抗菌多肽并清除病原微生物等[17]。研究发现,ACE2表达与EGFR密切相关,EGFR突变的原发性肺腺癌中,ACE2的表达水平远高于正常肺上皮细胞[18]。所以,EGFR可能是玉屏散介导ACE2预防COVID-19的关键靶点。
GO分析结果显示,BP分析可见玉屏风散的生物过程主要涉及缺乏配体时的体外凋亡信号通路、凋亡过程负调控、凋亡线粒体的变化、药物反应、氧化还原过程等。研究发现,黄芪注射液具有明显的抗流感病毒活性,可以提高被感染细胞的存活率,同时提高流感病毒对感染后细胞周期的阻断作用[19]。CC分析可见玉屏风散靶点主要涉及细胞外间隙、Bcl-2家族蛋白复合物、膜筏、线粒体外膜、细胞外外泌体、胞质等。病毒进入人体后,最外层的刺突蛋白通过与人的呼吸道上皮细胞表面特异性受体(ACE2蛋白)结合,再通过细胞的胞吞作用进入细胞,冠状病毒进入细胞后直接以病毒基因组RNA为翻译模板,表达出病毒RNA聚合酶[20]。再利用这个酶完成负链亚基因组RNA的转录合成、各种结构蛋白mRNA的合成,以及病毒基因组RNA的复制,这些都在细胞质内进行。MF分析可见玉屏风散的靶点主要涉及蛋白结合、酶结合、蛋白质同源二聚化活性、BH3域结合、RNA聚合酶II转录因子活性等分子功能。SARS-Cov-2是一种单链RNA正链包膜β冠状病毒,其基因组编码结构蛋白刺突糖蛋白,刺突蛋白与ACE2蛋白结合,再通过细胞的胞吞作用进入细胞。另外,冠状病毒感染细胞是一个复杂的过程,需要ACE2受体结合和刺突糖蛋白的蛋白水解过程的协同作用来促进病毒-细胞融合。在宿主细胞感染病毒之后,宿主的蛋白酶对S蛋白进行蛋白水解,产生两个功能亚单位,即S1和S2。S1亚单位包括受体结合区,S2锚定在病毒膜上促进病毒细胞融合。因此,刺突糖蛋白被认为是开发抗病毒药物的重要靶标[21]。
KEGG通路分析结果显示,玉屏风散预防COVID-19主要涉及癌症通路、HIF-1信号通路、癌症中的转录失调、p53信号通路、PI3K-Akt信号通路、细胞凋亡等通路。HIF-1α是HIF-1的亚单位组成,是缺氧状态下激活的关键转录因子,在缺氧条件下可稳定表达,是维持细胞内氧环境稳定的核心转录因子。研究发现,HIF-1α是肺部炎性损伤的关键因子[22]。在缺氧条件下HIF-1α可抑制ACE2的表达,而ACE催化的ANGⅡ的积累是HIF-1α下调ACE2的关键中介物[23]。另外PI3K/AKT通路与呼吸系统疾病发生发展密切相关[24]。研究发现,PI3K/AKT信号通路在ACE2促进内皮细胞eNOS活性中发挥重要作用[25]。提高的ACE2可通过AT1受体-PI3K/AKT途径减弱小鼠系膜细胞血管紧张素Ⅱ诱导的胶原生成,改善促纤维化作用[26]。可见,ACE2与PI3K/AKT通路可能存在一定的交互作用,PI3K/AKT通路可能介导ACE2参与玉屏风散对COVID-19预防。
综上所述,本研究采用网络药理学方法对玉屏风散主要有效成分作用于ACE2相关基因进行分析,初步探索其潜在预防COVID-19的分子机制,结果表明,玉屏风散是可能通过多成分、多靶点、多通路介导ACE2来发挥预防COVID-19的作用,其中CASP3、EGFR等基因可能为其作用关键靶点,HIF-1信号通路、PI3K-Akt信号通路等通路可能参与其中,但其具体机制有待进一步研究。

