视网膜母细胞瘤基因表达谱的生物信息学分析
陈 靖,许 诺,,崔 乙,牟 宁,简天明,吉 玲
0 引言
视网膜母细胞瘤是一种婴幼儿最常见的眼内发育性恶性肿瘤[1-3]。随着临床医生对视网膜母细胞瘤认识的逐渐深入,在不影响生存率的前提下出现了全身静脉、眼动脉化学治疗,局部激光光凝治疗、玻璃体腔化疗、冷冻治疗、巩膜敷贴外放射治疗、经瞳孔温热治疗等保眼与保视力的治疗方式[4]。然而,尽管视网膜母细胞瘤在发达国家的生存率大于95%,但在中低收入国家由于诊断不及时等原因其总体生存率仅为25%~65%[5]。因此深入了解视网膜母细胞瘤发生发展的关键分子,寻找患者早期诊断与治疗新靶点仍具有重要的基础与临床意义。
随着基因芯片的转录组数据与生物信息学分析算法的发展,学者们可以利用全世界范围内的高通量数据进行整合分析并筛选出差异表达的基因,并能够提供更敏感和更特异的靶点来预测肿瘤预后并辅助治疗。然而目前基于公共数据库中视网膜母细胞瘤数据进行诊断与治疗靶点筛选的研究报道较为稀缺。因此本研究拟通过生物信息学方法对视网膜母细胞瘤患者与正常视网膜的转录组芯片数据进行挖掘并筛选出候选关键基因,并在视网膜母细胞瘤细胞系中进行表达水平验证,为进一步明确视网膜母细胞瘤的发病机制提供数据支持。
1 材料和方法
1.1材料从Gene Expression Omnibus(GEO)(https://www.ncbi.nlm.nih.gov/geo/) 数据库下载基因芯片GSE97508与GSE110811。数据集GSE97508于2017-04提交并于2018-08更新。该数据集所用实验平台为 Affymetrix 公司提供的人类基因表达芯片平台 GPL15207,总共包含9个样本,其中3例为正常成年人视网膜组织,6例为视网膜母细胞瘤组织。数据集GSE110811于2018-02提交并于2019-05更新。该数据集所用实验平台为Affymetrix公司提供的人类基因转录检测2.0 ST平台GPL16686,总共包含34个样本,其中3例为正常成年人视网膜组织,3例为良性视网膜细胞瘤组织,28例为视网膜母细胞瘤组织。
1.2方法
1.2.1数据预处理与差异表达基因的获取使用R语言中的affy 软件包读取基因表达芯片数据(CEL格式数据),处理成表达矩阵,用RMA(robust multi-array average)算法对数据进行归一化处理,用Sva包ComBat函数校正批次效应,并利用各自平台注释文件进行探针注释,去除未匹配的基因探针信息。进一步使用limma软件包对GSE97508与GSE110811中视网膜母细胞瘤肿瘤样本和正常视网膜样本进行差异表达基因(differentially expressed gene,DEG)分析。选取|Log2 (Fold Change)| >1.5且P<0.05作为筛选DEG的标准。将以上两个数据集获取的DEG取交集得到本研究的目标DEG。
1.2.2DEG的功能富集分析使用在线分析工具包括DAVID,KEGG对DEG进行生物学功能与通路的分析并用R进行可视化。DAVID是一个用于功能注释和集成发现基因所代表的生物学意义的在线数据库[6]。KEGG是一个整合了基因组、化学和系统功能信息的数据库,本研究使用KEGG的PATHWAY数据库整合当前DEG涉及的通路信息[7]。基因本体论(gene ontology,GO)分析包括细胞组分(cellular component,CC),用于描述基因产物在细胞中的位置;分子功能(molecular function,MF),用于描述单个基因产物的功能;生物学过程(biological process,BP),用于描述具有多个步骤的有序的生物过程。以P<0.05且错误发现率(false discovery rate,FDR)阈值设置在<0.01。
1.2.3蛋白质-蛋白质相互作用网络与子网络模块分析获取枢纽基因使用在线分析工具STRING (http://string-db.org)进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建[8]。为进一步获得PPI中的枢纽基因,使用Cytoscape软件(http://www.cytoscape.org/)中的CytoHubba与Molecular Complex Detection(MCODE)两个插件筛选枢纽基因[9]。MCODE模块用以发现PPI网络中紧密联系的基因,参数设置:网络分数阈值:2;节点分数阈值:0.2;K-score:2;最大深度:100。CytoHubba采用11种拓扑分析方法对PPI网络数据节点进行排名以推测在基因调控,细胞路径和信号转导中的枢纽基因。本研究采用Degree法纳入值≥10的基因。
1.2.4验证枢纽基因及诊断效能评估本研究纳入一个独立的验证数据集GSE24673对筛选到的枢纽基因进行验证。数据集GSE24673于2010-10提交并于2019-08更新,所用实验平台为 Affymetrix公司提供的人类基因转录检测1.0 ST平台GPL6244,总共包含11个样本,其中2例为正常成年人视网膜组织,9例为视网膜母细胞瘤组织。并在GSE110811中采用受试者工作特征(receiver operating characteristic,ROC)曲线从基因表达量与诊断效能方面验证枢纽基因。采用ROC曲线下的面积(area under ROC curve,AUC)作为判断诊断效能的评价指标。
1.2.5细胞培养本研究采用视网膜母细胞瘤细胞系Y79、Weri-Rb1与HXO-Rb44,对照细胞系采用人RPE细胞系ARPE-19。Y79、Weri-Rb1与HXO-Rb44细胞系采用90% RPMI-1640+10%FBS条件培养;ARPE-19细胞系采用90%DMEM+10%FBS条件培养。置于37℃、体积分数5%CO2培养箱中,隔天换液。显微镜下观察细胞生长至80%~90%进行细胞传代。
1.2.6qRT-PCR验证枢纽基因按照RNA逆转录试剂盒步骤将提取的RNA逆转录合成cDNA。将获取的cDNA分别加入各引物的反应体系中进行实时荧光定量PCR。扩增后进行熔解曲线分析,以β-actin为内参照,采用2-ΔΔCt法计算各目的基因mRNA相对表达量。引物序列见表1。

表1 引物序列
统计学分析:应用R v.3.4.3进行上述生物信息学分析可视化。应用GraphPad Prism v.8.01进行枢纽基因在验证数据集的表达差异验证。两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05认为差异具有统计学意义。
2 结果
2.1视网膜母细胞瘤的差异表达基因与功能富集分析数据集GSE97508筛选出DEG共715个,包括上调基因192个,下调基因523个。数据集GSE110811筛选出DEG共273个,包括上调基因104个,下调基因169个。两者取交集共获得DEG 121个。对DEG的富集分析中KEGG通路富集分析结果发现差异基因主要富集于细胞周期、光传导通路与p53信号通路上(图1),GO分析结果发现DEG的生物学过程(GO-BP)主要富集于可见光接收、视紫红质信号传导通路、有丝分裂细胞核分裂、染色体分离与视紫红质信号传导调节通路上(图2A);细胞组分(GO-CC)主要富集于凝缩的染色体中心粒、纺锤体微管与极点、光感受器内外节膜与光感受器外节等上(图2B);分子功能(GO-MF)主要富集于G蛋白偶连光感受器活性、蛋白结合、微管结合、蛋白激酶活性、ATP结合等功能上(图2C)。
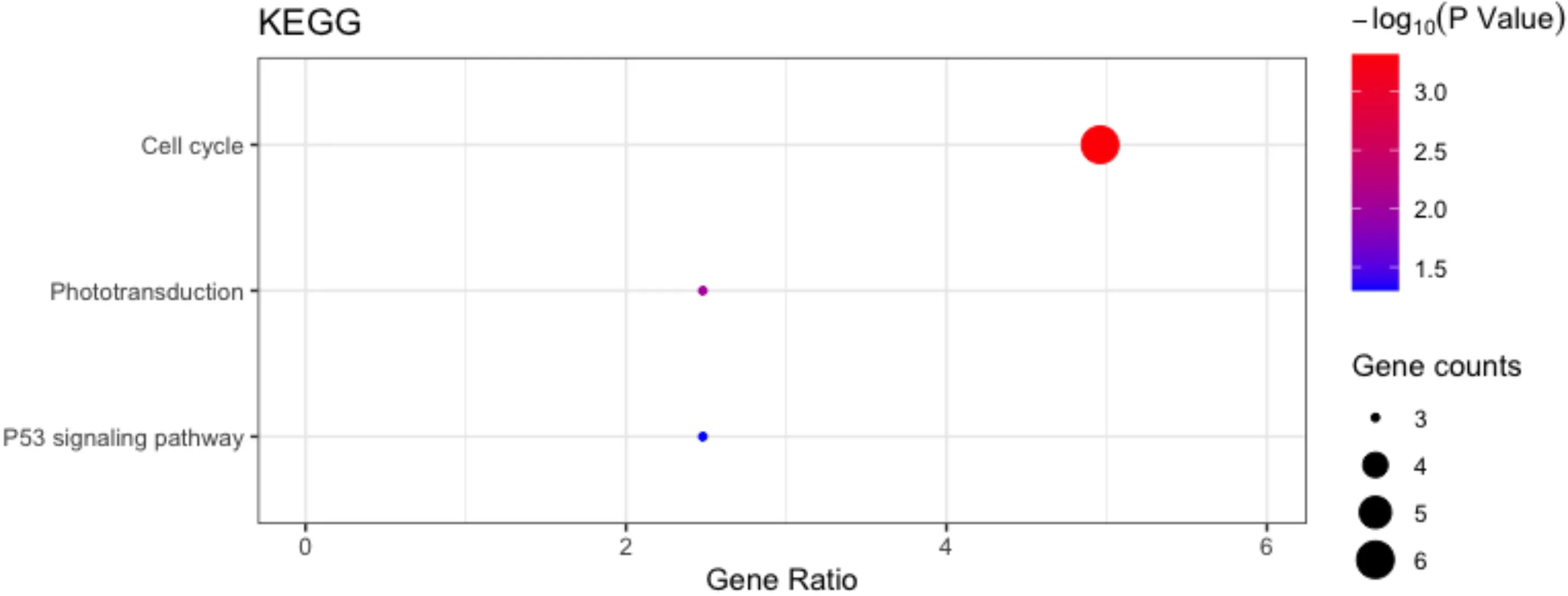
图1 视网膜母细胞瘤DEG的KEGG分析结果。
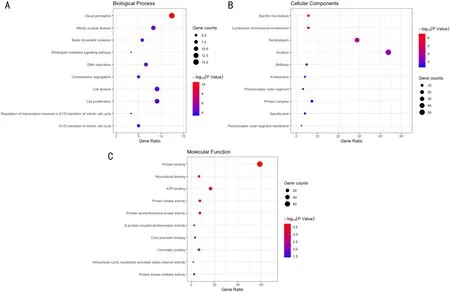
图2 视网膜母细胞瘤DEG的GO分析结果 A:生物学过程;B:细胞组分;C:分子功能。
2.2PPI网络构建及子网络模块分析视网膜母细胞瘤DEG 为进一步了解上述差异基因的蛋白互作网络,我们通过构建DEG的PPI网络(图3A)并利用MCODE插件发现3个子模块,包括子模块1包含的35个上调枢纽基因(图3B);子模块2包含的8个下调枢纽基因(图3C);子模块3包含的3个下调枢纽基因(图3D)。采用CytoHubba插件共得到39个枢纽基因,采用MCODE插件共富集得到46个枢纽基因,两者分别与GSE97508与GSE110811数据集中差异最大的30个基因取交集最终得到MCM6、DTL、UBE2T、TOP2A、NUSAP1、CENPK、RRM2、RLBP1、RHO共9个枢纽基因(表2,图4)。

图3 PPI网络构建与子网络模块图 A:PPI网络图;B:MCODE子模块1;C:MCODE子模块2;D:MCODE子模块3;红色:上调基因;绿色:下调基因。
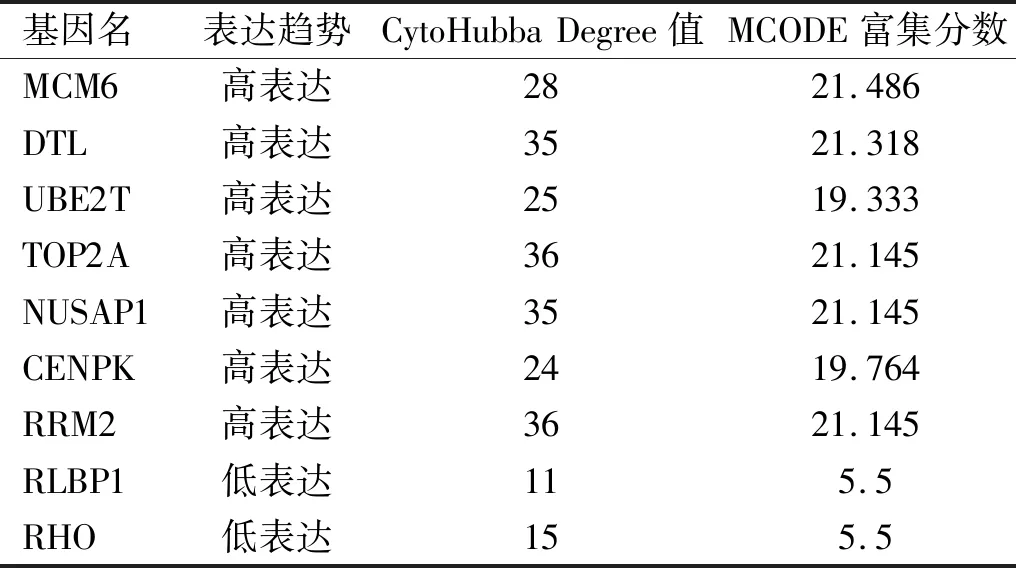
表2 视网膜母细胞瘤枢纽基因
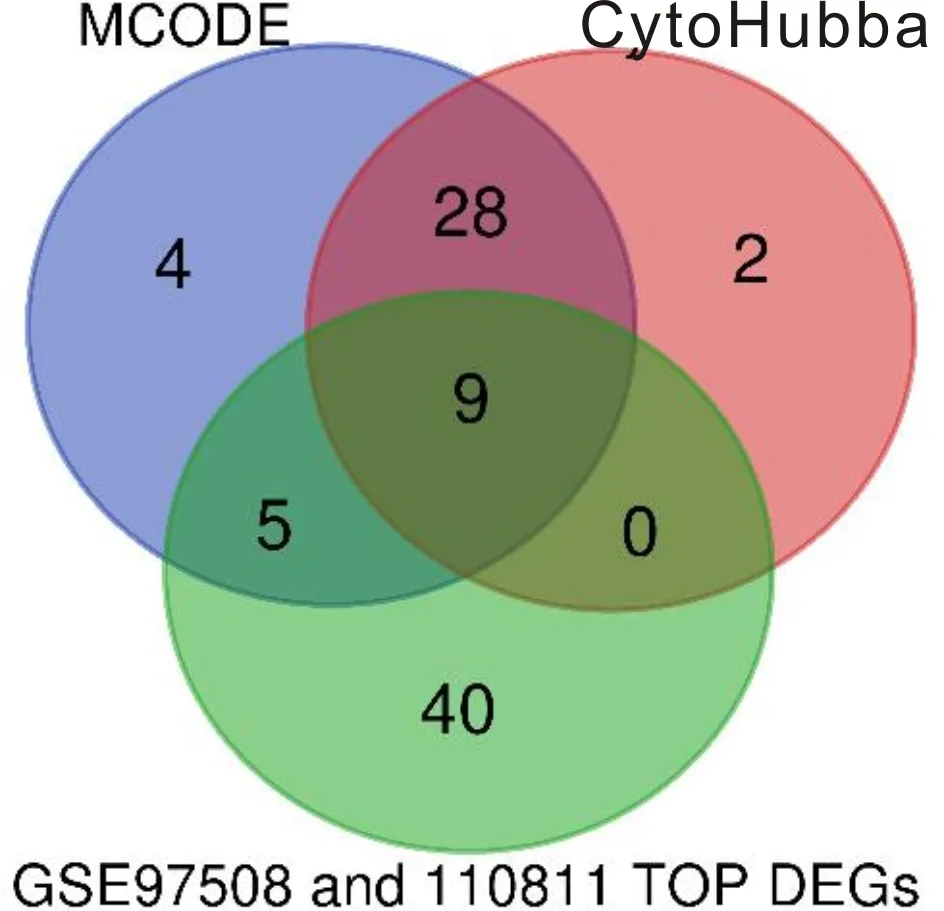
图4 MCODE和CytoHubba及Top DEG韦恩图。
2.3验证数据集与ROC曲线验证视网膜母细胞瘤的枢纽基因为验证上述9个枢纽基因是否在视网膜母细胞瘤发生发展中起到作用,我们纳入一个独立数据集GSE24673验证他们的表达量。结果显示:9个枢纽基因在GSE24673中的表达趋势与上述测试数据集的表达结果一致,差异均有统计学意义(P<0.001,图5)。进一步利用ROC曲线在GSE110811中对上述9个枢纽基因的表达量对视网膜母细胞瘤的诊断价值进行验证。结果显示:上调基因中UBE2T、RRM2与下调基因中的RHO共3个基因有统计学意义且曲线下面积(AUC)≥80%(图6)。
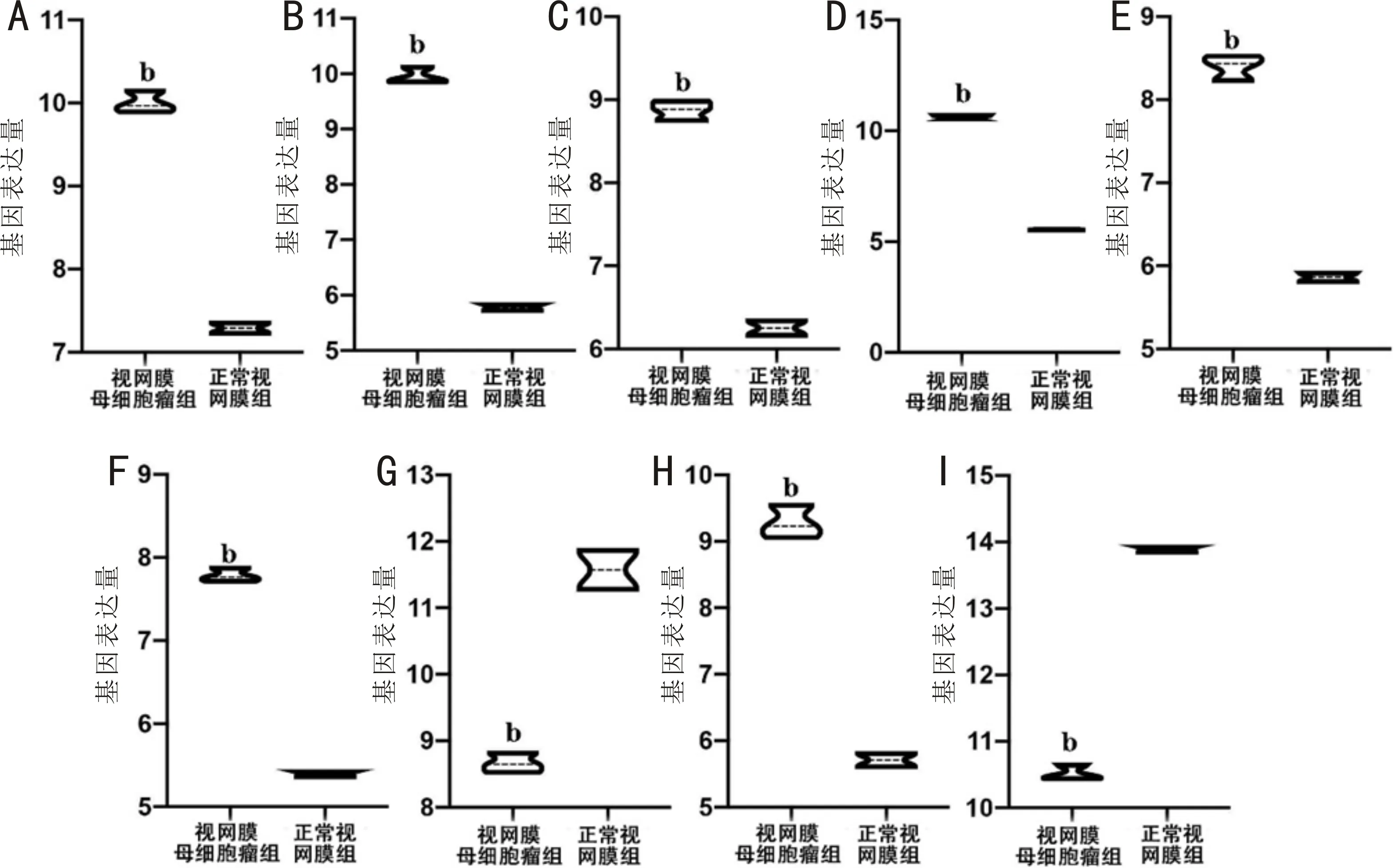
图5 数据集GSE24673中9个枢纽基因表达量 A:MCM6;B:DTL;C:UBE2T;D:TOP2A;E:NUSAP1;F:CENPK;G:RLBP1;H:RRM2;I:RHO;bP<0.001 vs 正常视网膜组。

图6 AUC大于80%的枢纽基因ROC曲线 A:UBE2T;B:RRM2;C:RHO。
2.4qRT-PCR验证视网膜母细胞瘤的枢纽基因利用qRT-PCR验证上述3个枢纽基因在视网膜母细胞瘤细胞系Y79、Weri-Rb1、HXO-Rb44与视网膜色素上皮细胞系ARPE-19中表达情况。结果确认UBE2T与RRM2在3种视网膜母细胞瘤细胞系中mRNA表达量均显著高于细胞系ARPE-19,而RHO的mRNA表达量显著低于细胞系ARPE-19,差异均有统计学意义(P<0.001,表3,图7)。
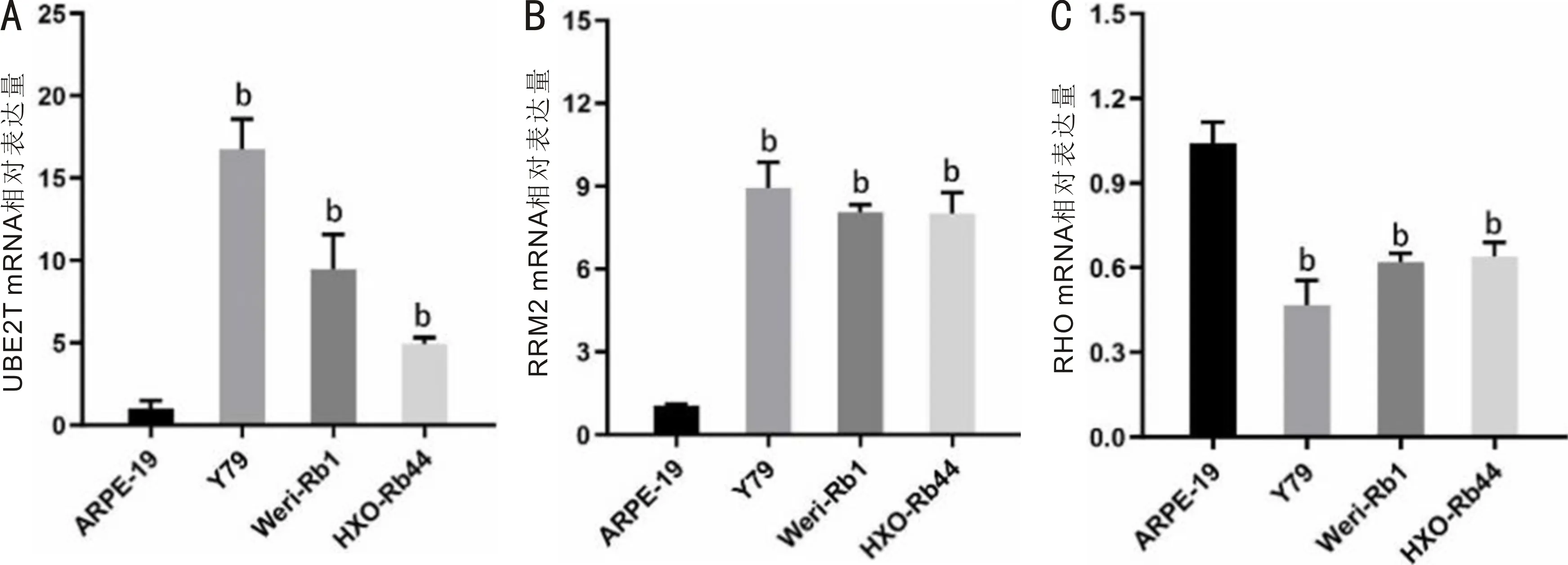
图7 qRT-PCR验证视网膜母细胞瘤枢纽基因表达水平 A:UBE2T;B:RRM2;C:RHO;bP<0.001 vs ARPE-19。

表3 qRT-PCR验证视网膜母细胞瘤枢纽基因表达水平
3 讨论
生物信息学已被广泛运用于各类疾病关键致病基因和信号通路的筛选。在视网膜母细胞瘤发病机制的相关研究中,生物信息学方法的使用也越来越多[10-11]。Zhao等[10]利用GEO数据库对罹患单侧与双侧视网膜母细胞瘤的患者进行差异表达基因与功能富集分析,但该研究缺少肿瘤组织与正常视网膜组织的比较。Huang等[11]也利用公共数据库进行视网膜母细胞瘤关键致病基因的筛选,但未进行细胞实验验证预测结果的可靠性。本研究通过生物信息学方法筛选并在细胞水平验证网膜母细胞瘤与正常视网膜的关键差异基因,为进一步明确视网膜母细胞瘤的发病机制提供重要信息。
本研究发现视网膜母细胞瘤的DEG除了富集于细胞周期以外,光传导与p53通路也参与了视网膜母细胞瘤的发病。光传导通路包括一系列的生化反应,可将光子转化为视锥与视杆细胞中的神经冲动。本研究结果中光传导通路涉及的基因均为下调基因,说明视网膜光感受器去分化是视网膜母细胞瘤进展的重要原因之一。既往对视网膜母细胞瘤光传导通路相关基因的研究提示该肿瘤为视锥细胞来源,且该通路基因与视网膜母细胞瘤的进展相关[12]。p53通路在众多肿瘤的发病中起到关键作用。相关研究已经证实p53基因敲除的小鼠可发展成双侧视网膜母细胞瘤。然而视网膜母细胞瘤基因组中p53基因并未产生突变。文献报道其可能的激活机制为:Rb1基因失活导致Arf、MDM2与MDMX激活,磷酸化的MDM2或MDMX转位到细胞核与p53结合,通过增加p53蛋白的降解而影响细胞存活,促进视网膜母细胞瘤的进展[13]。本研究从生物信息学的角度再次证实了p53通路失活在视网膜母细胞瘤发病机制中的作用。
本研究发现UBE2T、RRM2与RHO为视网膜母细胞瘤的关键基因。其中RRM2是核糖核苷酸还原酶(ribonucleotide reductase,RNR)的一个亚基。它是细胞周期中维持DNA合成与修复的重要蛋白,并且早有研究发现其存在恶性潜能[14]。Nie等[15]应用RNA-seq技术对比视网膜母细胞瘤与正常视网膜转录组差异基因同样发现了RRM2是视网膜母细胞瘤发生发展中的关键基因。既往研究表明RRM2可促进胶质母细胞瘤的增殖、迁移和侵袭,并抑制癌细胞凋亡,靶向抑制RRM2可抑制DNA复制,导致包括胰腺癌、卵巢癌与结肠癌等癌细胞的凋亡[16]。Rahman等[17]也报道利用纳米颗粒靶向抑制RRM2可调节Bcl2抑制头颈部肿瘤与肺癌的生长。RHO编码视紫红质,它属于G蛋白偶联受体,是视杆细胞的特异性标记物。作为成熟视网膜标记物,RHO在既往视网膜母细胞瘤高通量表达谱芯片数据中均证明为低表达状态[18]。对视网膜母细胞瘤的组织病理学研究也确定光感受器的低分化与视网膜母细胞瘤的恶性程度呈正相关[19]。有研究同样利用全基因组表达谱芯片分析发现视网膜母细胞瘤中包括RHO在内的光感受器标志物的丧失可导致视网膜母细胞瘤恶性程度增高[20]。UBE2T编码的功能蛋白属于泛素结合酶E2家族。它的功能最早发现于范可尼贫血综合征中[21]。而近年来UBE2T被认为是促癌基因在不同肿瘤的发生发展中发挥重要作用。已经证明UBE2T在包括乳腺癌、肺癌、胃癌、肝癌、前列腺癌、鼻咽癌与骨肉瘤中表达量均较对照组升高,并且其表达量在其中大多数肿瘤中可作为预测不良预后的独立危险因素[22-24]。本团队成员也进一步对UBE2T在视网膜母细胞瘤发生发展中的功能进行深入研究,确认了在蛋白层面UBE2T在视网膜母细胞瘤中高表达,其表达量与视网膜母细胞瘤的恶性程度相关,并通过激活STAT3通路促进肿瘤的形成[25]。
本文也存在一些局限性,如使用的数据集均来源于视网膜母细胞瘤的大体肿瘤,且更新于2019-05,而近年来有学者采用单细胞测序技术对视网膜母细胞瘤的分子亚型进行分类,为其精准治疗提供方向[26]。另外,本研究纳入的基因均属于功能基因,而目前认为包括miRNA、lncRNA与circRNA在内的众多非编码RNA也参与了视网膜母细胞瘤的发生与发展[27]。因此需要多组学测序技术对其治疗新靶点进行探讨,为视网膜母细胞瘤的生物信息学分析提供新方向[28]。
综上,本研究通过生物信息学综合分析视网膜母细胞瘤数据集筛选出UBE2T、RRM2与RHO这三个关键基因未来可能成为视网膜母细胞瘤的潜在治疗靶点。

