络石藤与地瓜藤抑制NO活性及差异性化学成分研究
黄梓泓, 宋鸿志, Edward J. Kennelly, 谭钦刚,*
( 1. 桂林医学院, 中国 广西 桂林 541199; 2. 纽约城市大学, 美国 纽约 10468 )
络石藤作为常见中药,在我国具有悠久的应用历史,始载于《神农本草经》,被列为上品,2020年版《中华人民共和国药典》中记载其为夹竹桃科植物络石(Trachelospermumjasminoides)的干燥带叶藤茎(国家药典委员会,2020)。络石藤主要含木脂素类、三萜类等化学成分,具有抗炎镇痛、抗肿瘤、抗病毒等作用,民间主要用于治疗风湿热痹、腰膝酸痛等症,现代临床广泛用于与炎症和疼痛相关的疾病,如关节炎、类风湿性关节炎等(李金生等,2016;Zhao et al., 2017)。因民族用药习惯不同,所以桑科榕属植物地果(Ficustikoua)的新鲜或干燥地上部分——地瓜藤在不同地区被用作络石藤(宫璐等,2016)。该植物主要含黄酮类、酚酸类及萜类等化学成分,具有抗菌、抗氧化、抗炎和抗肿瘤等活性,主要用于清热利湿、活血通络、解毒消肿等(周芹茹等,2020;杨烨等,2021;Yao et al., 2022)。上述两种药材在科属来源、化学成分及临床应用方面存在差异,其抗炎活性及相应的化学成分差异尚未明确。
中药材化学成分研究是阐明中药材药效物质、作用机制以及临床疗效的先决条件(郑敏霞等,2011;汪小莉等,2018),传统分离方法费时费力且消耗大量药材,利用现代技术如超高效液相色谱-串联四级杆-飞行时间质谱(UPLC-Q-TOF-MS/MS)技术可以为不同样品间化学成分差异及品质评价提供参考,如da Silva等(2017)通过该法结合多元统计学鉴定了两大产区瓜拉纳因地理条件不同而有差异的成分。络石藤与地瓜藤在性状上难以鉴别,两者皆有治疗炎症相关疾病的记载,为初步探究两种药材抗炎活性及相关化学成分的差异,本研究利用脂多糖(lipopolysaccharide,LPS)诱导的体外细胞模型探究络石藤与地瓜藤对炎症因子一氧化氮(nitric oxide,NO)的抑制活性差异,并采用UPLC-Q-TOF-MS/MS技术结合偏最小二乘法分析法(OPLS-DA),对络石藤和地瓜藤的差异性成分进行分析,进而为络石藤与地瓜藤的药效物质基础研究及质量控制提供理论依据。
1 材料、试剂与仪器
1.1 药材和试剂
所需药材于2019年12月采自广西壮族自治区,络石采自金秀瑶族自治县,地果采自阳朔县。干燥样品经广西壮族自治区中国科学院广西植物所黄俞淞副研究员鉴定为络石(Trachelospermumjasminoides)的带叶藤茎(络石藤)与地果(Ficustikoua)的地上部分(地瓜藤)。
质谱纯乙腈、甲醇、水和甲酸(美国Honeywell公司);DMEM高糖培养基、胎牛血清(美国Gibco公司);脂多糖(美国Sigma-Aldrich公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐MTT、二甲基亚砜DMSO、吲哚美辛Indomethacin(北京索莱宝科技有限公司);一氧化氮测定试剂盒(上海碧云天生物技术有限公司)。
1.2 仪器
UPLC-Q-TOF-MS/MS系统(美国Waters公司),包括ACQUITY UPLC液相色谱仪,Xevo G2-S Q-TOF质谱仪,配有Lockspray接口及电喷雾离子源(ESI)等;数据的采集和处理采用MassLynx 4.1质谱工作站;ACQUITY UPLC BEH C18色谱柱(2.1 mm × 100 mm, 1.7 μm, 美国Waters公司);S30H-D78224型超声清洗器(德国Elma Sonic公司);AL204型分析天平(瑞士Mettler Toledo公司);3111型CO2培养箱(美国Thermo Fisher Scientific公司);AC2-4S1 生物安全柜(新加坡ESCO公司);Infinite M200 PRO 多功能酶标仪(瑞士TECAN公司)。
1.3 细胞
RAW264.7细胞购自中国科学院上海生命科学研究院细胞资源中心。
2 研究方法
2.1 体外NO抑制活性测试
2.1.1 供试品溶液的制备 分别取络石藤及地瓜藤各0.2 g,置于20 mL 80%甲醇-水溶液中室温下超声提取2次,每次20 min,合并提取液静置30 min,过0.45 μm微孔滤膜,即得各样品甲醇提取物。
2.1.2 细胞及培养 将RAW264.7细胞加入DMEM培养基(含10%胎牛血清)中,置于5% CO2、37 ℃细胞培养箱中培养1~2 d。当细胞密度达到80%~90%时,按照1∶2的比例传代。
2.1.3 络石藤和地瓜藤醇提物对RAW264.7细胞的毒性考察 将RAW264.7细胞配置成浓度为6×104个·mL-1的细胞悬液,每孔100 μL接种于96孔板上,放入37 ℃、5% CO2的培养箱中24 h,设置对照组(仅含培养基)和给药组(含不同浓度络石藤醇提物、地瓜藤醇提物),每组3个重复孔。24 h后,除去孔内培养基,每孔添加100 μL含有0.5 mg·mL-1MTT的培养基,于孵箱中培养4 h后弃去培养基,每个孔中添加100 μL二甲基亚砜。在酶标仪490 nm波长下测量吸收波长,并计算细胞存活率。
细胞存活率=(A给药/A对照)×100%
2.1.4 NO释放量的检测 将RAW264.7细胞配置成浓度为1.5×105个·mL-1的细胞悬液,每孔100 μL接种于96孔板上,放入37 ℃、5% CO2的培养箱中12 h,设置空白对照组(仅含培养基)、LPS模型组(含2 μg·mL-1LPS)和给药组(2 μg·mL-1LPS、LPS+吲哚美辛、LPS+不同浓度络石藤醇提物和LPS+不同浓度地瓜藤醇提物),每组设置3个重复孔。24 h后,收集上清液,并采用Griess法测定NO含量,用酶标仪检测540 nm下的吸光度。
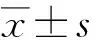
2.2 差异成分分析处理
2.2.1 色谱检测条件 ACQUITY UPLC BEH C18色谱柱(2.1 mm × 100 mm,1.7 μm),采用0.5 mL·min-1的流速进行洗脱,进样体积设定为1 μL,样品浓度为2 mg·mL-1。流动相由含有0.1%甲酸水溶液(A)-乙腈(B)组成,洗脱程序如下:0~1.00 min 5%~18% B;1.00~2.50 min 18%~20% B;2.50~4.50 min 20%~25% B;4.50~5.00 min 25%~70% B;5.00~7.00 min 70%~75% B;7.00~9.50 min 75%~98% B;9.50~11.50 min 98%~5% B;11.50~13.50 min 5% B。
2.2.2 质谱检测条件 质谱仪通过电喷雾电离(ESI)源连接到UPLC系统,雾化气为氮气,质量扫描范围m/z100~1 500,累积时间0.2 s。毛细管电压在负离子模式下为2.42 kV,在正离子模式下为3.00 kV,样品锥电压为25 V,提取锥电压为4 V。对于MS/MS谱图,优化了不同的碰撞能量(20~50 eV),以实现结构解析的最大特征片段数。氮气用于雾化器和去溶剂化,去溶剂化和锥形气体流速分别为800、20 L·h-1,去溶剂化温度为550 ℃,源温度为120 ℃。数据的采集和处理软件为MassLynx 4.1质谱工作站。
2.2.3 OPLS-DA差异性成分分析 以UPLC-Q-TOF-MS/MS采集所得络石藤和地瓜藤色谱图中峰面积量化值为变量,采用SIMCA 14.1软件进行OPLS-DA分析,络石藤和地瓜藤样品呈现一定分类聚集现象。OPLS-DA模型中变量投影重要度(VIP值)越大,表明该指标对区分络石藤和地瓜藤的贡献越大(崔婷等,2022),即可能是区分两种药材的差异性成分,确定络石藤与地瓜藤间的差异性化学成分。利用MassLynx 4.1色谱工作站得到化合物的精确相对分子质量及化合物碎片信息,参照对照品并查阅相关文献(范明松等,2005;袁珊琴等,2010;景玲等,2012;Liu et al., 2015; Zhao et al., 2017; Zhou et al., 2018; Murugesu et al., 2021; Song et al., 2022; Yao et al., 2022)结合Progenesis QI软件,鉴定络石藤与地瓜藤的差异性成分。
3 结果与分析
3.1 络石藤和地瓜藤醇提物对RAW264.7细胞活力的影响
与对照组比较,络石藤醇提物(ethanol extract of the stems with leaves inTrachelospermumjasminoides,TJ)和地瓜藤醇提物(ethanol extract of the aerial parts inFicustikoua,FT)质量浓度在80 mg·L-1时对细胞增殖有明显的抑制作用,质量浓度小于80 mg·L-1的各给药组对细胞增殖无明显抑制作用,结果如图1所示。以无毒质量浓度设计40、20、10 mg·L-1为高、中、低剂量进行下一步实验。

(平均值±标准差, n=3), 与对照组比较, *P<0.05。 n=3), compared with the control group, *P<0.05.图 1 络石藤和地瓜藤醇提物对RAW264.7细胞的毒性影响Fig. 1 Cytotoxicity of ethanol extracts of the medicinal parts in Trachelospermum jasminoides and Ficus tikoua to RAW264.7 cells
3.2 络石藤和地瓜藤醇提物对LPS刺激RAW 264.7细胞释放NO的影响
从表1结果可以看出,络石藤和地瓜藤醇提物均可一定程度抑制LPS刺激RAW264.7细胞释放NO炎症因子,并且各组的药效呈现浓度依赖性。其中,络石藤醇提物的NO释放抑制作用稍强于地瓜藤醇提物。
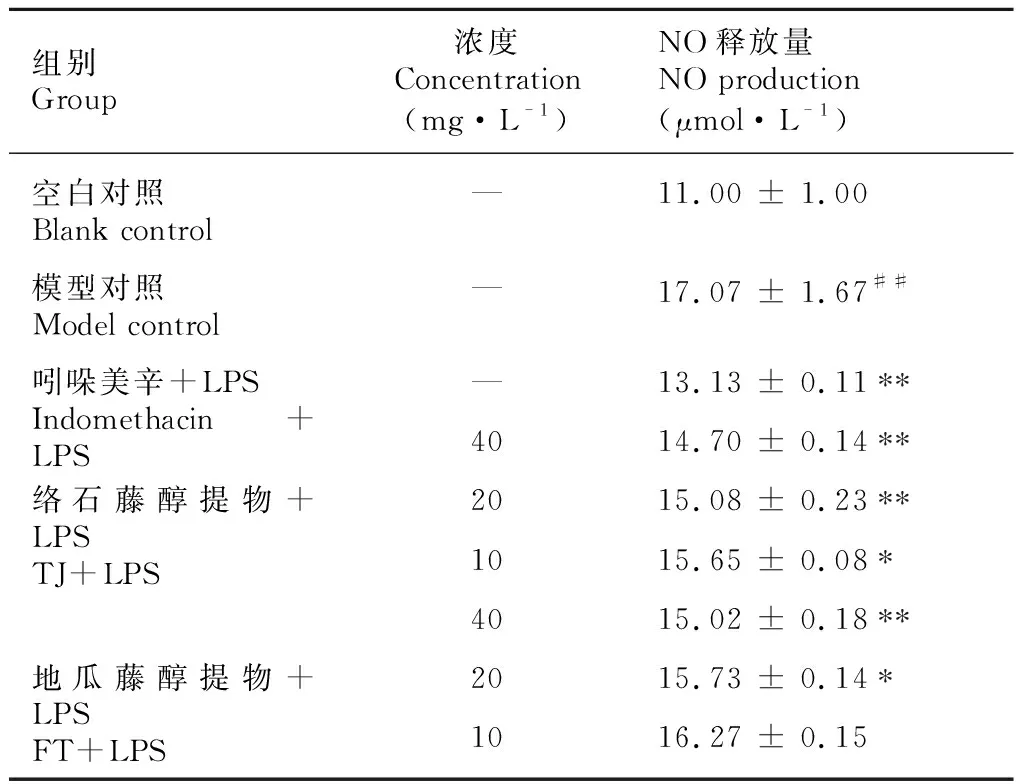
表 1 络石藤和地瓜藤醇提物对RAW264.7细胞分泌NO的影响Table 1 Effects of ethanol extracts of the medicinal parts in Trachelospermum jasminoides and Ficus tikoua on NO secretion by RAW264.7 cells
3.3 络石藤与地瓜藤差异性成分鉴定
OPLS-DA分析结果表明,模型对X变量的可解释性R2X为0.84,模型对Y变量的可解释性R2Y为0.999,模型预测能力Q2为0.993,说明对模型的评估良好。从得分图(图2)可以看出,络石藤和地瓜藤醇提物样品数据点区分明显,表明络石藤在化学成分上与地瓜藤有明显区别。按照该模型X变量对Y变量的解释能力(variable influence on projection,VIP)大小进行排序,从采集所得络石藤和地瓜藤色谱图(图3)中共鉴定出络石藤中21个显著差异性成分(表2),包括木脂素类10个、苯丙酸类4个、黄酮类2个、三萜类2个、其他类3个。地瓜藤中10个显著差异性成分(表3),包括黄酮类7个、木脂素类1个、苯丙酸类1个、三萜类1个。

图 2 经OPLS-DA 分析的得分图Fig. 2 Score chart of OPLS-DA analysis

表 2 络石藤的差异性化学成分鉴定Table 2 Identification of differential chemical constituents from the medicinal parts in Trachelospermum jasminoides

表 3 地瓜藤的差异性化学成分鉴定Table 3 Identification of differential chemical constituents from the aerial parts in Ficus tikoua
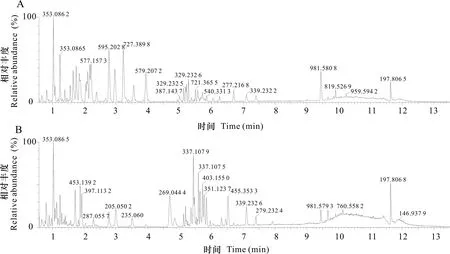
图 3 络石藤(A)和地瓜藤(B)的BPI色谱图Fig. 3 Base peak chromatograms of the medicinal parts in Trachelospermum jasminoides(A) and Ficus tikoua(B)
3.3.1 木脂素类化合物分析 从表2可以看出,在负离子模式下,化合物1-4的准分子离子峰为m/z697.236 1 [M-H]-,去除两分子葡萄糖残基(-162 Da×2)后得到碎片离子m/z373.127 3;接着,从内酯环上连接2个取代基的季碳上断裂取代基(-16-136 Da)(Abe et al.,1986; Liu et al., 2015)后得到碎片离子m/z221.068 2;随后,内酯环上丢失一分子CO(-28 Da)后,环内形成双键(-2 Da),得到碎片离子m/z191.056 0。结合文献(Liu et al., 2015)及质谱断裂方式,推测该化合物为去甲络石苷元4,4′-di-O-β-D-吡喃葡萄糖苷。化合物1-7与化合物1-8以及化合物1-12与化合物1-13为两对同分异构体,而同分异构体其保留时间接近且裂解途径无明显差别。在负离子模式下,化合物1-13的准分子离子峰为m/z595.204 3 [M+HCOO]-,去除一分子葡萄糖残基(-162 Da)后得到碎片离子m/z387.144 1,紧接着丢失一分子-OCH3得到碎片离子m/z357.133 9,可以推测出化合物的结构间母核上的区别。继而可推测,化合物1-4、1-7、1-8的母核皆为去甲络石苷元,化合物1-12与化合物1-13的母核为络石苷元。同时,结合保留时间与文献(Liu et al, 2015)上的报道对应,可以推测出化合物1-7与化合物1-8为去甲络石苷元5′-C-β-葡萄糖苷和去甲络石苷,化合物1-12与化合物1-13分别为5′-甲氧基罗汉松脂苷和络石苷。
3.3.2 苯丙酸类化合物分析 苯丙酸类化合物由于结构中含有羧基和酚羟基,其裂解过程中易丢失水分子和羧酸分子,并且容易在羰基处断裂形成碎片离子。化合物1-1及化合物1-2在负离子模式下,二者的准分子离子峰在m/z353.088 1 [M-H]-左右,可推测二者的分子式为C16H18O9,它们在二级质谱裂解过程中因酯键断裂而形成m/z191.055 4、179.025 3,分别对应于奎宁酸片段、咖啡酸片段(雒晓梅等,2019)。根据文献(Qi et al., 2009)报道的保留时间,可判断他们分别为绿原酸及隐绿原酸。
3.3.3 黄酮类化合物 黄酮苷类化合物的裂解通常为糖链结构的连续丢失,如鼠李糖(146 Da)或葡萄糖(162 Da)残基的丢失,从而可以找到黄酮苷元的碎片离子峰。化合物1-6的准分子离子峰为m/z447.092 1 [M-H]-,去除一分子葡萄糖残基(-162 Da)后得到碎片离子m/z285.039 5,结合文献(徐萌伶等, 2022)报道推测其为木犀草苷。并且,黄酮类化合物裂解过程中易发生脱水、环的逆狄尔斯-阿尔德反应(RDA)裂解,以及失去CO、CHO等一些中性分子。由于二级质谱中存在m/z285.040 0 [M-H-C12H20O9]-等碎片离子,因此根据文献(Qian et al., 2010)报道可推测化合物1-5为忍冬苷。
3.3.4 三萜类化合物 通常三萜类化合物在二级质谱裂解过程中,主要是糖键的连续性断裂以及取代基的丢失。化合物1-14的准分子离子峰为m/z727.394 1 [M+COOH]-,分子去除一个葡萄糖残基(-162 Da)后得到碎片离子m/z519.332 6,结合分子量及文献(谭兴起等,2006)推测其为络石苷B1。化合物1-16的准分子离子峰为m/z695.364 2 [M-H]-,去除一分子葡萄糖残基 (-162 Da) 后得到碎片离子m/z517.317 0,随后因丢失了一分子羧基及羟基(-45-17 Da)而得到碎片离子m/z471.310 5,结合分子量及文献(谭兴起等,2006)报道推测其为络石苷F。
4 讨论与结论
络石藤是药典中记载的我国常用且重要的中药材,由于其产地和用药习惯的不同,因此地瓜藤在民间常被用作络石藤替代品。本研究通过比较络石藤与地瓜藤醇提物对LPS诱导的RAW264.7细胞NO释放量的影响,发现络石藤与地瓜藤皆可抑制该炎症因子释放,这初步解释了地瓜藤可在部分地区长期用作络石藤的合理性。
本研究通过OPLS-DA法证实络石藤与地瓜藤的化学成分存在明显差异,络石藤以二苄基丁内酯类木脂素类成分为主要差异性成分,而地瓜藤则以黄酮类化合物居多,两类物质均具有抗炎活性。二苄基丁内酯类木脂素类成分具有抗炎、抗肿瘤和平喘等多种作用(毛杰等,2014),其代表性成分络石苷为药典中评价络石藤药材质量的主要指标(国家药典委员会,2020);牛蒡子苷元通过抑制转录因子p65的核移位等途径,降低了诱导型一氧化氮合酶(iNOS)的表达,进一步减少了NO的生产,从而起到抗炎作用(Cho et al., 2002);Lee等(2010)研究发现牛蒡子苷和罗汉松脂酚不仅抑制核转录因子NF-κB及其调节蛋白的激活, 而且能够潜在地抑制特异性丝裂原活化蛋白激酶(MAPK)的激活,从而降低炎症因子iNOS与COX-2的表达;Song等(2022)研究发现多个二苄基丁内酯类木脂素成分能抑制LPS诱导的RAW264.7中NO的产生。刘美平等(2010)通过紫外分光光度法,发现络石藤提取物中的总木脂素含量超过80%,证明该类成分为络石藤的主要化学成分。地瓜藤中的差异性黄酮类成分,如染料木素可降低LPS诱导的炎症小鼠的炎症因子表达(Chen et al., 2018);怀特酮具有显著的NO抑制作用(Anh et al., 2016);8-异戊烯基柚皮素可降低体外炎症模型的炎症因子表达(Paoletti et al., 2009)等。此外,Yao等(2021)从地瓜藤的同属植物高山榕果实中分离得到的黄酮类化合物也具有抑制NO的作用。
本研究应用体外细胞实验观察络石藤与地瓜藤的NO抑制活性差异,发现络石藤对NO释放的抑制作用稍优于地瓜藤,利用UPLC-Q-TOF-MS/MS技术并结合OPLS-DA方法,发现络石藤和地瓜藤的主要差异性成分分别是木脂素和黄酮,根据相关文献报道,推测上述两类成分分别为两种药材抗炎活性的主要药效物质基础。本研究结果为络石藤与地瓜藤的质量控制以及进一步合理开发与利用植物资源提供了理论依据。

