岩黄连乙酸乙酯部位化学成分及其抗炎活性研究
欧阳志伟, 李 伶, 覃 锋, 何佶蔓, 唐文迪, 耿丽筱, 覃江克*
( 1. 广西师范大学 化学与药学学院, 省部共建药用资源化学与药物分子工程国家重点实验室, 广西 桂林 541004; 2. 广西-东盟食品检验检测中心, 南宁 530029 )
岩黄连,又名土黄连、岩胡,为罂粟科(Papaveraceae)紫堇属植物石生黄堇(Corydalissaxicola)的全草,多分布于我国广西、贵州、云南等高山石缝、石穴中,是典型的喀斯特地带药用植物之一(唐超玲等,2018)。据《广西植物志》《中药大辞典》《中华本草》等记载,岩黄连味苦、性寒,具有清热、消肿、止血、止痛、利湿、拔毒等作用,在临床上用于治疗乙肝、肝硬化、急性黄疸型肝炎以及肝癌等肝部疾病,具有显著疗效(中国科学院广西植物研究所,1993;江苏新医学院,1996;国家中医药管理局《中华本草》编委会,1999;韦记青等,2006;吴颖瑞等,2012;Zeng et al., 2013; Liang et al., 2016; Zhang et al., 2016; Wu et al., 2017)。
有研究表明,岩黄连中的主要有效成分是生物碱,其基本类型为四氢原小檗碱型、小檗碱型、阿朴菲型、血根碱型、苄基异喹啉型等。其中,脱氢卡维汀、小檗碱和巴马汀为其主要生物碱类活性成分,具有抗肿瘤、保肝、镇痛、抗菌等多种药理活性(余姣娇等,2018;张成等,2020;Kuai et al., 2020)。也有研究表明,炎症与肝癌、肝硬化、黄疸型肝炎等疾病密切相关,在这些疾病的发生和发展过程中扮演着重要角色,有效干预炎症,有益于症状的缓解和相关疾病的治疗(Luigi et al., 2013; Ashwini et al., 2018; Lee et al., 2021)。目前,对岩黄连抗炎活性方面的研究很少,并且主要集中在生物总碱部位等粗提物研究上(唐超玲等,2018;诸葛明丽等,2019;肖萍等,2019;郭雅婷等,2021),而对其中单体化合物抗炎活性的研究尚未见报道,其抗炎物质基础不明确。为了更深入了解岩黄连化学成分,探究其抗炎活性物质,本课题组对岩黄连95%乙醇提取物中的乙酸乙酯部分进行系统的化学成分分离和纯化、结构鉴定及抗炎活性研究,以期从纯单体化合物层面丰富壮药岩黄连的化学成分,阐明其抗炎活性物质基础,为岩黄连的进一步开发与利用提供科学依据。
1 材料与方法
1.1 材料
岩黄连购于广西东兰县, 经广西师范大学生命科学院唐绍清教授鉴定为罂粟科植物石生黄堇(Corydalissaxicola)的全草。
1.2 仪器和试剂
LC3000型制备高效液相色谱仪(北京创新通恒科技有限公司);LC-20A分析型高效液相色谱仪(日本岛津科技公司);Inertil ODS-3(4.6 mm×250 mm)分析柱(日本岛津科技公司);400、600 MHz 超导核磁共振仪(瑞士Bruker公司);ZHJH-C1112B超净工作台(Clean Bench公司);TH4-200倒置显微镜(OLYMPUS公司);Infinite M1000型多功能酶标仪(Tecan公司);YMC-Pack-ODS 色谱柱 (20.0 mm×250 mm)(日本YMC公司);AB-8大孔树脂(郑州和成新材料科技有限公司);100~200目柱色谱硅胶(青岛海洋化工有限公司);Sephadex LH-20凝胶(美国GE公司);MCI柱色谱(日本三菱公司)。甲醇(色谱纯,美国TEDIA公司);乙醇、乙酸乙酯、正丁醇等溶剂(分析纯,西陇化工股份有限公司);甲醇、三氟乙酸(TFA)溶剂(色谱纯,上海泰坦科技股份有限公司);RAW264.7巨噬细胞(中科院上海生命科学研究院);一氧化氮(NO)试剂盒(碧云天公司,批号为022421210608);噻唑蓝(MTT)粉剂(Solarbio公司,批号为1223G0531);脂多糖(Solarbio公司,批号为426Y031);DMEM基础培养基、胎牛血清(Gibco公司,批号为2110875CP);吲哚美辛(西亚公司,批号为Y2462)。
1.3 提取和分离
参考Zhang等(2016)的方法并有所改动。将9 kg岩黄连全草药材粉碎后,加入50 L石油醚回流3 h去除叶绿素,过滤后再加入95%乙醇回流提取3次,每次3 h,将提取液合并浓缩得到浸膏0.7 kg。将浸膏溶于1 L 3%的酒石酸溶液(pH = 2~3),依次用石油醚、乙酸乙酯、正丁醇萃取3次,浓缩得石油醚部位100 g、乙酸乙酯部位60 g、正丁醇部位60 g。
取乙酸乙酯部位(60 g),用AB-8大孔树脂初步分离,乙醇-水(0∶100→100∶0,V/V)梯度洗脱,得到Fr.1~Fr.8共8个组分。Fr.3经Sephadex LH-20凝胶柱(甲醇-水,30∶70→100∶0,V/V)分离,得到Fr.3-1~Fr.3-8共8个组分。其中,Fr.3-2经制备型HPLC(甲醇-0.1% TFA,45∶55,V/V)纯化后得到化合物1(16 mg)、2(15 mg);Fr.3-4经制备型HPLC(甲醇-0.1% TFA,40∶60,V/V)纯化后得到化合物3(83.7 mg);Fr.3-5经制备型HPLC(甲醇-0.1% TFA,40∶60,V/V)纯化后得到化合物4(10 mg)、5(10 mg);Fr.3-6经制备型HPLC(甲醇-0.1% TFA,40∶60,V/V)纯化后得到化合物6(14 mg);Fr.3-8经制备型HPLC(甲醇-0.1% TFA,45∶55,V/V)纯化后得到化合物7(11.7 mg)、8(7 mg)。Fr.5经Sephadex LH-20凝胶柱(甲醇-水, 30∶70→100∶0,V/V)分离,得到Fr.5-1~Fr.5-5共5个组分。其中,Fr.5-5经制备型HPLC(甲醇-水,35∶665,V/V)纯化后得到化合物9(6.1 mg)。Fr.8经硅胶柱色谱(二氯甲烷-甲醇)进行分离,得到Fr.8-1~Fr.8-6共6个组分。其中,Fr.8-1经制备型HPLC(甲醇-0.1% TFA,75∶25,V/V)纯化后得到化合物10(4.6 mg);Fr.8-3经MCI柱色谱处理后经制备型HPLC(甲醇-水,72∶28,V/V)纯化后得到化合物11(3.4 mg)、12(118.6 mg);Fr.8-4和Fr.8-5经制备型HPLC(甲醇-水,78∶22,V/V)纯化后得到化合物13(3.7 mg)。化合物的结构如图1所示。

图 1 化合物1-13 结构式Fig. 1 Chemical structures of compounds 1-13
1.4 细胞的培养及毒性评价
RAW264.7细胞在含有10%胎牛血清的DMEM培养液中于37 ℃、5% CO2条件下培养,生长至70%时进行传代。采用MTT法(Mosmann, 1983)检测化合物对RAW264.7细胞存活率的影响。
将对数生长周期的RAW264.7细胞株,按照180 μL每孔的体积将浓度为1×105个·mL-1的细胞悬浮液接种于96孔板中,同时设置空白组、吲哚美辛组以及给药组(50 μmol·L-1),每组设3个复孔,于5% CO2、37 ℃条件下培养24 h。在避光条件下每孔加入10 μL 5 g·L-1的MTT溶液,继续于5% CO2、37 ℃条件下孵育4 h,弃去培养液,每孔加入100 μL DMSO试剂充分溶解后用酶标仪在570 nm波长处测量吸光度OD值,并根据OD值计算RAW264.7细胞的存活率。计算公式如下:
存活率=(OD给药组)/(OD空白组)×100%
1.5 抗炎活性评价
细胞分为4组,分别为空白组、LPS炎症模型组、不同浓度给药组(测试化合物及阳性药吲哚美辛),每个浓度设置3个复孔,取对数生长周期的RAW264.7细胞株,以1×105个·mL-1的密度接种于96孔板中,培养箱培养24 h后给药。空白组加入完全培养基,给药组加入不同浓度的化合物,继续培养孵育4 h后和LPS炎症模型组一起加入质量浓度为1 mg·L-1的LPS,继续于细胞培养箱中培养24 h。
1.6 NO含量测定
采用Griess法(Green et al., 1982; 焦兵等,2019)测定给药组对LPS诱导的RAW264.7细胞上清液中NO的含量,收集各组细胞上清液,严格按照NO检测试剂盒说明书进行测定。
1.7 统计学分析
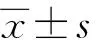
2 结果与分析
2.1 化合物的结构鉴定
化合物1C19H14NO4,黄色晶体,HR-ESI-MSm/z: 321.259 0 [M+H]+。1H-NMR (DMSO-d6,400 MHz)δH: 7.78 (1H, s, H-1), 7.08 (1H, s, H-4), 3.20 (2H, t,J= 6.3 Hz, H-5), 4.89 (2H, t,J= 6.3 Hz, H-6), 9.97 (1H, s, H-8), 8.03 (1H, d,J= 8.6 Hz, H-11), 7.83 (1H, d,J= 8.6 Hz, H-12), 8.98 (1H, s, H-13), 6.17 (2H, s, 2-OCH2O-3), 6.53 (2H, s, 9-OCH2O-10);13C-NMR (DMSO-d6, 100 MHz)δc: 105.3 (C-1), 147.7 (C-2), 149.8 (C-3), 108.4 (C-4), 130.6 (C-4a), 26.3 (C-5), 55.1 (C-6), 143.8 (C-8), 111.6 (C-8a), 144.6 (C-9), 147.7 (C-10), 121.1 (C-11), 121.8 (C-12), 132.3 (C-12a), 121.1 (C-13), 136.8 (C-13a), 120.5 (C-13b), 102.1 (2-OCH2O-3), 104.5 (9-OCH2O-10)。以上数据与文献(毛宇昂,2006)报道基本一致,故鉴定该化合物为黄连碱(coptisine)。
化合物2C20H18ClNO4,浅黄色结晶粉末,HR-ESI-MSm/z: 372.103 3 [M+H]+。1H-NMR (DMSO-d6, 400 MHz)δH: 7.79 (1H, s, H-1), 7.08 (1H, s, H-4), 3.20 (2H, t,J= 6.4 Hz, H-5), 4.94 (2H, t,J= 6.3 Hz, H-6), 9.91 (1H, s, H-8), 8.20 (1H, d,J= 9.2 Hz, H-11), 8.00 (1H, d,J= 9.0 Hz, H-12), 8.97 (1H, s, H-13), 6.17 (2H, s, 2-OCH2O-3), 4.09 (3H, s, 9-OCH3), 4.06 (3H, s, 10-OCH3);13C-NMR (DMSO-d6, 100 MHz)δC: 105.5 (C-1), 147.7 (C-2), 150.4 (C-3), 108.4 (C-4), 130.7 (C-4a), 26.3 (C-5), 55.2 (C-6), 143.7 (C-8), 121.4 (C-8a), 145.5 (C-9), 149.8 (C-10), 126.7 (C-11), 123.6 (C-12), 133.0 (C-12a), 120.5 (C-13), 137.5 (C-13a), 120.2 (C-13b), 102.1 (2-OCH2O-3), 62.0 (9-OCH3), 57.1 (10-OCH3)。以上数据与文献(Janssen et al., 1989)报道基本一致,故鉴定该化合物为盐酸小檗碱(berberine hydrochloride)。
化合物3C20H18NO4+,黄色粉末,HR-ESI-MSm/z: 337.127 6 [M+H]+。1H-NMR (DMSO-d6, 400 MHz)δH: 7.78(1H, s, H-1), 7.09 (1H, s, H-4), 13.20 (2H, t,J= 8.0 Hz, H-5), 4.93 (2H, t,J= 8 Hz, H-6), 9.88 (1H, s, H-8), 7.99 (1H, d,J= 9.1 Hz, H-10), 8.20 (1H, d,J= 9.2 Hz, H-11), 8.92 (1H, s, H-13), 6.17 (2H, s, -OCH2O-), 4.09 (3H, s, -OCH3), 4.07 (3H, s, -OCH3);13C-NMR (DMSO-d6, 100 MHz)δC: 105.4 (C-1), 149.8 (C-2), 147.7 (C-3), 108.5 (C-4), 120.4 (C-4a), 26.3 (C-5), 55.2 (C-6), 145.5 (C-8), 121.4 (C-8a), 150.4 (C-9), 123.5 (C-10), 126.8 (C-11), 143.7 (C-12), 133.0 (C-12a), 120.2 (C-13), 137.5 (C-13a), 130.7 (C-13b), 102.1 (C-OCH2O), 61.9 (9-OCH3), 57.1 (12-OCH3)。以上波谱数据与文献(Sun et al., 2009)报道一致,故鉴定该化合物为文殊兰新碱(crinumaquine)。
化合物4C21H20NO4+,黄色针晶,HR-ESI-MSm/z: 351.143 3 [M+H]+。1H-NMR (DMSO-d6, 400 MHz)δH: 7.15(1H, s, H-1), 7.47 (1H, s, H-4), 3.11 (2H, s, H-5), 4.82 (2H, s, H-6), 9.89 (1H, s, H-8), 8.20 (2H, s, H-9, 12), 4.09(6H, s, -OCH3), 6.18 (2H, s, -OCH2O-), 2.93 (3H, s, CH3);13C-NMR (DMSO-d6, 100 MHz)δC: 110.6 (C-1), 146.4 (C-2), 149.0 (C-3), 108.2 (C-4), 133.8 (C-4a), 27.3 (C-5), 57.0 (C-6), 144.0 (C-8), 121.4 (C-8a), 144.1 (C-9), 150.3 (C-10), 125.9 (C-11), 120.4 (C-12), 133.0 (C-12a), 135.9 (C-13), 120.8 (C-13a), 130.1 (C-13b), 56.7 (O-CH3), 62.1 (O-CH3), 17.7 (C-CH3), 102.0 (-OCH2O-)。以上数据与文献(李志峰等,2012)报道基本一致,故鉴定该化合物为甲基小檗碱(worenine)。
化合物5C21H20NO4+,黄色粉末,HR-ESI-MSm/z: 373.099 7 [M+Na]+。1H-NMR (DMSO-d6, 400 MHz)δH: 7.17 (1H, s, H-1), 7.38 (1H, s, H-4), 3.14 (2H, t,J= 5.9 Hz, H-5), 4.79 (2H, t,J= 5.8 Hz, H-6), 9.95 (1H, s, H-8), 8.00 (1H, d,J= 9.0 Hz, H-11), 8.06 (1H, d,J= 9.0 Hz, H-12), 3.89 (3H, s, 2-OCH3), 3.85 (3H, s, 3-OCH3), 6.56 (2H, s, 9-O-CH2-O-10), 2.97 (3H, s, 13-CH3);13C-NMR (DMSO-d6, 100 MHz)δC: 111.0 (C-1), 150.6 (C-2), 147.2 (C-3), 110.9 (C-4), 135.6 (C-4a), 26.8 (C-5), 56.7 (C-6), 143.1 (C-8), 132.4 (C-8a), 147.0 (C-9), 144.7 (C-10), 114.4 (C-11), 119.2 (C-12), 131.8 (C-12a), 120.2 (C-13), 130.5 (C-13a), 119.4 (C-13b), 56.1 (2-O-CH3), 55.9 (3-O-CH3), 104.7 (-OCH2O-), 18.2 (13-CH3)。以上数据与文献(何志超等,2014)报道基本一致,故鉴定化合物为脱氢卡维丁(dehydrocavidine)。
化合物6C21H25NO4,淡黄色无定形粉末,HR-ESI-MSm/z: 356.186 6 [M+H]+。1H-NMR (DMSO-d6, 400 MHz)δH: 6.87(1H, s, H-1), 6.68 (1H, s, H-4), 2.93 (1H, m, H-5α), 2.44 (1H, m, H-5β), 2.54 (1H, m, H-6α), 3.10 (1H, m, H-6β), 4.06 (1H, d,J= 15.7 Hz, H-8β), 6.88 (2H, s, H-11,12), 2.60 (1H, dd,J= 15.3, 11.2 Hz, H-13α), 3.35 (1H, d,J= 3.7 Hz, H-13β), 3.39 (2H, dd,J= 3.6 Hz, H-8α, 13a), 3.77 (3H, s, 2-OCH3), 3.75 (3H, s, 3-OCH3), 3.73 (3H, s, 9-OCH3), 3.72 (3H, s, 10-OCH3);13C-NMR (DMSO-d6, 100 MHz)δC: 109.4 (C-1), 147.2 (C-2), 147.2 (C-3), 111.7 (C-4), 126.4 (C-4a), 28.6 (C-5), 50.9 (C-6), 53.4 (C-8), 127.7 (C-8a), 144.4 (C-9), 149.8 (C-10), 111.1 (C-11), 123.7 (C-12), 128.3 (C-12a), 35.7 (C-13), 58.8 (C-13a), 129.7 (C-13b), 55.4 (2-OCH3), 55.7 (3-OCH3), 59.6 (9-OCH3), 55.7 (10-OCH3)。以上数据与文献(Blanchfieid et al., 2003)的报道基本一致,故鉴定化合物为左旋四氢巴马汀[(-)-tetrahydropalmatine]。
化合物7C20H20NO4+,黄色无定形粉末,HR-ESI-MSm/z: 339.143 4 [M+H]+。1H-NMR (DMSO-d6, 400 MHz)δH: 7.04(1H, s, H-1), 7.57 (1H, s, H-4), 3.19 (2H, t, H-5), 4.93 (2H, t,J= 6.3 Hz, H-6), 9.85 (1H, s, H-8), 8.03 (1H, d,J= 9.1 Hz, H-11), 8.17 (1H, d,J= 9.1 Hz, H-12), 8.78 (1H, s, H-13), 3.88 (3H, s, C2-OCH3), 4.05 (3H, s, C9-OCH3), 4.08 (3H, s, C10-OCH3);13C-NMR (DMSO-d6, 100 MHz)δC: 111.5 (C-1), 150.7 (C-2), 146.6 (C-3), 112.3 (C-4), 127.1 (C-4a), 26.1 (C-5), 55.6 (C-6), 145.5 (C-8), 119.2 (C-8a), 150.3 (C-9), 143.6 (C-10), 123.7 (C-11), 126.7 (C-12), 133.2 (C-12a), 119.6 (C-13), 137.9 (C-13a), 121.4 (C-13b), 56.0 (C-OCH3), 62.0 (C-OCH3), 57.1 (C-OCH3)。以上数据与文献(Li et al., 2019)报道一致,故鉴定化合物为药根碱(jatrorrhizine)。
化合物8C11H13NO3,无色棱晶,HR-ESI-MSm/z: 208.097 6 [M+H]+。1H-NMR (DMSO-d6, 600 MHz)δH: 3.33 (2H, m, H-3), 2.81 (2H, t,J= 6.6 Hz, H-4), 7.34 (1H, s, H-5), 7.72 (1H, s, H-8), 6.88 (1H, s, N-H), 3.80 (3H, s, 6-OCH3), 3.75 (3H, s, 7-OCH3);13C-NMR (DMSO-d6, 150 MHz)δC: 164.7 (C-1), 40.1 (C-3), 27.4 (C-4), 132.9 (C-4a), 109.7 (C-5), 151.6 (C-6), 147.4 (C-7), 110.4 (C-8), 121.6 (C-8a), 55.7 (6-CH3), 55.5 (7-OCH3)。以上数据与文献(崔泽旭等,2018)报道相符,故鉴定化合物为紫堇定(corydaldine)。
化合物9C19H21NO5,淡粉色粉末,HR-ESI-MSm/z: 344.149 3 [M+H]+。1H-NMR (CDCl3, 600 MHz)δH: 6.96 (1H, s, H-2), 7.03 (1H, d,J= 8.4 Hz, H-5), 6.89 (1H, d,J= 8.4 Hz, H-6), 7.53 (1H, d,J= 15.5 Hz, H-7), 6.17 (1H, d,J= 15.5 Hz, H-8), 6.70 (2H, d,J= 7.8 Hz, H-2′, 6′), 6.86 (2H, d,J= 7.8 Hz, H-3′, 5′), 2.81 (2H, t,J= 6.9 Hz, H-7′), 3.62 (2H, q,J= 6.9 Hz, H-8′), 3.88 (6H, d, -OCH3);13C-NMR (CDCl3, 150 MHz)δC: 127.4 (C-1), 109.7 (C-2), 147.6 (C-3), 146.8 (C-4), 111.4 (C-5), 122.3 (C-6), 141.3 (C-7), 114.6 (C-8), 166.4 (C-9), 130.8 (C-1′), 114.9 (C-2), 146.8 (C-3′), 144.4 (C-4′), 118.2 (C-5′), 121.5 (C-6′), 35.4 (C-7′), 41.0 (C-8′)。以上数据与文献(宋坤等,2014)报道相一致,故鉴定化合物9为反式阿魏酸酰对羟基苯乙胺(N-trans-feruloyl tyramine)。
化合物10C16H22O4,无色油状液体,HR-ESI-MSm/z: 301.142 4 [M+Na]+。1H-NMR (DMSO-d6, 600 MHz)δH: 7.70 (2H, q,J= 4.3 Hz, H-2, 5), 7.65 (2H, q,J= 4.3 Hz, H-3, 6), 4.19 (4H, t, H-9, 9′), 1.58 (4H, m, H-10, 10′), 1.33 (4H, m, H-11, 11′), 0.88 (6H, t, H-2, 12′);13C-NMR (DMSO-d6, 150 MHz)δC: 132.1 (C-1, 4), 129.1 (C-2, 5), 132.0 (C-3, 6), 167.6 (C-7, 7′), 65.6 (C-9, 9′) ,30.4 (C-10, 10′), 19.1 (C-11, 11′), 13.9 (C-12, 12′)。以上数据与文献(陈磊等,2010)报道基本一致,故鉴定该化合物10为对苯二甲酸二丁酯(dibutylterephthalate)。
化合物11C15H10O6,黄色无定形粉末,HR-ESI-MSm/z: 287.054 8 [M+H]+。1H-NMR (MeOH-d4, 600 MHz)δH: 8.04 (2H, d,J= 8.8 Hz, H-2′, H-6′), 6.86 (2H, d,J= 8.8 Hz, H-3′, H-5′), 6.14 (1H, d,J= 1.8 Hz, H-6), 6.35 (1H, d,J= 1.7 Hz, H-8);13C-NMR (MeOH-d4, 150 MHz)δC: 146.6 (C-2), 135.7 (C-3), 175.9 (C-4), 161.1 (C-5), 97.9 (C-6), 164.1 (C-7), 93.1 (C-8), 156.8 (C-9), 103.1 (C-10), 122.3 (C-1′), 129.3 (C-2′, C-6′), 114.9 (C-3′, C-5′), 159.1 (C-4′)。以上数据与文献(斯建勇等,2006)报道相一致,故鉴定化合物为山奈酚(kaempferol)。
化合物12C11H16O3,淡黄色粉末,HR-ESI-MSm/z: 197.117 0 [M+H]+。1H-NMR (DMSO-d6, 600 MHz)δH: 5.79 (1H, s, H-8), 4.90 (1H, s, 3-OH), 3.98 (1H, m, H-3), 2.35 (2H, ddd,J= 11.6, 4.1, 2.1 Hz, H-2α), 1.51 (3H, s, H-1), 1.89 (1H, ddd,J= 12.8, 4.3, 2.2 Hz, H-4α), 1.29 (2H, d,J= 11.6 Hz, H-2β), 1.22 (3H, s, H-12),1.19 (3H, s, H-11),1.15 (1H, d,J= 12.1 Hz, H-4β);13C-NMR (DMSO-d6, 150 MHz)δC: 34.8 (C-1), 47.9 (C-2), 63.1 (C-3), 49.7 (C-4), 86.5 (C-5), 171.0 (C-7), 112.4 (C-8), 181.8 (C-9), 25.3 (C-10), 29.8 (C-11), 24.7 (C-12)。以上数据与文献(付露等,2019)报道相一致,故鉴定化合物为异地芰普内酯(isololiolide)。
化合物13C11H16O3,淡黄色粉末,HR-ESI-MSm/z: 197.117 0 [M+H]+。1H-NMR (Pyr-d5, 600 MHz)δH: 5.86 (1H, s, H-8), 4.38(1H, s, 3-OH), 3.94 (1H, m, H-3), 2.60 (1H, dd,J= 13.4, 2.3 Hz, H-4α), 2.04 (1H, dd,J= 14.2, 2.5 Hz, H-2α), 1.93 (3H, s, H-1), 1.76 (1H, dd,J= 13.4, 3.9 Hz, H-4β), 1.52 (3H, s, H-12), 1.41 (1H, dd,J= 14.2, 3.9 Hz, H-2β), 1.14 (3H, s, H-11);13C-NMR (Pyr-d5, 150 MHz)δC: 37.1 (C-1), 47.3 (C-2), 66.8 (C-3), 48.6 (C-4), 88.0 (C-5), 172.8 (C-7), 114.0 (C-8), 183.9 (C-9), 31.6 (C-10), 28.2 (C-11), 27.5 (C-12)。经比对,与化合物12为同分异构体,并且以上数据与文献(Sun W et al., 2015)报道相一致,故鉴定化合物为地芰普内酯(loliolide)。
2.2 抗炎活性测试
炎症是生物体对抗外来有害物质或损伤的防御性反应,通过释放NO、TNF-α等炎症介质或因子对抗细菌、病毒等入侵物质,以维持机体平衡;适度的炎症反应对生物体有利,但过度和持续的炎症反应会导致细胞肿胀、破裂并释放细胞毒性物质,最终引起组织坏死,引发炎症性疾病(Sun LD et al., 2015)。NO是一种独特的内源性信号分子,参与正常生理活动;然而,炎症反应过度爆发时,NO会异常过量表达,导致炎症加剧,其与多种炎症疾病的发生和发展密切相关,通常被认为是炎症产生的标志并用作体外抗炎药物筛选模型(Guzik et al., 2003)。本研究采用LPS刺激RAW264.7细胞产生炎症介质NO对所分离的化合物进行抗炎活性初筛。首先,采用MTT方法测定化合物对RAW264.7细胞存活率的影响,以确保后续实验NO抑制实验在基本无毒的条件下进行。本研究结果表明,当化合物浓度为50 μmol·L-1时,除化合物1-3外,其余化合物RAW264.7细胞存活率均高于70%。因此,我们用Griess法进一步测试了化合物4-13对LPS诱导RAW264.7细胞产生NO的抑制作用(表1)。从表1可以看出,化合物4、9、11对NO的产生有明显的抑制活性,IC50值分别为(18.8 ± 0.2)、(29.1 ± 0.3)、(18.0 ± 0.1)μmol·L-1,优于对照药吲哚美辛,表现出良好的体外抗炎活性。

表 1 化合物4-13对LPS诱导RAW264.7细胞产生NO抑制的IC50值Table 1 IC50 values of compounds 4-13 on NO production in LPS-induced RAW264.7 macrophage cells
3 讨论与结论
作为我国西南喀斯特地带民间常用的珍贵药材之一,岩黄连在治疗急性黄疸型肝炎、肝硬化、肝癌等疾病方面具有良好的疗效,非常值得深入研究与开发利用。岩黄连相关产品的开发,其化学成分与药理学的系统研究是基础。本研究从岩黄连95%乙醇提取物的乙酸乙酯萃取部位中分离出13个化合物,包括9个生物碱类化合物(1-9)、3个酯类化合物(10、12、13)和1个黄酮(11)。其中,化合物3、4、8-13成分首次从岩黄连植物中分离得到,抗炎活性筛选的研究结果表明化合物4、9和化合物11对LPS诱导的小鼠巨噬细胞RAW264.7产生炎症介质NO具有良好的抑制活性,优于阳性对照吲哚美辛。
有研究表明,急性黄疸型肝炎往往会导致过度炎症反应,并且炎症会与肝硬化、肝癌的发展密切相关,适当干预炎症有助于这些疾病的治疗(Muratori & Longhi, 2013; Karthikeyan et al., 2018; Lee et al., 2021)。岩黄连中的单体化合物除表现出抗病毒、抗肿瘤等活性外,还表现出良好的抗炎活性,其可能亦通过对炎症的干预发挥协同治疗作用,这可能是其表现出良好疗效的因素之一。本研究结果进一步丰富了岩黄连的化学成分,并发现了其中有效的抗炎化合物,为今后阐明岩黄连中的抗炎药效物质基础,以及为其进一步深度研究与开发利用提供了科学理论依据。

