白花银背藤中的生物碱及其细胞毒活性研究
廖广凤, 黎云清, 莫柳艳, 刘彩兰, 卢汝梅
( 广西中医药大学 药学院, 南宁 530200 )
白花银背藤(Argyreiaseguinii)又名东京银背藤、白背藤、白面水鸡和滇一匹绸等,为旋花科(Convolvulaceae)银背藤属(ArgyreiaLour.)植物,主产于广西、云南等地。白花银背藤主要以根、茎入药,味微涩,性温,入心、肺二经,具有驳骨、止血、生肌、收敛、润肺止咳的功效(中药辞海编写组,1993)。白花银背藤是广西民间常用的壮药,收载于《中国壮药资源名录》《广西药用植物名录》和《广西中药材标准》中,具有补血虚、调气道、续筋骨、止血的功效(常小龙等,2006)。白花银背藤单方制剂为白银宫血灵胶囊,具有益气化瘀、收敛止血的功效,主要用于治疗功能性子宫出血(邱宏聪等,2011)。
银背藤属植物全世界约有90种,主要分布在南亚和东南亚地区,我国有21种。现代研究表明,该属植物具有抗炎、抗菌、保肝和抗肿瘤等活性,其化学成分丰富多样,包括香豆素、黄酮、生物碱等(Tofern et al.,1999;Sharma et al.,2015;Lalan et al.,2015)。目前,从白花银背藤中分离得到的化学成分包括香豆素(邱宏聪等,2008;贾薇等,2008)、脂肪酸类(常小龙等,2005)以及生物碱(常小龙等,2006)等,药理活性研究包括抗炎(邱宏聪等,2011)、止血(陈海丰等,2008)等活性。其中香豆素类成分东莨菪内酯的抗炎活性研究受到较多关注。本课题组前期从同属植物白鹤藤(A.acuta)中分离得到一系列结构新颖的香豆素(Li et al.,2021)和生物碱(卢汝梅等,2018)等成分,其中吲哚里西定类新生物碱为白鹤藤碱,初步药理研究表明其具有较好的抗肿瘤活性。长期以来,在广西、云南等地白鹤藤和习用品白花银背藤,俗名均为白面水鸡、一匹绸,都作为壮药“一匹绸”药材使用,属于民族药中常见的“同名异物”“地方习用”现象。那么白花银背藤是否也具有与白鹤藤类似的具有抗肿瘤活性的生物碱,还有待进一步研究。
本文前期研究表明,白花银背藤的氯仿部位提取物对肝癌SMMC-7721细胞株具有较好的细胞毒活性 [IC50=(42.17 ± 1.05)μg·mL-1]。为进一步深入探讨白花银背藤的药效物质基础,本研究对白花银背藤的氯仿部位,特别是生物碱成分及其肿瘤细胞毒活性进行了研究,以期为合理开发利用这一植物资源提供依据。
1 材料与方法
1.1 药材
白花银背藤药材于2019年采自广西河池市大化县,经广西中医药大学韦松基教授鉴定为旋花科银背藤属植物白花银背藤(Argyreiaseguinii)的地上部分。
1.2 仪器和试剂
Bruker AvanceIII 500 MHz核磁共振仪(瑞士Bruker公司);Waters Autospec Premier p776质谱仪(美国Waters公司);Agilent 1100高效液相色谱仪(美国安捷伦公司);LC-20AR制备液相色谱仪(日本岛津公司);中低压ODS制备液相色谱仪(美国格雷斯戴维森公司);爱朗CCA-1112A旋转蒸发仪(东京理化);CPA225D型分析天平(赛多利斯科学仪器有限公司);ODS柱色谱填料(日本YMC公司);Sephadex LH-20柱色谱填料(美国Pharmacia公司);硅胶(100~200目、200~300目)及其余化学试剂(国药集团化学试剂有限公司)。二甲基亚砜(以色列生物公司);阳性对照药物顺铂(DDP)和紫杉醇(taxol)均购自大连美仑生物技术有限公司;MTS试剂盒(普洛麦格公司);白血病HL-60、肺癌A549、肝癌SMMC-7721、乳腺癌MCF-7、结肠癌SW480细胞株(ATCC细胞库)。
1.3 研究方法
1.3.1 提取和分离 取白花银背藤粗粉20 kg,用75%乙醇浸提3次,合并提取液,减压回收溶剂,得到乙醇总提取物约1 590 g。总浸膏用水悬浮,依次使用石油醚(60~90 ℃)、氯仿、乙酸乙酯、正丁醇进行萃取,回收溶剂,得到石油醚部位浸膏130 g、氯仿部位浸膏47 g、乙酸乙酯部位浸膏144 g、正丁醇部位浸膏502 g、水部位浸膏500 g。
取氯仿部位浸膏45 g,经硅胶柱色谱分离, 石油醚-乙酸乙酯(10∶0 ~ 1∶1)梯度洗脱,分离得到9个组分Fr.1~Fr.9。Fr.5经Sephadex LH-20柱色谱分为3个组分(Fr.5-1~Fr.5-3)。其中,Fr.5-1经甲醇重结晶得到化合物6(白色针晶,7.8 mg),Fr.5-2通过半制备HPLC色谱分离得到化合物5(1.5 mg)。Fr.6经中低压ODS制备液相色谱分离,用甲醇-水(10%~100%)梯度洗脱,划分为4个组分(Fr.6-1~Fr.6-4)。其中,Fr.6-1、Fr.6-3、Fr.6-4分别用半制备HPLC色谱分离,得到化合物1(4.0 mg)、2(4.9 mg)、3(5.0 mg)和化合物9(6.0 mg)。Fr.7经中低压ODS制备液相色谱分离,以甲醇-水(10%~100%)梯度洗脱,划分为12个组分(Fr.7-1~Fr.7-12)。其中,Fr.7-3、Fr.7-4分别用半制备HPLC色谱分离,得到化合物7(6.0 mg)、8(10.0 mg)。Fr.8经Sephadex LH-20柱色谱分为3个组分(Fr.8-1~Fr.8-3)。其中,Fr.8-1经半制备HPLC色谱纯化得到化合物4(1.5 mg)。
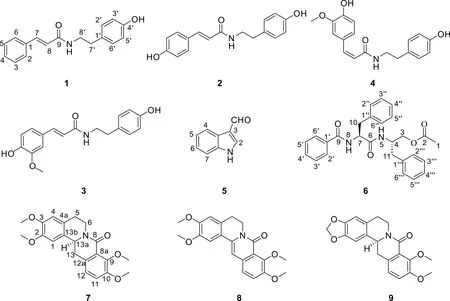
图 1 化合物1-9的结构式Fig. 1 Structures of compounds 1-9
1.3.2 细胞毒活性实验 细胞毒活性测试参考Kaunda等(2020)的方法,分别将对数期生长的白血病HL-60、肺癌A549、肝癌SMMC-7721、乳腺癌MCF-7及结肠癌SW480细胞调整浓度为3×104~1.5×105个·mL-1的细胞悬液,接种到96孔板,每孔体积100 μL,培养24 h后弃去旧培养液,PBS清洗,分组给药,每组3个复孔,空白组加入新的完全培养液,实验组分别加入含待测样品的完全培养液每孔200 μL。化合物1-9分别用DMSO溶解,再用培养液稀释到相应浓度,单体化合物初次筛选终浓度为40 μmol·L-1。根据初筛结果进行复筛,单体化合物终浓度分别为40、8、1.6、0.32、0.064 μmol·L-1,并设顺铂(DDP)和紫杉醇(taxol)2个阳性对照组。给药后放入培养箱中培养48 h后,弃去贴壁细胞孔内的培养液,分别加入20 μL MTS溶液和100 μL培养液;弃去悬浮细胞孔内培养上清液100 μL,再加入MTS溶液20 μL。设置加入MTS溶液和培养液分别为20、100 μL的3个空白复孔,放入培养箱中继续孵育2~4 h后测定光吸收值。使用多功能酶标仪于492 nm波长处,读取并记录各孔光吸收值。初筛数据经处理后以分离得到的化合物编号为横坐标,肿瘤细胞抑制率为纵坐标绘制细胞的抑制率图,复筛结果处理后以分离得到的化合物浓度为横坐标,肿瘤细胞存活率为纵坐标绘制细胞生长曲线,应用Reed和Muench(1938)的方法计算化合物的IC50值。应用GraphPad Prism 7.0统计软件进行统计分析,采用ANOVA检验,以α=0.05作为检验水准,P< 0.05表示差异有显著性。化合物1-9的结构式如图1所示。
2 结果与分析
2.1 化合物的结构鉴定
化合物1白色粉末,溶于甲醇。ESI-MSm/z: 290 [M+Na]+;1H-NMR (500 MHz, CD3OD)δ: 7.54 (2H, m, H-2, 6), 7.37 (3H, m, H-3, 4, 5), 7.52 (1H, d,J= 15.8 Hz, H-7), 6.58 (1H, d,J= 15.8 Hz, H-8), 7.06 (2H, d,J= 8.5, 2.0 Hz, H-2′, 6′), 6.72 (2H, d,J= 8.5, 2.0 Hz, H-3′, 5′), 2.76 (2H, t,J= 7.4 Hz, H-7′), 3.47 (2H, t,J= 7.4 Hz, H-8′);13C-NMR (125 MHz, CD3OD)δ: 136.3 (C-1), 128.8 (2C, C-2, 6), 129.9 (2C, C-3, 5), 130.7 (C-4), 141.6 (C-7), 121.9 (C-8), 168.6 (C-9), 131.2 (C-1′), 130.8 (2C, C-2′, 6′), 116.3 (2C, C-3′, 5′), 156.9 (C-4′), 35.8 (C-7′), 42.6 (C-8′)。以上数据与文献(冯文明等,2018)的报道基本一致,故鉴定为N-反式桂皮酰对羟基苯乙胺(trans-N-cinnamoyltyramine)。
化合物2淡黄色固体,溶于氯仿。ESI-MSm/z: 306 [M+Na]+;1H-NMR (500 MHz, CD3OD)δ: 7.40 (2H, d,J= 8.7 Hz, H-2, 6), 6.79 (2H, d,J= 8.7 Hz, H-3, 5), 7.44 (1H, d,J= 15.8 Hz, H-7), 6.38 (1H, d,J= 15.8 Hz, H-8), 7.05 (2H, d,J= 8.6 Hz, H-2′, 6′), 6.71 (2H, d,J= 8.6 Hz, H-3′, 5′), 2.75 (2H, t,J= 7.4 Hz, H-7′), 3.46 (2H, t,J= 7.4 Hz, H-8′);13C-NMR (125 MHz, CD3OD)δ: 127.7 (C-1), 130.7 (2C, C-2, 6), 116.7 (2C, C-3, 5), 160.5 (C-4), 141.8 (C-7), 118.4 (C-8), 169.2 (C-9), 131.3 (C-1′), 130.5 (2C, C-2′, 6′), 116.2 (2C, C-3′, 5′), 156.9 (C-4′), 35.8 (C-7′), 42.6 (C-8′)。以上数据与文献(杨炳友等,2010)报道基本一致,故鉴定为N-反式香豆酰酪胺(trans-N-p-coumaroyltyramine)。
化合物3黄色粉末,溶于甲醇。ESI-MSm/z: 336 [M+Na]+;1H-NMR (500 MHz, CD3OD)δ: 7.09 (1H, d,J= 1.9 Hz, H-2),6.79 (1H, d,J= 8.2 Hz, H-5), 7.01 (1H, dd,J= 8.2, 1.9 Hz, H-6), 7.43 (1H, d,J= 15.6 Hz, H-7), 6.40 (1H, d,J= 15.6 Hz, H-8), 3.88 (3H, s, 3-OCH3), 7.05 (2H, d,J= 8.6 Hz, H-2′, 6′), 6.72 (2H, d,J= 8.6 Hz, H-3′, 5′), 2.75 (2H, t,J= 7.4 Hz, H-7′), 3.46 (2H, t,J= 7.4 Hz, H-8′);13C-NMR (125 MHz, CD3OD)δ: 128.2 (C-1), 111.5 (C-2), 149.3 (C-3), 150.0 (C-4), 116.5 (C-5), 123.2 (C-6), 142.0 (C-7), 118.6 (C-8), 169.2 (C-9), 56.3 (3-OCH3), 131.3 (C-1′), 130.7 (2C, C-2′, 6′), 116.3 (2C, C-3′, 5′), 156.9 (C-4′), 35.8 (C-7′), 42.5 (C-8′)。以上数据与文献(杨洋等,2016)报道一致,故鉴定该化合物为N-反式阿魏酰酪胺(N-trans-feruloyltyramine)。
化合物4白色无定形粉末,溶于甲醇。ESI-MSm/z: 336 [M+Na]+;1H-NMR (500 MHz, CD3OD)δ: 7.36 (1H, d,J= 2.0 Hz, H-2), 6.74 (1H, d,J= 8.2 Hz, H-5), 6.93 (1H, dd,J= 8.2, 2.0 Hz, H-6), 6.61 (1H, d,J= 12.7 Hz, H-7), 5.81 (1H, d,J= 12.7 Hz, H-8), 3.83 (3H, s, 3-OCH3), 7.00 (2H, d,J= 8.5 Hz, H-2′, 6′), 6.69 (2H, d,J= 8.5 Hz, H-3′, 5′), 2.69 (2H, t,J= 7.5 Hz, H-7′), 3.40 (2H, t,J= 7.5 Hz, H-8′);13C-NMR (125 MHz, CD3OD)δ: 128.5 (C-1), 113.9 (C-2), 148.5 (C-3), 148.6 (C-4), 115.8 (C-5), 124.8 (C-6), 138.4 (C-7), 121.6 (C-8), 170.3 (C-9), 56.4 (3-OCH3), 131.2 (C-1′), 130.7 (2C, C-2′, 6′), 116.2 (2C, C-3′, 5′), 156.9 (C-4′), 35.6 (C-7′), 42.4 (C-8′)。以上数据与文献(杨炳友等,2017)报道基本一致,故鉴定化合物4为N-顺式阿魏酰基酪胺(N-cis-feruloyltyramine)。
化合物5淡黄色针状结晶,可溶于甲醇、氯仿。ESI-MSm/z: 146 [M+H]+;1H-NMR (500 MHz, CD3OD)δ: 9.89 (1H, s, -CHO), 8.10 (1H, s, H-2), 8.16 (1H, d,J= 7.2 Hz, H-4), 7.25 (2H, m, H-5, 6), 7.48 (1H, d,J= 7.8 Hz, H-7);13C-NMR (125 MHz, CD3OD)δ: 139.7 (C-2), 123.6 (C-5), 122.4 (C-6), 113.1 (C-7), 125.0 (C-8), 187.5 (CHO)。以上数据与文献(梁益敏等,2017)报道一致,故鉴定该化合物为1H-吲哚-3-甲醇(1H-indole-3-carbaldehyde)。
化合物6白色针晶,溶于丙酮、甲醇。ESI-MSm/z: 467 [M+Na]+;1H-NMR (500 MHz, CD3OD)δ: 2.01 (3H, s, H-1), 3.98 (1H, dd,J= 11.2, 4.4 Hz, H-3a), 3.91 (1H, dd,J= 11.2, 6.1 Hz, H-3b), 4.31 (1H, m, H-4), 4.79 (1H, m, H-7), 3.13 (1H, dd,J= 13.7, 6.9 Hz, H-10a), 2.99 (1H, dd,J= 13.7, 8.4 Hz, H-10b), 2.82 (2H, m, H-11), 7.72 (2H, m, H-2′, 6′), 7.42 (2H, t, m, H-3′, 5′), 7.53 (1H, m, H-4′), 7.15 (2H, m, H-2″, 6″), 7.22 (3H, m, H-3″, 4″, 5″), 7.26 (2H, m, H-2‴, 6‴), 7.19 (3H, m, H-3‴, 4‴, 5‴);13C-NMR (125 MHz, CD3OD)δ: 20.8 (C-1), 173.2 (C-2), 66.1 (C-3), 51.2 (C-4), 172.5 (C-6), 56.6 (C-7), 169.9 (C-9), 39.0 (C-10), 38.1 (C-11), 135.3 (C-1′), 129.5 (2C, C-2′, 6′), 128.4 (2C, C-3′, 5′), 132.8 (C-4′), 138.9 (C-1″), 129.5 (2C, C-2″, 6″), 130.3 (2C, C-3″, 5″), 129.5 (C-4″), 138.5 (C-1‴), 129.5 (2C, C-2‴, 6‴), 130.3 (2C, C-3‴, 5‴), 127.5 (C-4‴)。以上数据与文献(Mei et al.,2016)报道一致,故鉴定该化合物为金色酰胺醇酯(aurantiamide acetate)。
化合物7白色针状结晶,溶于氯仿、甲醇。ESI-MSm/z: 392 [M+Na]+;1H-NMR (500 MHz, CD3OD )δ: 6.89 (1H, s, H-1), 6.81 (1H, s, H-4), 2.83 (1H, m, H-5α), 1.31 (1H, m, H-5β), 4.90 (1H, dd,J= 11.3, 3.1 Hz , H-6α), 2.90 (1H, m , H-6β), 7.16 (1H, d,J= 8.2 Hz, H-11), 7.07 (1H, d,J= 8.2, 1.1 Hz , H-12), 3.20 (1H, dd,J= 15.4 , 3.2 Hz, H-13α), 2.73 (1H, ddd,J= 15.0 , 13.3,1.2 Hz, H-13β), 4.75 (1H, dd,J= 13.3, 3.2 Hz, H-13a), 3.84 (3H , s, 2-OCH3), 3.83 (3H, s, 3-OCH3), 3.87 (3H, s, 9-OCH3), 3.97 (3H, s, 10-OCH3);13C-NMR (125 MHz, CD3OD)δ: 111.1 (C-1), 149.5 (C-2), 149.6 (C-3), 112.9 (C-4), 129.2 (C-4a), 30.2 (C-5), 39.7 (C-6), 164.7 (C-8), 123.7 (C-8a), 151.1 (C-9), 154.2 (C-10), 117.1(C-11), 123.8 (C-12), 132.8 (C-12a), 39.6(C-13), 56.5 (C-13a), 128.7(C-13b), 56.7 (2-OCH3), 56.7 (3-OCH3), 61.9 (9-OCH3), 56.5 (10-OCH3)。以上数据与文献(喻蓉等,2003)的报道一致,故鉴定该化合物为8-氧-四氢巴马亭(8-oxotetrahydropalmatine)。
化合物8黄色针状结晶,溶于氯仿、甲醇。ESI-MSm/z: 390 [M+Na]+;1H-NMR (500 MHz, CD3OD)δ: 7.36 (1H, s, H-1), 7.03 (1H, s, H-4), 2.91 (2H, t,J= 6.2 Hz, H-5), 4.90 (1H, dd,J= 6.9, 5.6 Hz, H-6), 7.46 (1H, d,J= 8.7 Hz, H-11), 7.41 (1H, d,J= 8.7 Hz, H-12), 7.02 (1H, s, H-13), 3.91 (3H, s, 2-OCH3), 3.87 (3H, s, 3-OCH3), 3.88 (3H, s, 9-OCH3), 3.91 (3H, s, 10-OCH3);13C-NMR (125 MHz, CD3OD)δ: 109.4 (C-1), 150.0 (C-2), 151.9 (C-3), 111.9 (C-4), 130.0 (C-4a), 28.9 (C-5), 40.9 (C-6), 162.0 (C-8), 123.4 (C-8a), 150.1 (C-9), 152.7 (C-10), 120.6 (C-11), 124.1 (C-12), 134.0 (C-12a), 103.1 (C-13), 136.8 (C-13a), 119.6 (C-13b), 56.8 (2-OCH3), 56.5 (3-OCH3), 61.9 (9-OCH3), 57.2 (10-OCH3)。以上数据与文献(许颖,2012)报道一致,故鉴定该化合物为8-oxypalmatine。
化合物9黄色针状结晶,溶于甲醇。ESI-MSm/z: 376 [M+Na]+;1H-NMR (500 MHz, CD3OD)δ: 6.83 (1H, s, H-1), 6.71 (1H, s, H-4), 2.83 (1H, m, H-5α), 1.32 (1H, m, H-5β), 4.84 (1H, m, H-6α), 2.95 (1H, m , H-6β),7.17 (1H, d,J=8.3 Hz, H-11), 7.07 (1H, dd,J=8.3, 1.1 Hz, H-12), 3.16 (1H, m, H-13α), 2.75 (1H, m, H-13β), 4.75 (1H, dd,J=13.3, 3.2 Hz, H-13a), 3.86 (3H, s, 9-OCH3), 3.87 (3H, s, 10-OCH3);13C-NMR (125 MHz, CD3OD)δ: 107.3 (C-1), 148.3 (C-2), 148.1 (C-3), 109.3 (C-4), 129.8 (C-4a), 30.3 (C-5), 39.7 (C-6), 164.7 (C-8), 123.6 (C-8a), 151.1 (C-9), 154.2 (C-10), 117.2 (C-11), 123.8 (C-12), 132.7 (C-12a), 39.7 (C-13), 56.7 (C-13a), 130.1 (C-13b), 56.8 (9-OCH3), 61.9 (10-OCH3)。以上数据与文献(Pinho et al.,1992;刘丙蕊,2011)的报道一致,故鉴定该化合物为12,13-dihydro-8-oxoberberine。
2.2 细胞毒活性结果
化合物7和化合物8对肝癌细胞SMMC-7721具有一定的抑制率,其半抑制浓度(IC50)值分别为(15.50 ± 0.76)、(14.24 ± 0.72)μmol·L-1,阳性对照药物顺铂和紫杉醇分别为(10.28 ± 0.49)、(0.16 ± 0.01)μmol·L-1,其余化合物在40 μmol·L-1浓度下对5种肿瘤细胞(白血病HL-60、肺癌A549、肝癌SMMC-7721、乳腺癌MCF-7及结肠癌SW480细胞)均未显示出细胞毒活性。与对照组相比,化合物7和化合物8能够显著抑制肝癌SMMC-7721细胞的增殖,差异具有统计学意义(P<0.05)。
3 讨论与结论
本研究对白花银背藤氯仿部位的化学成分进行研究,共获得9个生物碱成分,除化合物2和化合物3外,其余均为首次从该植物中分离得到。其中化合物7-9为异喹啉类生物碱,此类生物碱在小檗科黄连(Tang et al.,2009)、防己科细圆藤(Yan et al.,2008)以及旋花科青风藤(Kou & Wang,2008)等植物中均有分布,具有抗肿瘤活性且作用机制复杂。例如,小檗碱可以通过阻滞细胞分裂周期、刺激Fas/FasL信号通路及线粒体/半胱天冬酶通路、抑制拓扑异构酶和NF-κB及其他核转录因子等多种途径,从而引起肿瘤细胞DNA损伤、诱导细胞凋亡(Tang et al.,2009; 钱平和杨秀伟,2014)。
本研究细胞毒活性结果表明,化合物7和化合物8显示出较好的肿瘤细胞增殖抑制活性,而化合物9在40 μmol·L-1浓度下未显示细胞毒活性,其主要结构区别在于化合物9的C-2、C-3位为亚甲二氧基,推测可能与亚甲二氧基的取代影响拓扑异构酶I和II的选择性有关(Kobayashi et al.,1995)。此外,通过对比发现白花银背藤与白鹤藤的生物碱类成分有一定相似性,如均具有N-反式对香豆酰基酪胺等生物碱,但生物碱的类型存在一定差异,白鹤藤中抗肿瘤活性成分为吲哚里西啶类生物碱,而白花银背藤中主要为异喹啉类生物碱。本研究结果为进一步探讨白花银背藤的化学成分和药理活性奠定了基础,为厘清壮药“一匹绸”的药材基原提供了一定依据。

