发酵米荞对高脂肪秀丽隐杆线虫的降脂及抗氧化作用
严 静,薛秋艳,王 旸,陈汶意,谢诗晴,江津津,黎 攀,杜 冰,
(1.华南农业大学食品学院,广东广州 510642;2.黄埔海关后勤管理中心,广东广州 510730;3.广州城市职业学院,广东广州 510405)
随着经济的高速发展,人们的生活品质不断提高。然而,肥胖和高血脂症的患病率正在以惊人的速度增长[1]。肥胖症是体内脂肪、甘油三酯等过量聚集而导致超重和肥胖的一种代谢性疾病,而脂质的过度积累会诱导许多疾病的发生发展,如高脂血症、2型糖尿病和心血管疾病[2]。现今,如何有效地预防及改善肥胖和高血脂症是科学研究的重大难题。以运动与健康饮食为先导,再结合药物干预,是目前最有效的治疗方式。虽然临床上用于降脂的药物种类很多,但长期使用合成类药物具有潜在的副作用及不良反应[3]。因此,开发副作用小、功效显著的功能性食品具有一定的应用价值。近年来,谷物一直被认为是开发功能性食品的潜在理想候选,故寻找具有调节脂质代谢功能的天然、无毒的谷物类产品是目前的研究热点。
米荞是荞麦中的优质品种之一,属于苦荞类中一年生草本植物,全国范围内仅在云南省西盟县有种植,故又称为“西盟米荞”。西盟米荞营养丰富,有“杂粮之王”的美誉。西盟米荞富含丰富的蛋白质、矿物质、微量元素、黄酮及酚类化合物等,具有抗氧化、减肥降脂和缓解心血管疾病等功效[4]。目前,虽然以西盟米荞为原料已开发了米荞茶、米荞面条、米荞粉等产品[5],但在精深加工方面仍需加强。近年来,相关研究表明经发酵处理的粮食作物的功能活性得到提高[6]。程珂[7]利用植物乳杆菌发酵大麦提取物研究其对秀丽隐杆线虫的降脂作用,结果表明经发酵处理的大麦提取物中的总酚及有机酸含量显著增加,并且能显著抑制秀丽隐杆线虫体内的脂质积累。课题组前期研究表明[8],经复合益生菌发酵处理的米荞的总酚、黄酮、γ-氨基丁酸等活性成分显著增加,且体外抗氧化能力提升,但暂未见采用秀丽隐杆线虫模型来研究发酵米荞降脂及抗氧化作用的相关报道。
野生型N2秀丽隐杆线虫(Caenorhabditis elegans,C. elegans)是一种多细胞模式生物,具有体积小、成本低、易于培养、世代周期短和基因操作容易等优点[9]。秀丽隐杆线虫是抗衰老、抗氧化等功能评价最常用的模型之一。近年来,研究表明秀丽隐杆线虫的脂肪代谢通路明确,且与人类的脂肪代谢通路相似,可作为研究脂质代谢的重要模式生物[10]。目前,秀丽隐杆线虫高脂肪模型的建立主要通过向线虫培养基中添加高浓度的胆固醇或糖类,但添加高浓度的胆固醇会对线虫的产卵量产生显著的影响[7]。因此,本文利用复合益生菌发酵米荞,以10 mmol/L葡萄糖诱导秀丽隐杆线虫建立高脂肪模型,初步探讨发酵米荞对高脂肪线虫生理生化、降脂和抗氧化作用的影响,以期为开发以发酵米荞为原料的功能产品提供理论依据,也为秀丽隐杆线虫这一模式生物在脂质代谢和抗氧化等方面研究提供更多科学依据。
1 材料与方法
1.1 材料与仪器
米荞 云南省普洱市西盟县;产乳酸芽孢杆菌(Bacillussp.)DU-106、植物乳杆菌(Lactobacillus plantarum) 存放于华南农业大学新资源食品及功能性原料评价中心,二者菌粉按12:1进行复配[11]为本实验所用的菌粉;野生型N2秀丽隐杆线虫(C.elegans)、缺陷型大肠杆菌(E. coliOP50) 上海南方模式生物科技股份有限公司;奥利司他胶囊 重庆植恩药业有限公司;胡桃醌 上海源叶生物有限公司;甘油三酯(TG)、游离脂肪酸(FFA)、总超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等生化分析试剂盒 南京建成生物工程研究所。
体式显微镜 上海精密科学仪器有限公司;SPX-150B-Z型生化培养箱 上海博迅实业有限公司;Labserv K3型酶标仪 赛默飞世尔科技(中国)有限公司;HH-4数显恒温水浴锅 常州亿通分析仪器制造有限公司;DHP-600型恒温培养箱 北京市永光明医疗仪器厂;JIDI-17R微量高速冷冻离心机广州吉迪仪器有限公司。
1.2 实验方法
1.2.1 样品制备 生米荞粉[12]:挑选颗粒大小一致、成熟饱满的米荞,用清水洗净后,低温冷冻真空干燥,研磨,过80目筛。
生米荞发酵粉[12]:称取0.5 g复配菌粉,于50 mL 0.9%生理盐水中活化。取60 g米荞于锥形瓶中,料水比1:3(g/mL),糖添加量为2%。复合菌粉按2%接种,置于28℃恒温培养箱中发酵3 d,发酵结束后低温冷冻真空干燥、研磨,过80目筛。
分别称量0.5 g生米荞粉和发酵米荞粉,溶于10 mL 2%二甲基亚砜(DMSO)溶液中,并与活化后的大肠杆菌OP50菌液1:9混合,使DMSO的终浓度为0.2%,且生米荞和发酵米荞的样品浓度均为0.5 mg/mL。取1粒奥利司他胶囊(0.12 g),溶解于100 mL 2% DMSO溶液中,得1.2 mg/mL奥利司他溶液,并与活化后的OP50菌液1:9混合,使DMSO的终浓度为0.2%,奥利司他浓度为120 μg/mL。
1.2.2 含糖培养基的配制
1.2.2.1 线虫生长培养基(Nematode Growth Medium,NGM)的配制 称取1.2 g氯化钠、8 g琼脂粉、1 g胰蛋白胨、0.08 g链霉素硫酸盐于锥形瓶中,加入390 mL蒸馏水混匀密封后于灭菌锅内121 ℃灭菌30 min,待培养液温度降至65℃时,依次加入400 μL 1 mol/L CaCl2溶液、400 μL 1 mol/L MgSO4溶液、400 μL 5 mg/mL的胆固醇以及10 mL 1 mol/L K3PO4缓冲液。混匀后,在无菌条件下,趁热分装至培养皿中。
1.2.2.2 含10 mmol/L葡萄糖的NGM培养基制备参考吉鑫[13]的研究方法,略作修改。称量0.72 g葡萄糖溶于10 mL的无菌水中,0.22 μm微孔滤膜过滤,过滤后加入NGM正常培养基内。
1.2.3 线虫同步化 参考Lin等[14]的研究方法,略作修改。用M9缓冲液将产卵期线虫从NGM培养基洗进无菌EP管中,待自然沉降后,弃部分上清,留500 μL,按体积比1:1加入裂解液,涡旋震动3~4 min,4000 r/min离心1 min,弃上清,用M9清洗沉淀2~3遍。用移液枪吸取EP管底部虫卵滴于含有OP50的NGM培养基中,于20 ℃恒温培养箱中孵育48~72 h即可得到实验所需的L4期线虫。
1.2.4 寿命和移动力试验 线虫分为阴性对照组(含0.2% DMSO,正常培养基)、高脂肪模型组(含0.2%DMSO,高糖培养基)、奥利司他药物组(120 μg/mL,高糖培养基)、生米荞组(0.5 mg/mL,高糖培养基)、发酵米荞组(0.5 mg/mL,高糖培养基)。随机挑取同期化至L4期的线虫到各组平板上(每组3个平板,每个平板30条线虫)。从转移时刻起记录各组线虫的存活天数,每24 h转移线虫至对应的实验组新板中,产卵期结束后可每2 d转一次。每天记录线虫存活和死亡数,当所有组别中的线虫均死亡时,则实验结束。
做寿命试验的同时进行线虫的移动力试验。在第0、5、10、15、20 d时观察线虫的移动能力。移动力可分为三个等级为A、B、C[15]。线虫可自主运动,不需触碰刺激,记为A;线虫必须受到触碰刺激才会运动,记为B;线虫受到触碰刺激后只摆动头或尾,记为C。
1.2.5 产卵量试验 参考王凤等[16]的研究方法,略作修改。挑取L4期线虫至各组平板上,每板2条,每组5个板。每24 h将线虫转移至对应的新板中,直至产卵期结束。所有含虫卵的板置于20 ℃培养48 h后再计数,各板孵出的子代数目之和即为该线虫总子代数。
1.2.6 活性氧(ROS)含量测定 参照Zhang等[17]的研究方法,略作修改。挑取L4期线虫至各组平板上,干预3 d后,再用M9缓冲液将虫体冲洗至无菌EP管中,加入研磨珠后冷冻研磨,4000 r/min离心1 min,取上清液。同时,吸取50 μL上清液和50 μL 100 μmol/L H2DCF-DA溶液于96孔板中混匀,以H2DCF-DA溶液为对照。将96孔板放置于酶标仪中测定荧光强度,发射波长为528 nm,激发波长为485 nm,反应温度为25 ℃,每隔10 min测定一次,总反应时间为2 h。
1.2.7 胡桃醌氧化应激试验 参考李玉英等[18]的实验方法,略作修改。挑取L4期线虫至各组平板上,经样品干预3 d后,转移至含有500 μmol/L胡桃醌的培养基中,每组30条,每1 h统计一次线虫存活情况,直到线虫全部死亡为止。
1.2.8 甘油三酯和游离脂肪酸含量的测定 挑选L4期的线虫至各组平板上,干预3 d后,用M9冲洗虫体至无菌EP管中,采用珠磨仪破碎虫体,4 ℃、4000 r/min离心1 min,收集上清液。根据甘油三脂和游离脂肪酸试剂盒说明书测定线虫体内甘油三酯和游离脂肪酸含量。
1.2.9 抗氧化酶的测定 挑选L4期的线虫至各组平板上,干预3 d后,转移至EP管中,将线虫用M9冰浴匀浆后,4 ℃、4000 r/min离心1 min,收集上清液。按试剂盒说明书测定线虫体内SOD、CAT、GSH-Px酶活力和MDA含量。
1.3 数据处理
每个实验均进行三次重复实验,结果以平均数±标准差(mean±SD)表示,并通过GraphPad Prism 8.0软件采用one-way ANOVA分析法进行多组间显著性分析,采用log-rank检验对生存曲线进行显著性分析。P<0.05为有显著性差异,P<0.01为有极显著差异。
2 结果与分析
2.1 发酵米荞对高脂肪线虫寿命的影响
相关研究表明,高糖饮食与线虫寿命的缩短具有一定的相关性[19]。由图1和表1可知,与对照组相比,10 mmol/L高糖诱导的高脂肪线虫的生存曲线向左移,其中平均寿命13.69 d,缩短了19.14%(P<0.01);最大寿命23.33 d,缩短了8.57%(P<0.01),与Lee等[20]和Elena等[21]的研究结果相一致。研究表明,高脂肪线虫的寿命降低,可能是由于机体代谢过程中产生过量的活性氧自由基,引起氧化损伤加剧[22]。而与高脂肪模型组相比,药物组、生米荞组、发酵米荞组线虫的生存曲线右移,最大寿命分别为25.80、29.02、30.54 d,相对寿命延长率分别达10.59%、24.39%和30.90%(P<0.01),说明在高糖诱导脂肪积累的情况下,摄入奥利司他、生米荞和发酵米荞均能延长线虫的寿命。其中,发酵米荞组线虫的平均寿命和最长寿命均最大,与高脂肪模型组相比分别增加6.84和7.21 d(P<0.01)。研究表明,天然活性成分在一定程度上可以延长线虫寿命[23],发酵米荞组线虫的寿命增加最显著,这可能与发酵米荞中含有丰富的活性成分如芦丁、多酚有关。除此之外,发酵米荞能延长线虫寿命还可能与Insulin/IGF-1信号通路有关[24],该通路是调节线虫寿命最重要的信号通路之一,但具体的调节机制还需进一步研究。
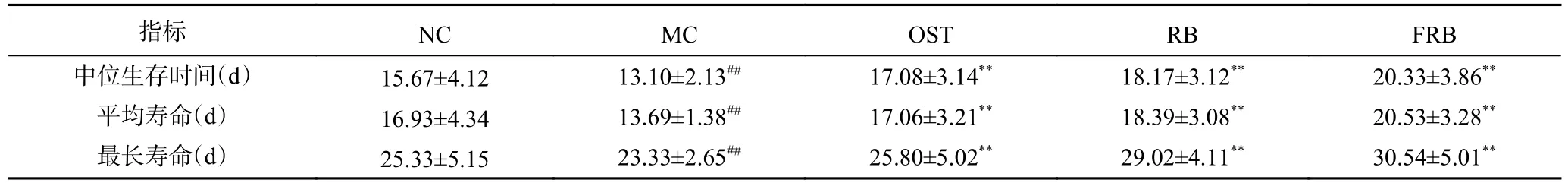
表1 发酵米荞对秀丽隐杆线虫平均寿命和最长寿命的影响Table 1 Effects of fermented rice buckwheat on the average and maximum life of C. elegans
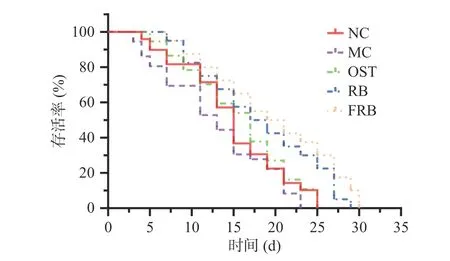
图1 发酵米荞对秀丽隐杆线虫寿命的影响Fig.1 Effects of fermented rice buckwheat on the longevity of C. elegans
2.2 发酵米荞对高脂肪线虫移动力的影响
有研究表明,线虫衰老过程中往往伴随着相关生理功能的衰退,所以线虫的移动能力与寿命有直接相关性[18]。由图2所示,在做寿命试验的同时,记录了线虫第5、10、15和20 d的移动能力。当线虫处于生命早期阶段时(第5 d),对照组、高脂肪模型组、药物组和各样品组均有大于80%的线虫处于在A状态;第10 d,相比于其他组,高脂肪模型组处于A状态线虫的比例最低,仅为70%;在线虫寿命晚期阶段(第20 d),高脂肪模型组线虫可自发平稳运动的比例为0。在线虫寿命晚期阶段,与模型组相比,药物组、米荞和发酵米荞组可自主游动的线虫比例分别增加了20%、22.22%和28.57%(P<0.01),且发酵米荞组可自主游动的线虫比例最高。相关研究表明,移动力代表能量消耗情况,运动频率越高,能量消耗越多,脂肪的积累程度越低[25]。因此,发酵米荞不仅可以增加高脂肪线虫的能力消耗,减少脂质的积累,还可以缓解高脂肪线虫的运动能力因年龄的增加而下降的情况。
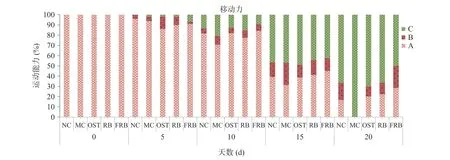
图2 发酵米荞对秀丽隐杆线虫运动能力的影响Fig.2 Effects of fermented rice buckwheat on the locomotion ability of C. elegans
2.3 发酵米荞对高脂肪线虫产卵量的影响
线虫的产卵量受环境、传代数等多种因素的影响,线虫通常在产卵期的前4 d具有很强的繁殖能力。由图3A可知,线虫的生育高峰期处在第2 d和第3 d,并且第2 d的产卵量最多。随着线虫的衰老,第5 d时基本不产卵。由图3B可得,与对照组相比,高脂肪模型组线虫的总产卵量下降,由341个下降至288个,下降了15.54%(P>0.05),说明高糖应激会对线虫的产卵量产生一定的影响。宗华[26]研究表明10~500 mmol/L的葡萄糖诱导均会导致线虫的生殖能力下降,可能是通过调控蛋白质糖基化和胰岛素相关通路。而与高脂肪模型组相比,药物组、米荞组和发酵米荞组的线虫产卵量均有所增加(P>0.05),且与对照组相接近,说明样品对高脂肪线虫的繁殖能力均无抑制作用。
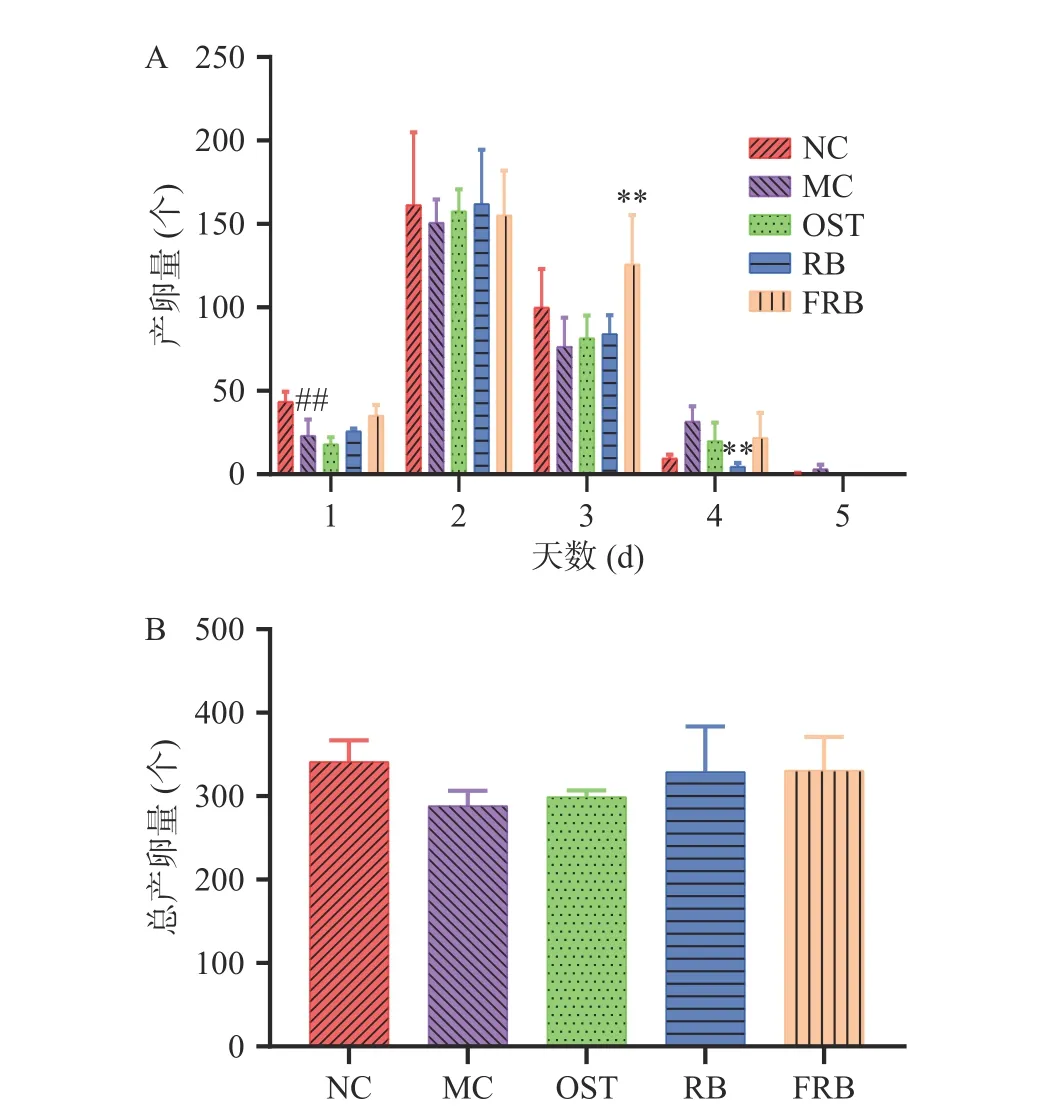
图3 发酵米荞对秀丽隐杆线虫产卵量的影响Fig.3 Effects of fermented rice buckwheat on egg production in C. elegans
2.4 发酵米荞对高脂肪线虫ROS积累的影响
当机体受到氧化损伤时(如高糖应激)会产生ROS自由基,ROS自由基的过度积累会引起氧化系统失衡,导致机体处于氧化应激状态[27]。氧化应激会引起一系列生物大分子的氧化损伤,并且参与了许多代谢疾病的发生发展,如肥胖、高脂血症等[28]。本实验用H2DCF-DA分子探针检测各组线虫体内ROS积累的情况。由图4可得,随着检测时间的延长,分子探针检测到的ROS含量逐渐增多。与对照组相比,高脂肪模型组线虫的ROS水平明显升高。而经米荞、发酵米荞干预后,高脂肪线虫的ROS相对含量明显降低,并且给予高脂肪线虫饲喂发酵米荞,相比于米荞,更显著抑制了氧化应激状态下线虫体内的ROS积累。有研究表明脂质积累与ROS水平具有强相关性,减少机体的ROS水平有助于抑制脂肪沉积[29]。由此可得,发酵米荞可以清除高脂肪线虫体内的自由基,缓解氧化损伤,从而减少高脂肪线虫体内的脂质积累。
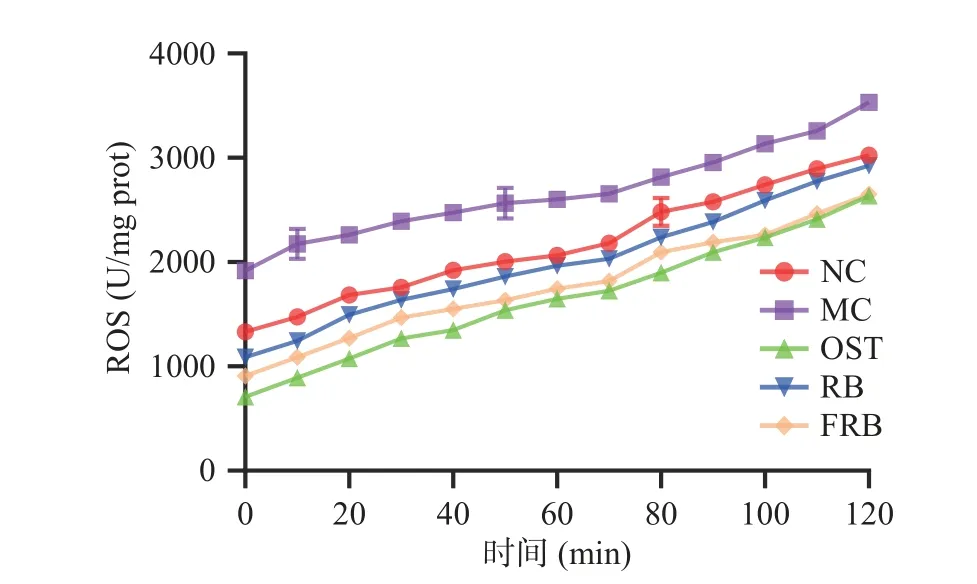
图4 发酵米荞对秀丽隐杆线虫体内ROS的影响Fig.4 Effects of fermented rice buckwheat on ROS in C.elegans
2.5 发酵米荞对高脂肪线虫胡桃醌氧化应激的影响
为研究发酵米荞对线虫抵抗氧化应激能力的影响,用500 μmol/L胡桃醌创造一个急性氧化应激的环境。胡桃醌是强氧化剂,在线虫体内会诱导产生氧化应激反应,短时间内产生大量的自由基,从而引起急性氧化损伤[30]。研究结果如图5所示,与对照组相比,高脂肪模型组线虫的生存曲线向左移,寿命由12 h缩短至10 h,说明高糖诱导加以胡桃醌应激会导致线虫生存能力降低。而经药物、米荞和发酵米荞干预后,高脂肪线虫的生存曲线明显向右移,生存时间分别增加至14、13和16 h,且发酵米荞组线虫的生存时间长于米荞组,说明发酵米荞组线虫抵抗氧化应激能力强于生米荞组,这可能与发酵米荞有较强的抗氧化活性有关[8]。王力等[31]研究表明,线虫抵抗氧化应激能力与机体的抗氧化能力具有一定的相关性,故发酵米荞可能通过发挥抗氧化功效以达到增强线虫抵抗氧化应激能力的作用。综上所述,发酵米荞显著增强了高脂肪线虫对氧化应激的耐受力,特别是在胡桃醌诱导的氧化胁迫下。
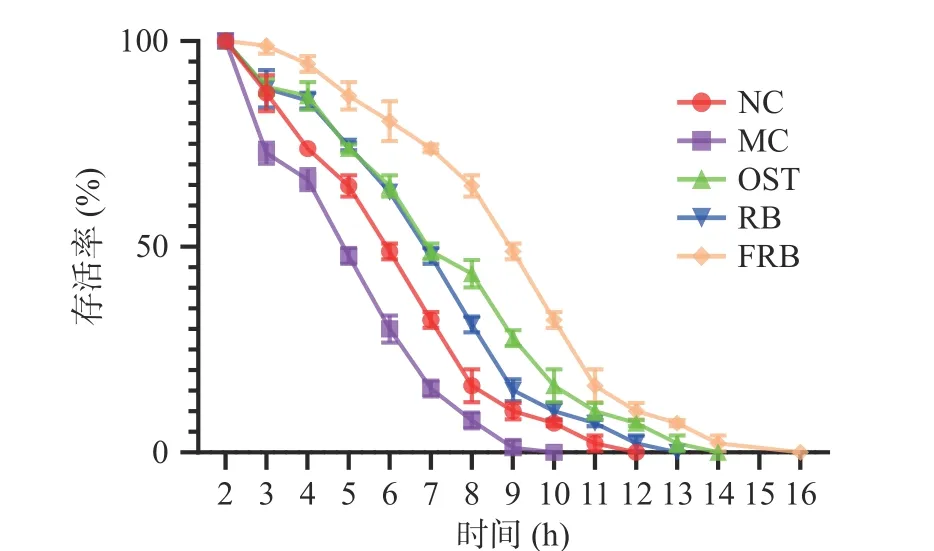
图5 发酵米荞对秀丽隐杆线虫应激能力的影响Fig.5 Effects of fermented rice buckwheat on the stress capacity of C. elegans
2.6 发酵米荞对高脂肪线虫甘油三酯含量的影响
甘油三酯是脂肪合成的重要原料,其含量常用于评价体内脂质水平。甘油三酯含量降低,将会导致线虫体内的脂肪合成减少,从而达到降脂的效果[32]。由图6所示,与对照组相比,高脂肪模型组线虫体内甘油三酯含量显著增加,为2.90 mmol/g prot,增加了46.27%(P<0.01),说明高糖诱导会导致线虫体内脂肪沉积。而给予高脂肪线虫饲喂米荞和发酵米荞均可显著降低甘油三酯含量,分别降低了34.77%和56.58%(P<0.01),并且在相同剂量下发酵米荞抑制线虫体内脂肪沉积的效果优于米荞,抑制效果与药物组相接近。黄壮等[33]研究表明,高浓度三七醇提物可以降低线虫体内甘油三酯水平达到降脂的目的,与我们研究结果相类似。Qin等[34]研究发现芦丁可以通过降低甘油三酯含量,从而减少高脂肪线虫的脂质积累。之前的研究发现,相比未发酵的米荞,经乳酸菌发酵处理的米荞的生物活性成分如黄酮、多酚类化合物含量显著增加[8],故发酵米荞展现出较好的降脂活性可能是由于黄酮类和多酚类物质的富集。
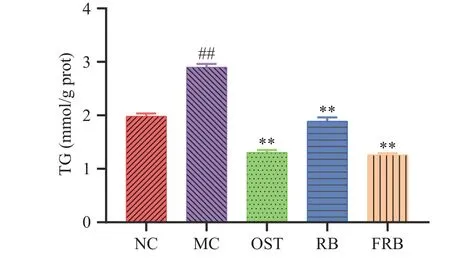
图6 发酵米荞对秀丽隐杆线虫体内甘油三酯含量的影响Fig.6 Effects of fermented rice buckwheat on triglycerides in C. elegans
2.7 发酵米荞对高脂肪线虫游离脂肪酸含量的影响
为了进一步研究发酵米荞对线虫脂肪沉积的影响,对线虫体内的游离脂肪酸含量进行测定。游离脂肪酸是中性脂肪分解后的产物之一,其水平的升高会导致自由基的过度产生,与脂质双分子层相互作用,最终产生脂质过氧化物[35]。有研究者认为,过多的游离脂肪酸会诱导肥胖、高血脂症等代谢性疾病的发生[36]。由图7所示,游离脂肪酸的测定结果与甘油三酯结果的趋势相一致。与对照组相比,高脂肪线虫体内的游离脂肪酸含量极显著增加了231.92%(P<0.01)。而给予高脂肪线虫饲喂米荞和发酵米荞均可极显著降低游离脂肪酸含量,相较于模型组分别降低了49.54%、130.54%(P<0.01),并且发酵米荞抑制线虫体内脂肪沉积的效果优于米荞,这可能与发酵米荞能显著促进脂肪水解、抑制脂肪酸合成有关[12]。由此可得,发酵米荞可以显著降低高脂肪线虫体内游离脂肪酸的含量,减少脂肪积累。
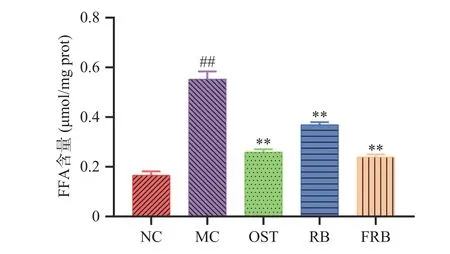
图7 发酵米荞对秀丽隐杆线虫体内游离脂肪酸含量的影响Fig.7 Effects of fermented rice buckwheat on free fatty acids in C. elegans
2.8 发酵米荞对高脂肪线虫抗氧化酶的影响
一个复杂的酶或非酶抗氧化防御系统可以清除机体内积累过多的自由基,以维持生理稳态[37]。抗氧化防御系统涉及多种酶,包括SOD、CAT和GSHPx。由图8A~图8C可得,与对照组相比,高脂肪模型组线虫的SOD、CAT和GSH-Px酶活性极显著降低,分别降低了21.90%、19.25%和45.60%(P<0.01)。相关研究表明,高糖诱导会使线虫处于氧化应激状态,使得抗氧化酶活性降低[23],与王慧等[27]的研究结果相一致。而给予高糖诱导的高脂肪线虫饲喂药物、米荞和发酵米荞均能不同程度提高抗氧化酶的活性,其中发酵米荞组线虫的SOD、CAT和GSH-Px活性最高,相比于模型组分别增加了37.49%、83.97%和185.83%(P<0.01)。由此可得,发酵米荞可以通过提高线虫体内的抗氧化酶活性来清除自由基,从而抵抗高脂肪线虫的损伤。
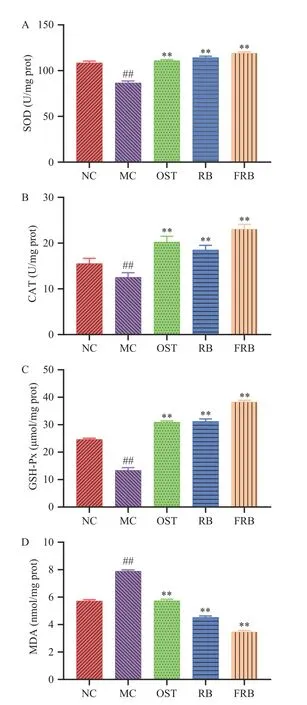
图8 发酵米荞对秀丽隐杆线虫体内抗氧化酶的影响Fig.8 Effects of fermented rice buckwheat on antioxidant enzymes in C. elegans in vivo
MDA作为细胞中多不饱和脂肪酸过氧化的游离产物之一,常用于评价机体脂质过氧化程度和氧化应激程度[38]。MDA的含量越高,则说明机体氧化损伤越严重。由图8D可知,高脂肪模型组线虫的MDA含量相比于对照组极显著增加,由5.72 nmol/mg prot增加至7.89 nmol/mg prot(P<0.01),说明高糖诱导会导致线虫抗脂质过氧化能力降低。与高脂肪模型组相比,饲喂米荞和发酵米荞能显著降低高脂肪线虫体内的MDA含量,并且发酵米荞组降低最显著,由7.89 nmol/mg prot下降至3.47 nmol/mg prot,下降了56.02%(P<0.01)。这可能是由于经益生菌发酵的米荞中含有丰富的黄酮、多酚类化合物等抗氧化成分[8],这些成分在高脂肪线虫体内显示出抗脂质过氧化的作用,从而减轻了氧化应激对线虫的损伤。综上所述,发酵米荞通过提高机体抗氧化能力和减缓氧化损伤,发挥对高脂肪线虫的降脂作用。
3 结论
本文以高脂肪秀丽隐杆线虫为研究对象,探讨发酵米荞的降脂及抗氧化活性。结果表明,经乳酸菌发酵的米荞可以显著降低高脂肪模型线虫体内的甘油三酯和游离脂肪酸含量,从而减少脂质积累。此外,发酵米荞能极显著增强高脂肪线虫体内的SOD、CAT和GSH-Px 抗氧化酶活性、极显著降低MDA含量和ROS积累(P<0.01),以增强线虫的抗氧化能力;并且在500 μmol/L胡桃醌诱导氧化应激条件下,发酵米荞能够极显著提高线虫的存活率(P<0.01),以提高线虫的抗逆性。由此可推断,发酵米荞不仅具有降低高脂肪线虫脂肪沉积的作用,还可以对机体脂肪代谢稳态具有一定的调节作用。发酵米荞展现较好的降脂活性,可能与其含有丰富的活性成分有关,但其具体降脂机制还需进一步研究。今后将利用相关突变体线虫进一步研究发酵米荞降脂作用的分子机制。
——评《油脂营养健康》

