甘草附子汤加减方通过抑制GSDMD介导的焦亡治疗CIA大鼠的作用机制研究*
张铭, 吴天宇, 刘小碣, 张妍, 何晓宇, 刘赛赛, 赵士弟,,陈莉秋, 陈传好, 张小楠,△
甘草附子汤加减方通过抑制GSDMD介导的焦亡治疗CIA大鼠的作用机制研究*
张铭1,2, 吴天宇3, 刘小碣1, 张妍4, 何晓宇1, 刘赛赛5, 赵士弟1,5,陈莉秋6, 陈传好2△, 张小楠1,5△
(1蚌埠医学院心脑血管疾病基础与临床重点实验室,2蚌埠医学院人体解剖学教研室,3蚌埠医学院公共卫生学院,4蚌埠医学院临床医学院,5蚌埠医学院病理生理学教研室,6蚌埠医学院第二附属医院中医科,安徽 蚌埠 233030)
探讨甘草附子汤加减方(GCFZD)抑制gasdermin D (GSDMD)介导细胞焦亡途径对胶原诱导性关节炎(CIA)大鼠的治疗效果。SD大鼠尾跟部注射由牛Ⅱ型胶原与弗氏佐剂混合形成的乳化剂,构建CIA大鼠模型并对其关节炎指数进行评估,将成功诱发关节炎的30只雄性SD大鼠随机分为模型组、甘草附子汤低(4 g/kg)、中(8 g/kg)和高(16 g/kg)剂量组及甲氨蝶呤(1 mg/kg)组,每组6只,连续给药30 d。测定大鼠的体重、关节炎指数和足爪肿胀指数;X线影像学观察骨质破坏和软组织厚度改变;HE染色观察脾脏和关节组织病理学改变;番红O-固绿染色观察关节软骨改变;TUNEL染色观察关节内细胞焦亡发生情况;Western blot测定TLR4、caspase-1、NLRP3和GSDMD蛋白表达;real-time PCR和ELISA测定IL-1β、IL-6和IL-10细胞因子表达。与模型组相比,GCFZD治疗显著改善CIA大鼠软组织肿胀和骨质破坏,降低脾脏和胸腺指数;HE染色结果显示,GCFZD治疗减轻CIA大鼠脾脏和踝关节组织病理学改变;番红O-固绿染色结果显示,GCFZD治疗减少软骨组织破坏,修复软骨结构;TUNEL染色结果显示,GCFZD显著抑制关节组织内的细胞焦亡;Western blot结果表明,GCFZD降低CIA大鼠脾脏中TLR4、cleaved caspase-1、NLRP3和GSDMD-N的蛋白表达;real-time PCR和ELISA结果显示,GCFZD减少CIA大鼠IL-1β和IL-6的mRNA和蛋白水平的表达,上调IL-10的mRNA和蛋白水平的表达。GCFZD能够抑制GSDMD介导的细胞焦亡,减少IL-1β和IL-6分泌,促进IL-10分泌,有效减轻CIA大鼠的类风湿关节炎症状。
甘草附子汤;类风湿关节炎;gasdermin D;细胞焦亡
类风湿关节炎(rheumatoid arthritis, RA)是一种慢性自身免疫性疾病,以关节骨质破坏和侵蚀性滑膜炎症为主要病理特征,致残率高且预后较差,尚缺乏有效防治措施[1]。RA临床药物治疗常通过免疫抑制剂与非甾体药物的联合应用缓解患者病情,但常规药物治疗导致的治疗耐受和毒副作用致使其临床应用受限[2]。因此,探索RA治疗新途径尤为重要。
甘草附子汤源于张仲景的《伤寒论》,包含甘草、附子、白术和桂枝四种中药,制附子补火助阳、逐风驱湿;桂枝助阳化气、温经散寒;白术除湿益燥、健脾益气;甘草通血利痹、调和诸药,全方共奏除湿祛风、温经散寒之效,能够有效缓解关节肿胀、疼痛、僵直等症状,临床已有报道其对RA具有较好治疗效果[3-4],本研究前期根据临床患者实际症状和兼症,在原方剂的基础上加入了知母、白芍、威灵仙、鸡血藤、木瓜和伸筋草等六味中药,临床治疗效果较好,但其具体机制不明。细胞焦亡是一种由Gasdermin D(GSDMD)蛋白介导的溶解性细胞程序性死亡,研究表明,依赖GSDMD诱导的细胞焦亡途径与RA滑膜炎症的发生密切相关,通过抑制GSDMD的表达有助于缓解RA[5-6]。已有研究证明甘草附子汤能够通过抑制滑膜成纤维细胞增殖、炎症因子分泌等减轻RA疾病活动度[7-8],但从细胞焦亡层面探究GCFZD的药效学机制尚缺乏文献报道。因此,本研究对CIA模型大鼠给予不同剂量的GCFZD处理后,通过检测TLR4、caspase-1、NLRP3、GSDMD等焦亡相关蛋白的表达水平,首次探讨了GCFZD是否能够抑制GSDMD诱导的焦亡途径对CIA大鼠起到治疗作用,旨在进一步探究GCFZD治疗RA的作用机制,为RA治疗方法的创新发展提供理论依据。
材料和方法
1 实验动物
雄性SD大鼠45只,5~6周,体重(200±20) g,购自安徽医科大学,饲养于SPF环境,保证充足食物与饮水,保持12 h光照周期。动物实验开始前,经过6~7 d适应饲养环境,动物方案经过蚌埠医学院动物实验中心伦理委员会的批准。
2 主要试剂
牛Ⅱ型胶原和完全弗氏佐剂(货号20022、货号7009,chondrex);甲氨蝶呤(国药准字H31020644,上海上药信谊药厂有限公司);异氟烷(R510-22,RWD);4%多聚甲醛通用型组织固定液、RIPA裂解液、蛋白酶抑制剂和BCA蛋白浓度测定试剂盒(货号BL359A、BL504A、BL612A、BL521A,biosharp);兔抗β-Actin和兔抗GSDMD抗体(货号WX766117、A20728,ABclonal);兔抗cleaved caspase-1、兔抗GSDMD N-Terminal抗体(货号AF4005、DF13758,Affinity);鼠抗TLR4(货号sc-293072,SANTA);兔抗caspase-1、兔抗NLRP3、HRP-羊抗兔IgG、HRP-羊抗小鼠IgG(货号BA2220、A00034、BA1054、BA1050,BOSTER);Trizol(货号:15596026,ambion);FastKing RT Kit 反转录试剂盒、SuperReal PreMix Plus 试剂盒(货号KR116、FP205,TIANGEN);大鼠白细胞介素-1β (interleukin-1β,IL-1β)ELISA试剂盒、大鼠IL-6 ELISA试剂盒和大鼠IL-10 ELISA试剂盒(货号JM-01454R2、JM-01597R2、JM-01602R2,江苏晶美生物科技);TUNEL试剂盒(货号G1501,武汉赛维尔生物科技有限公司)。
3 主要方法
3.1甘草附子汤制备制附子(15 g)、桂枝(10 g)、甘草(9 g)、知母(12 g)、白芍(20 g)、威灵仙(12 g)、鸡血藤(20 g)、白术(15 g)、木瓜(12 g)和伸筋草(20 g)购自山东。按照2020版《中华人民共和国药典》制备甘草附子汤,药材提前浸入20倍量水浸泡,武火煎煮1次,转文火蒸煮至药液至300 mL,取出后滤过,放入4 ℃冰箱备用。
3.2大鼠CIA模型构建胶原诱导性关节炎(CIA)大鼠模型的建立在课题组前期经验及参考文献中的方法优化进行[9]。步骤简述如下:动物实验开始前,经过6~7 d适应饲养环境,取弗氏不完全佐剂1∶1分次滴加至2 g/L牛II型胶原中,使用沃信手持式匀浆机冰上配制乳化液;配置的 2 g/L的牛Ⅱ型胶原-弗氏佐剂乳化液,在大鼠尾根前1 cm处采用皮内注射,针斜面朝上平行进针,初次免疫剂量200 μL,7 d后进行加强免疫,每只SD大鼠注射乳化剂量100 μL,加强免疫5~8 d后,出现关节红肿,关节炎评分、足爪 X-ray、大体照片、足跖厚度证明成模。
3.3实验分组和药物治疗从初始免疫后第15天开始,每隔3 d对大鼠关节炎指数(arthritis index,AI)评分,实验组大鼠AI>4 分,认定为关节炎诱导成功,分入实验组;按照随机分组原则,每组6只,分为正常(vehicle)组,模型组(CIA),甘草附子汤低(GCFZD-L)、中(GCFZD-M)、高剂量组(GCFZD-H)和MTX组,各组连续灌胃给药30 d。甘草附子汤低、中、高剂量组给药量分别为4、8和16 g/kg ;MTX组给药量为1 mg/kg,每周1次;正常组和模型组给予2 mL的PBS溶液。
3.4关节炎指数评估根据大鼠关节红肿程度、范围及关节肿大、变形情况,采用五级评分法进行关节炎指数评分,每个关节的炎症最高分为4分,4个关节炎症的总和最高为16分(0分,无关节炎;1分,个别足趾发红、肿胀;2分,大部分足趾及足底肿胀;3分,踝关节及以下肿胀;4分,肿胀累及踝关节以上且不能负重)。
3.5胸腺和脾指数评估大鼠脱颈处死后,剥离胸腺和脾脏,无菌PBS清洗组织血液,无菌吸水纸吸去多余水分,分别称量胸腺和脾脏重量,其与大鼠体重比值即为胸腺和脾脏指数。
3.6X线影像学评估处死前3 d,异氟烷麻醉大鼠,固定大鼠四肢,使用数字诊断DR系统(飞利浦医疗),对CIA大鼠后肢软组织肿胀情况及骨质情况进行数字放射成像检查。
3.7酶联免疫吸附试验异氟烷麻醉大鼠后,将SD大鼠置于仰卧位,固定四肢,用无菌剪刀剪开腹部皮肤,无菌镊拨开肠组织,暴露腹后壁,使用玻璃分针分开腹主静脉和腹主动脉,刺入腹主动脉后接入无菌采血管采血。血液室温放置20~30 min后,低温离心机4 ℃,3 000 r/min,离心10 min,取得血清。按照说明书,用酶联免疫吸附试剂盒(江苏晶美)检测CIA大鼠血清中IL-1β、IL-6和IL-10的表达水平。
3.8组织病理学染色脾组织和关节滑膜组织在4%多聚甲醛中固定后,关节脱钙后与脾组织进行脱水和包埋处理。切片5 μm厚,苏木精伊红(H&E)染色、番红固绿染色及TUNEL染色。对脾组织切片进行外周动脉淋巴鞘密度、淋巴结节增生、边缘带增生和红髓等参数的评估;对踝关节的滑膜组织、炎细胞浸润、软骨破坏、骨质侵蚀、血管翳形成和滑膜增生等变化进行评估;通过TUNEL染色阳性率对关节组织中是否发生细胞焦亡进行评估。公式:TUNEL阳性率(%)=TUNEL染色阳性细胞数/Hoechst阳性细胞数×100%。
3.9real-time PCR在盛放组织的无菌EP管中加入Trizol裂解液,采用超微量组织研磨机充分研磨组织,按照5∶1加入氯仿充分震荡,低温12 000 r/min×15 min,取上清后等比例加入异丙醇,颠倒混匀后低温12 000 r/min×10 min,弃上清后加入75%乙醇低温7 500 r/min×5 min洗涤两次,加入无水乙醇低温7 500 r/min×5 min洗涤两次,无菌吸水纸吸干多余液体,加入DEPC水溶解。按照FastKing RT Kit反转录试剂盒要求操作合成cDNA,以cDNA 为模板,按照SuperReal PreMix Plus试剂盒要求操作加样,试验所用引物均由安徽华晓基因科技有限公司合成,引物序列信息见表1。选择β-actin作为内参照,用相对定量(2-ΔΔCt)法计算目的基因的相对表达量。
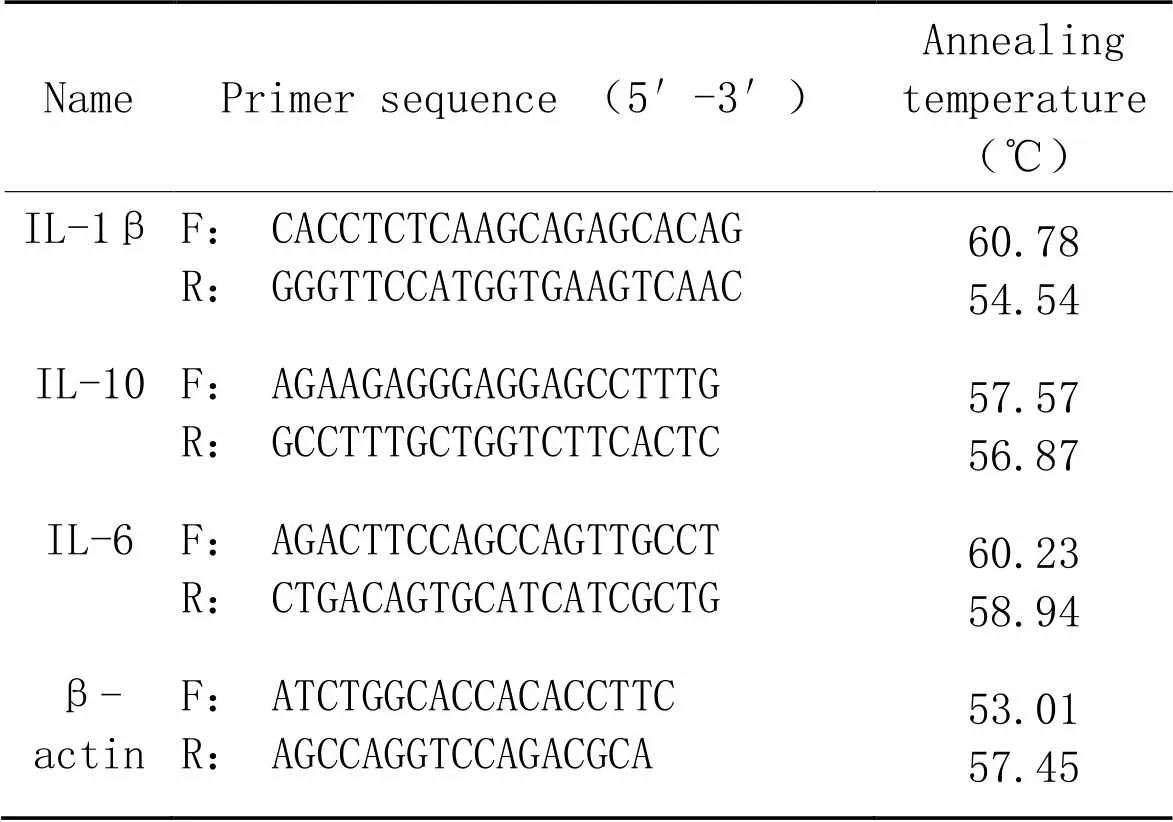
表1 real-time PCR引物序列
F: forward; R: reverse.
3.10Western blot提取各组大鼠脾脏组织蛋白,使用BCA蛋白测定试剂盒测定蛋白浓度,上样后120 V电泳1.5 h,200 mA转膜2 h,5%脱脂牛奶封闭2 h,Ⅰ抗(均1∶1 000;TLR4抗体, Santa Cruz; NLRP3和caspase-1抗体,Boster;cleaved caspase-1和GSDMD N-Terminal抗体,Affinity; GSDMD抗体, ABclonal)4 °C摇床孵育过夜,Ⅱ抗室温封闭2 h,使用超敏ECL化学发光底物在凝胶成像系统曝光,采集曝光图像并使用ImageJ软件分析灰度值。
4 统计学处理
采用SPSS 21.0分析数据,以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析及LSD-检验。以<0.05为差异有统计学意义。
结果
1 大鼠的一般情况
各组大鼠造模前基本状态良好,毛发正常有光泽,排便正常,关节活动自由。加强免疫一周后,除对照组外,各组大鼠的足爪和踝关节出现不同程度的红肿,体重增长不明显,毛发杂乱。加强免疫两周后,除对照组外,各组大鼠足爪厚度明显增加,踝关节红肿明显,关节活动受限,体重出现下降趋势,毛发灰暗无光泽。经药物治疗4周后,各治疗组大鼠精神状态较好,体重增长趋势明显,毛发整齐有光泽,关节肿胀度减轻,关节活动尚可。
2 GCFZD降低CIA大鼠关节肿胀及骨质破坏
X线影像学结果显示,与对照组相比,模型组大鼠踝关节软组织肿胀明显,关节间隙增宽,骨密度降低;GCFZD中、高剂量组和甲氨蝶呤组处理后大鼠关节肿胀程度明显降低,骨质破坏程度减轻,见图1。
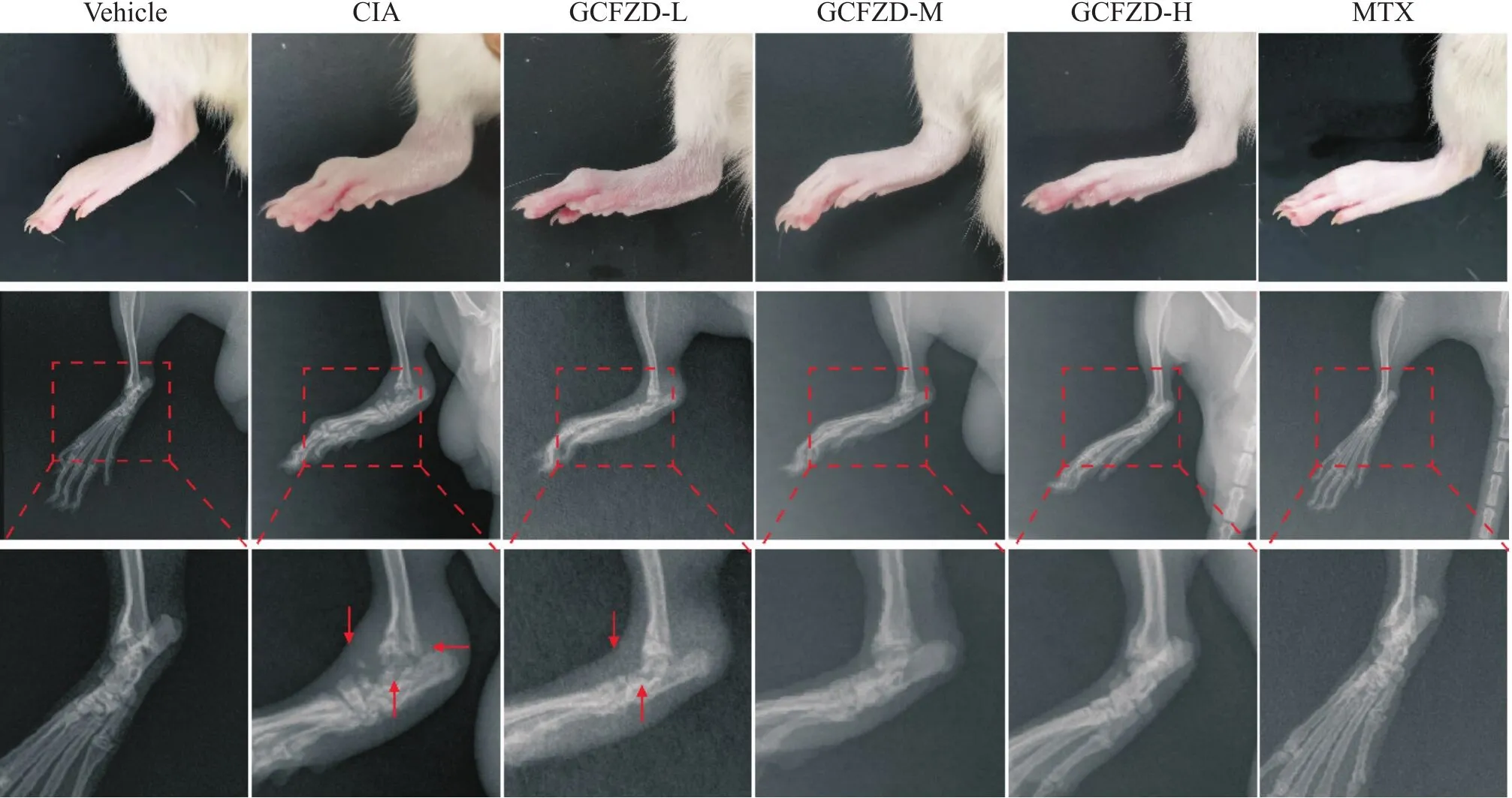
Figure 1. Imaging data of joint swelling and bone changes in different groups of rats. ↓: Soft tissue swelling;↑: Bone erosion;←: Joint space.
3 GCFZD对CIA大鼠体质量、关节炎指数和足爪肿胀指数的影响
模型组大鼠的体重增长缓慢,明显低于对照组大鼠(<0.01);GCFZD中、高剂量和甲氨蝶呤治疗后大鼠体重增加(<0.01),见图2A。与模型组大鼠相比,GCFZD低、中、高剂量和甲氨蝶呤治疗可以显著降低大鼠关节炎指数(<0.01),减轻足爪肿胀程度(<0.01),见图2B、C。

Figure 2. Changes of joint weight, arthritis score and paw swelling index in each group. A: body weight; B: arthritis score; C: degree of foot swelling. Mean±SD. n=3. *P<0.05, **P<0.01 vs CIA group.
4 GCFZD降低CIA大鼠脾脏指数和胸腺指数
与对照组相比,模型组大鼠脾脏明显肥大,GCFZD中、高剂量和甲氨蝶呤治疗后CIA大鼠脾脏增大得到缓解,形态大小接近对照组(图3A)。进一步对各组大鼠脾脏指数和胸腺指数进行测定,结果显示,模型组大鼠较对照组脾脏指数和胸腺指数明显升高(<0.01);GCFZD中、高剂量和甲氨蝶呤治疗后可降低CIA大鼠脾脏指数(<0.01)和胸腺指数(<0.01),甘草附子汤低剂量组对CIA大鼠胸腺指数无明显影响(>0.05),见图3B、C。

Figure 3. Effect of GCFZD on spleen and thymus index of CIA rats. A: spleen samples of rats in each group; B: index of spleen; C: index of thymus. Mean±SD. n=3. **P<0.01 vs vehicle group; ##P<0.01 vs CIA group.
5 GCFZD改善CIA大鼠脾脏组织病理学改变
脾脏HE染色镜下结果显示,与对照组相比,模型组大鼠脾脏组织红髓着色较深,周围动脉淋巴鞘密度显著增高,边缘区增宽和淋巴结节增生明显;与模型组相比,GCFZD中、高剂量和甲氨蝶呤治疗组大鼠脾组织白髓和主要生发中心未见明显增生,但经GCFZD低剂量处理的CIA大鼠仍可见边缘区和淋巴结节增生(图4A)。脾组织病理学评估显示,GCFZD低、中、高剂量治疗组大鼠各项病理参数评分均低于模型组大鼠(图4B)。

Figure 4. Spleen HE staining images (A) and histopathological scores (B) of rats in each group. a: peripheral arterial lymphatic sheath density; b: marginal zone hyperplasia; c: lymphoid nodular hyperplasia; d: red pulp. Mean±SD. n=3. *P<0.05, **P<0.01 vs vehicle group; #P<0.05, ##P<0.01 vs CIA group.
6 GCFZD改善CIA大鼠关节组织病理学改变
踝关节HE染色镜下结果显示,对照组大鼠关节内组织结构完整,关节面光滑无破损,滑膜组织和软骨组织未见增生;与对照组相比,模型组大鼠关节软骨和滑膜组织增生明显,骨质侵蚀程度较重,可见大量炎症细胞浸润和血管翳产生;经GCFZD低、中、高剂量和甲氨蝶呤治疗后,CIA大鼠关节破坏程度显著降低,软骨面相对完整,滑膜组织厚度增生不明显,炎症细胞浸润减少(图5A、B)。踝关节组织病理学评分显示,GCFZD低、中、高剂量治疗组大鼠滑膜增生、骨质侵蚀、血管翳和炎症细胞浸润水平得到不同程度缓解,中、高剂量治疗组效果与甲氨蝶呤治疗组相似,没有显著性差异(图5C)。
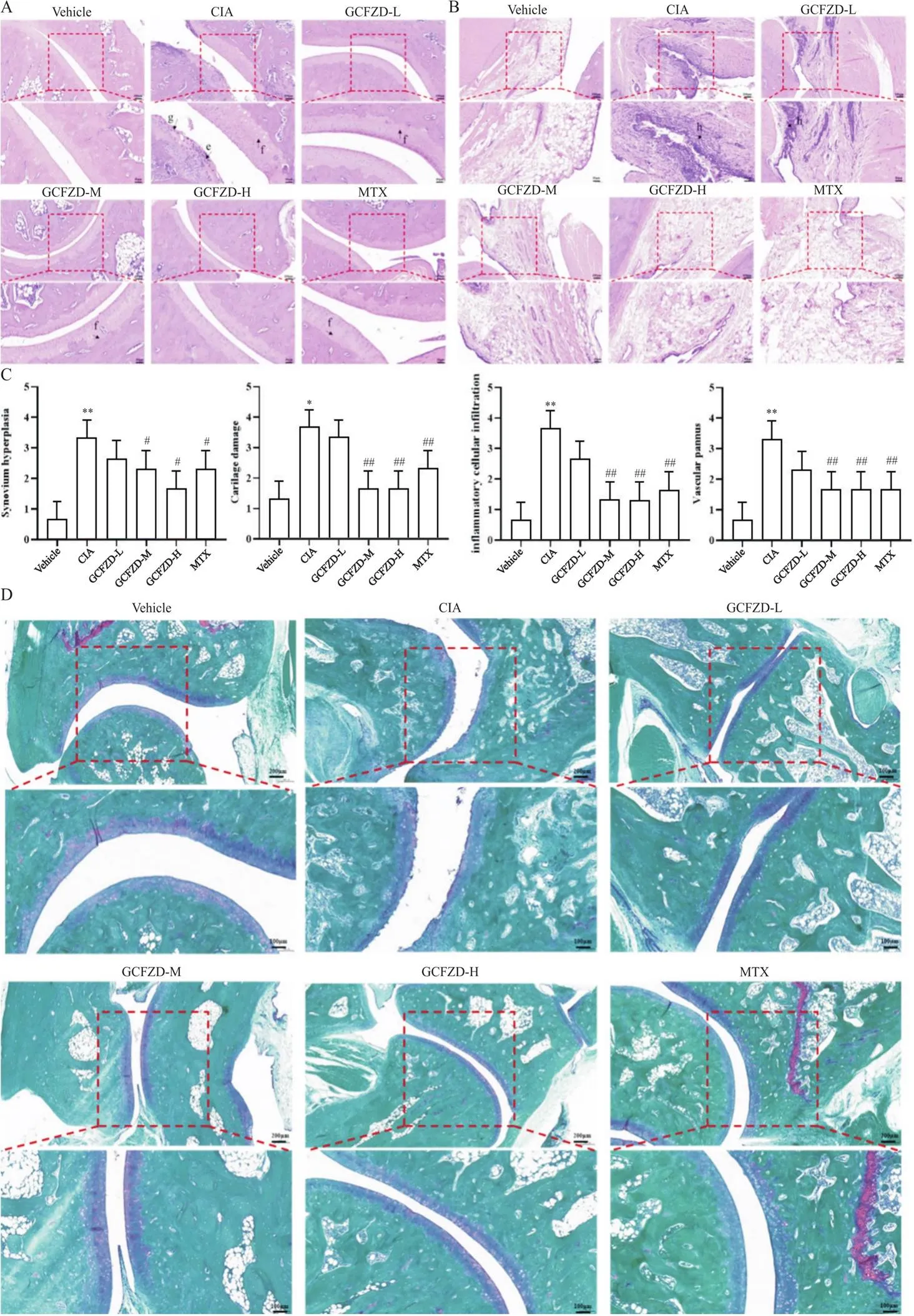
Figure 5. Images of H&E and Safranine O-Fast Green staining of the ankle joint in various groups of rats. A: HE staining of ankle joint; B: HE staining of synovial tissue; C: statistical chart of ankle pathological score; D: safranin O-Fast Green staining of ankle joint. e: synovium hyperplasia; f: carilage damage; g: vascular pannus; h: inflammatory cellular infiltration. Mean±SD. n=3. *P<0.05, **P<0.01 vs vehicle group; #P<0.05, ##P<0.01 vs CIA group.
为进一步反映关节内软骨及软骨下骨的组织形态学变化,对踝关节进行番红O-固绿染色。镜下结果显示,对照组大鼠关节软骨及软骨下组织结构完整,软骨潮线清晰,软骨基质分布均匀;与对照组相比,模型组大鼠软骨面不完整并伴有糜烂、脱落,软骨下骨组织受侵袭程度较重,软骨潮线模糊,软骨基质分布不均匀;经GCFZD低、中、高剂量和甲氨蝶呤处理后大鼠关节内软骨结构相对完整,软骨及软骨下组织分界清晰,软骨潮线较规则清晰,软骨面相对完整(图5D)。
7 GCFZD抑制细胞焦亡并降低TLR4、caspase-1和NLRP3蛋白水平抑制GSDMD表达
踝关节TUNEL染色结果显示,与对照组相比,模型组大鼠关节可见大量膨大、变形的TUNEL阳性细胞;经GCFZD治疗后,TUNEL阳性细胞率明显降低(<0.05),见图6A。Western blot结果显示,与对照组比较,模型组大鼠脾脏中TLR4蛋白表达增高,同时伴有cleaved caspase-1、NLRP3和GSDMD-N的表达升高,这提示TLR4通过激活caspase-1,活化的caspase-1剪切端和NLRP3炎症小体导致GSDMD-N与胞膜磷脂蛋白结合后形成孔洞,诱发细胞焦亡(<0.05),经GCFZD和甲氨蝶呤处理后,TLR4、cleaved caspase-1、NLRP3等焦亡相关蛋白表达下调,并降低GSDMD-N蛋白表达,且GCFZD对GSDMD-N降低较MTX相比更明显(<0.05),见图6B、C。

Figure 6. GCFZD decreased TLR4, caspase1 and NLRP3 protein levels and inhibited GSDMD expression. A: the TLR4, caspase-1, NLRP3 and GSDMD protein gray bands in different groups; B: gray scale statistics of TLR4, caspase-1, NLRP3 and GSDMD proteins in different groups. GSDMD-FL: full length of GSDMD; GSDMD-N: N-terminal of GSDMD. Mean±SD. n=3. *P<0.05, **P<0.01 vs vehicle group; #P<0.05, ##P<0.01 vs CIA group.
8 GCFZD减少CIA大鼠IL-1β和IL-6分泌,并促进IL-10表达抑制RA进展
与模型组相比,GCFZD低、中、高剂量治疗组大鼠血清中IL-1β和IL-6的mRNA和蛋白水平表达下调(<0.05),见图7A,且治疗效果呈现剂量依赖性;甲氨蝶呤治疗组IL-1β表达水平与高剂量组相比没有显著差异(>0.05),但甲氨蝶呤治疗组IL-6的mRNA水平明显低于GCFZD高剂量治疗组(<0.01);低、中、高剂量和甲氨蝶呤组治疗后可增加CIA大鼠IL-10的mRNA和蛋白表达水平(<0.01),但高剂量治疗组比甲氨蝶呤组升高更为明显(<0.01),见图7B。
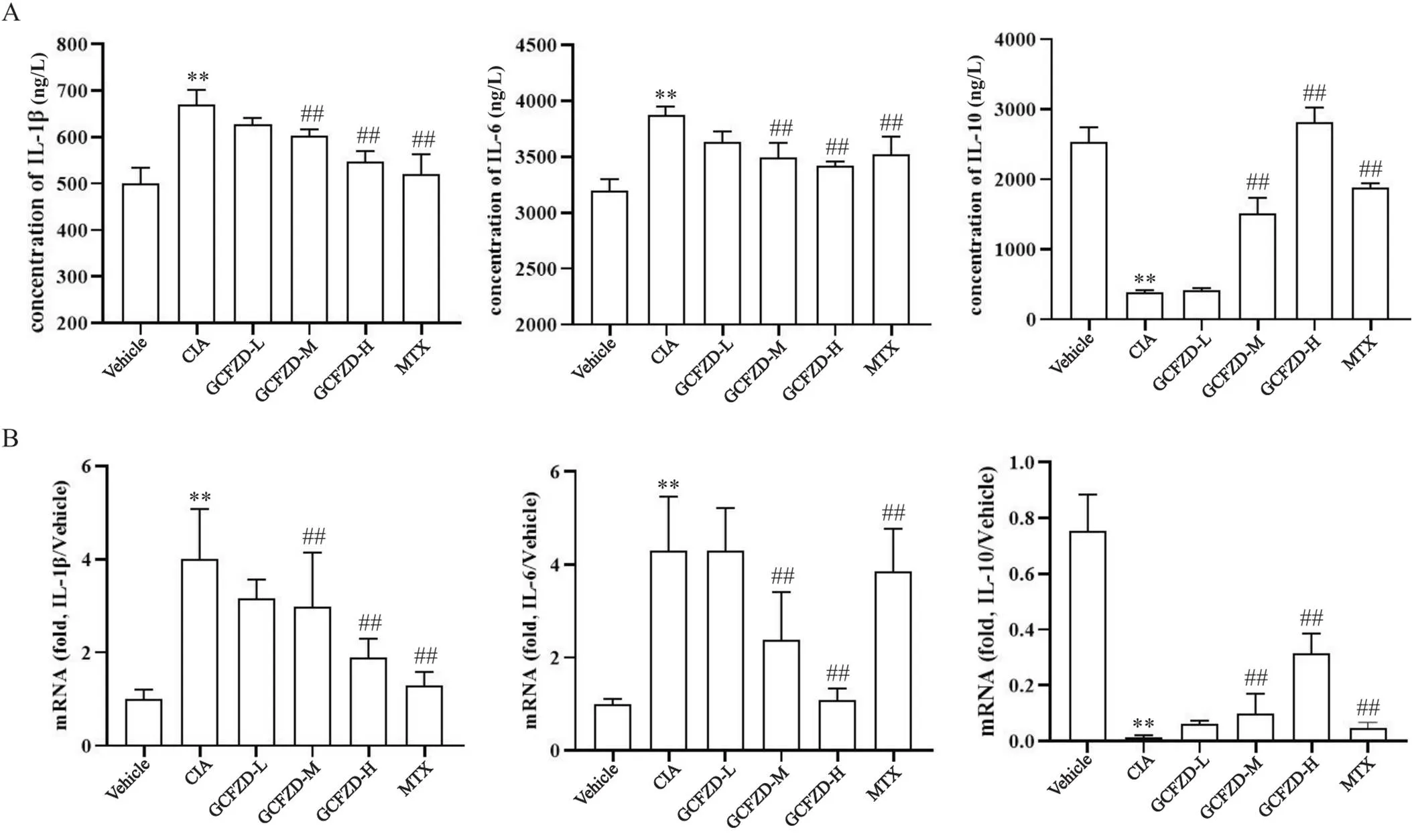
Figure 7. GCFZD reduced the secretion of IL-1β and IL-6, and increased IL-10 in CIA rats to inhibit the progression of rheumatoid arthritis. A: the protein levels of IL-1β, IL-6 and IL-10 were detected by ELISA; B: the mRNA levels of IL-1β, IL-6 and IL-10 were detected by real-time PCR. Mean±SD. n=3. *P<0.05, **P<0.01 vs vehicle group; #P<0.05, ##P<0.01 vs CIA group.
讨论
RA是一种中老年人群常患的慢性非传染性疾病,疾病早期常通过单独使用甲氨蝶呤或甲氨蝶呤联合非甾体类抗炎药、糖皮质激素、靶向药等降低疾病活动度[10]。甲氨蝶呤作为常规治疗药物虽然能够改善部分患者的临床症状,但因其安全窗口窄、早期耐受性差、毒副作用明显等弊端导致临床上应用受限[11]。因此,迫切需要探索RA治疗新途径、新方法。甘草附子汤原方剂由甘草、附子、白术和桂枝4味主药组成,具有散寒止痛、温通经脉、补脾益气的作用,是治疗RA的经典汤剂。结合中医辨证论治的整体观念,本研究在原方剂的基础上加入知母止渴除烦、通便润燥;白芍敛阴止汗、柔肝止痛;威灵仙祛风湿、通经络;鸡血藤舒筋活络;木瓜祛湿除痹;伸筋草活血化瘀,以加强方剂活血通络、祛风散寒、补气益血的功效。CIA大鼠是常用的RA动物模型,与RA患者具有高度一致的免疫和病理学改变[9]。本研究通过尾部注射牛Ⅱ型胶原与弗氏佐剂形成的乳化剂来构建CIA大鼠模型,给予不同剂量甘草附子汤加减方,观察了甘草附子汤加减方对RA的治疗效果,并对其作用机制进行了探究。
RA作为一种慢性自身免疫病,全身炎症反应和滑膜成纤维细胞异常增殖导致的关节肿胀、骨密度降低和关节畸形等是RA的主要临床表现和生物学观测指标[12]。甲氨蝶呤作为传统抗风湿药,主要通过抑制二氢叶酸和脱氧胸苷一磷酸的生成进而减少嘌呤和嘧啶的生成,从而发挥优异的免疫抑制和抗炎作用[13]。同传统抗风湿药物的治疗机制类似,中医单药或复方治疗也主要通过抑制过度活跃的免疫应答或维持滑膜细胞正常生理稳态以达到抗炎和骨保护的效果。例如,昆明山海棠通过抑制IL-12、IL-23和MMP-13等炎症因子的分泌发挥全身抗炎作用,对RA有较好的治疗效果[14];传统中草药青风藤的有效成分青藤碱通过增加miR-23b-3p的表达并下调其下游靶标成纤维细胞生长因子9(fibroblast growth factor 9,FGF9)的水平,诱导疾病活动期滑膜成纤维细胞的凋亡并抑制其异常增殖[15]。与上述的研究结果相似,我们通过给予不同实验剂量的甘草附子汤加减方治疗后,CIA大鼠关节软组织肿胀和骨质破坏程度得到显著改善,炎症细胞浸润减少,关节炎指数和足爪肿胀指数明显降低,这说明甘草附子汤加减方能够有效降低RA的疾病活动度。
多种炎症细胞因子介导的滑膜炎症在RA的发病过程中发挥重要作用[16]。研究证明,GSDMD蛋白介导的免疫细胞焦亡与炎症因子的释放密切相关[17]。焦亡发生过程中,GSDMD的特定结构域被NLRP3激活的caspase-1/-4/-5/-11识别并切割,释放出GSDMD-N端片段与质膜上的磷脂分子相结合,诱导质膜孔洞的形成,破坏细胞膜完整结构,导致质膜溶解并释放IL-1β、IL-6和TNF-α等炎症因子,诱导滑膜炎症的发生[18-19]。本研究结果显示,RA发病过程中存在细胞焦亡,经GCFZD处理后,CIA大鼠踝关节中发生焦亡的细胞数明显降低(<0.05),这提示GCFZD能够抑制细胞焦亡发挥治疗效果。同时,脾脏中TLR4、cleaved caspase-1、NLRP3、GSDMD-N端蛋白的表达显著下调(<0.05),IL-1β和IL-6促炎细胞因子的mRNA和蛋白表达水平降低(<0.01),IL-10抗炎细胞因子的mRNA和蛋白表达水平增加(<0.01),这说明GCFZD能够抑制GSDMD介导的细胞焦亡途径,减少炎症因子的分泌,改善RA的滑膜炎症。
综上所述,甘草附子汤能够抑制GSDMD介导的细胞焦亡,下调IL-1β和IL-6促炎细胞因子的表达水平,增加IL-10抗炎因子的分泌,显著抑制RA关节组织病理学改变和滑膜炎症的发生,降低RA的疾病活动度。但本项研究中缺少GCFZD对CIA大鼠成纤维滑膜细胞方面的调控研究,在后续的研究中将从细胞层面更加深入探讨分析GCFZD对RA干预的作用机制。本研究探究了甘草附子汤加减方对RA的治疗效果和作用机制,为RA的创新疗法提供理论依据。
[1] Sparks JA. Rheumatoid arthritis[J]. Ann Intern Med, 2019, 170(1):ITC1-ITC16.
[2] Aletaha D, Smolen JS. Diagnosis and management of rheumatoid arthritis: a review[J]. JAMA, 2018, 320(13):1360-1372.
[3]曹江山, 庄贺, 侯王君, 等. 甘草附子汤治疗类风湿关节炎34例临床观察[J]. 中医药导报, 2013, 19(5):35-37.
Cao JS, Zhuang H, Hou WJ, et al. Chinical observation of 34 cases of rheumatoid arthritis treated by Licorice Aconiti Decoction[J]. Cuid J Tradit Chin Med Pharm, 2013, 19(5):35-37.
[4]叶映月. 甘草附子汤治疗寒湿型踝关节炎33例时效观察[J]. 中国实验方剂学杂志, 2010, 16(12):231.
Ye YY. Observation on 33 cases of cold and dampness ankle arthritis treated by Glycyrrhiza aconiti Decoction[J]. Chin J Exp Tradit Med Formulae, 2010, 16(12):231.
[5] Shi J, Gao W, Shao F. Pyroptosis: gasdermin-mediated programmed necrotic cell death[J]. Trends Biochem Sci, 2017, 42(4):245-254.
[6] Spel L, Martinon F. Inflammasomes contributing to inflammation in arthritis[J]. Immunol Rev, 2020, 294(1):48-62.
[7]李东薇, 穆柏辰, 窦德强, 等. 甘草附子汤对胶原诱导性关节炎大鼠血清和关节液中IL-1β、IL-10及TNF-α含量的影响[J]. 中华中医药杂志, 2020, 35(12):6355-6358.
Li DW, Mu BC, Dou DQ, et al. Effects of Gancao Fuzi Decoction on IL-1β, IL-10 and TNF-α in serum and synovial fluid of collagen-induced arthritis rats[J]. China J Tradit Chin Med Pharm, 2020, 35(12):6355-6358.
[8]蔡悦, 张博, 郭静. 甘草附子汤对佐剂性关节炎小鼠滑膜成纤维样细胞增殖的影响[J]. 中国实验方剂学杂志, 2019, 25(11):29-33.
Cai Y, Zhang B, Guo J. Effect of Gancao Fuzitang on synovial fibroblast-like cell proliferation in adjuvant arthritis mice model[J]. Chin J Exp Tradit Med Formulae, 2019, 25(11):29-33.
[9] Zhao T, Xie Z, Xi Y, et al. How to model rheumatoid arthritis in animals: from rodents to non-human primates [J]. Front Immunol, 2022, 13:887460.
[10] García-González CM, Baker J. Treatment of early rheumatoid arthritis: methotrexate and beyond[J]. Curr Opin Pharmacol, 2022, 64:102227.
[11] Giollo A, Fuzzi E, Doria A. Methotrexate in early rheumatoid arthritis: is the anchor drug still holding?[J]. Autoimmun Rev, 2022, 21(4):103031.
[12] Scherer HU, Häupl T, Burmester GR. The etiology of rheumatoid arthritis[J]. J Autoimmun, 2020, 110:102400.
[13] Katturajan R, S V, Rasool M, et al. Molecular toxicity of methotrexate in rheumatoid arthritis treatment: a novel perspective and therapeutic implications[J]. Toxicology, 2021, 461:152909.
[14] 母传贤, 刘国玲. 昆明山海棠对CIA大鼠足爪组织MMP-13蛋白表达及血清和足爪组织中IL-12、IL-23和IL-37水平的影响[J]. 中国病理生理杂志, 2015, 31(11):2090-2095.
Mu CX, Liu GL. Effect ofHutch on MMP-13 protein expression and IL-12, IL-23 and IL-37 levels in serum and foot paws of rats with collagen-induced arthritis[J]. Chin J Pathophysiol, 2015, 31(11):2090-2095.
[15] 李嘉, 付婷婷, 张光峰, 等. 青藤碱通过miR-23b-3p/FGF9诱导人类风湿关节炎成纤维细胞样滑膜细胞凋亡[J]. 中国病理生理杂志, 2020, 36(9):1653-1660.
Li J, Fu TT, Zhang GF, et al. Sinomenine induces apoptosis of human rheumatoid arthritis fibroblastlike synoviocytes via miR-23b-3p/FGF9 signaling pathway[J]. Chin J Pathophysiol, 2020, 36(9):1653-1660.
[16] Kondo N, Kuroda T, Kobayashi D. Cytokine networks in the pathogenesis of rheumatoid arthritis[J]. Int J Mol Sci, 2021, 22(20):10922.
[17] Tang L, Lu C, Zheng G, et al. Emerging insights on the role of gasdermins in infection and inflammatory diseases [J]. Clin Transl Immunology, 2020, 9(10):e1186.
[18] Tang D, Kang R, Berghe TV, et al. The molecular machinery of regulated cell death[J]. Cell Res, 2019, 29(5):347-364.
[19] Chadha S, Behl T, Bungau S, et al. Mechanistic insights into the role of pyroptosis in rheumatoid arthritis[J]. Curr Res Transl Med, 2020, 68(4):151-158.
Mechanism of Gancao-Fuzi Decoction in treatment of collagen-induced arthritis rats via inhibiting GSDMD-mediated pyroptosis
ZHANG Ming1,2, WU Tianyu3, LIU Xiaojie1, ZHANG Yan4, HE Xiaoyu1, LIU Saisai5, ZHAO Shidi1,5, CHEN Liqiu6, CHEN Chuanhao2△, ZHANG Xiaonan1,5△
(1,,2,,3,,4,5,6,,233030,)
To explore the therapeutic effect of Gancao-Fuzi Decoction (GCFZD) on collagen-induced arthritis (CIA) in rats by inhibiting the GSDMD-mediated pyroptosis.The tail heels of rats were injected with an emulsifier formed by mixing the bovine type II collagen with Freund's adjuvant to construct the CIA rat models and evaluate its arthritis indexes. The 30 male CIA rats were randomly divided into the model group, the low- (4 g/kg), medium- (8 g/kg) and high-dose (16 g/kg) groups of GCFZD and the methotrexate group (1 mg/kg), 6 rats per group for 30 days. The body weight, arthritis index and paw swelling index were recorded in each group of rats.X-ray imaging to observe the changes in bone destruction and soft tissue thickness, and the spleen and joints were detected by HE staining to observe the histopathological changes.The safranine o-fast green staining was used to observe articular cartilage changes. TUNEL staining was performed to evaluate cellular pyroptosis. Western blot for TLR4, caspase-1, NLRP3 and GSDMD protein expression. Real-time PCR and ELISA for IL-1β, IL-6 and IL-10 cytokine expression.Compared with the model group, there were significant improvements in soft tissue swelling and bone destruction, as well as reduced spleen and thymus indices in CIA rats with GCFZD treatment. HE staining results showed that the histopathological changes in the spleen and ankle joint of CIA rats were significantly improved with GCFZD treated. The safranine o-fast green staining showed that GCFZD could reduce the cartilage tissue destruction and repaired cartilage structure. TUNEL staining results indicated that GCFZD could significantly inhibit joint tissue pyroptosis. Western blot showed that TLR4, cleaved caspase-1, NLRP3 and GSDMD-N were decreased in spleen of CIA rats in GCFZD treatment groups. Real-time PCR and ELISA results showed that the GCFZD decreased the mRNA and protein level expression of IL-1β and IL-6 while upregulating the mRNA and protein level expression of IL-10 in blood serum of CIA rats.GCFZD may inhibit GSDMD-mediated pyroptosis and decrease IL-1β and IL-6 secretion and promote IL-10 secretion, resulting in an effective reduction of rheumatoid arthritis symptoms in CIA rats.
Gancao-Fuzi Decoction; rheumatoid arthritis; gasdermin D; pyroptosis
R593.21; R363.2
A
10.3969/j.issn.1000-4718.2023.02.015
1000-4718(2023)02-0325-10
2022-09-07
2022-12-14
[基金项目]安徽省高校自然科学研究项目重点项目(No. KJ2020A0588);安徽省重点科研平台开放课题基金项目(No. KLICD-2022-Z5);蚌埠医学院研究生创新项目(No. Byycx21012、21058);安徽省大学生创新项目(No. S202110367076)
张小楠 Tel: 13609827842; E-mail: zhangxn@bbmc.edu.cn; 陈传好 Tel: 15212108484; E-mail: cch711124@bbmc.edu.cn
(责任编辑:宋延君,李淑媛)

