2型糖尿病患者高同型半胱氨酸血症与早期肾脏疾病的相关性
王 翠,林 昊,武萍萍,张雅丽,任 建,徐 婷,董国玉,宰国田
(南通大学附属南京江北医院 a.内分泌科;b.普外科,江苏 南京 210048)
近30年来,我国糖尿病患病率显著增加,目前我国18岁及以上人群糖尿病患病率为12.8%[1]。其中2型糖尿病(type 2 diabetes mellitus, T2DM)占总糖尿病患者的90%以上[2]。糖尿病肾脏疾病(diabetic kidney disease, DKD)是糖尿病最令人忧心的慢性微血管并发症之一[3],以肾小球基底膜增厚、肾小管和肾间质纤维化为主要病理表现[4]。临床表现为尿蛋白增多和肾功能下降(肾小球滤过率降低)[5],最终可引起肾功能衰竭,进而危及患者生命。目前我国约20%~40%的糖尿病患者合并DKD,DKD已成为慢性肾功能衰竭及终末期肾病的主要原因之一[5-7],且DKD已超过肾小球肾炎成为我国住院患者慢性肾脏病的首要病因[8]。因此早期发现及预防DKD至关重要。研究显示,同型半胱氨酸(homocysteine, Hcy)为反应性血管损伤性氨基酸[9],长期高Hcy可引起血管内皮细胞受损,从而引起微血管疾病的发生[10-11]。研究表明,高Hcy血症除了可作为肾功能损害的标志外,还可能在早期肾损伤中发挥致病作用[9-11]。本研究以南京江北医院306例T2DM患者为研究对象,探讨高Hcy血症与T2DM患者早期DKD的关系,以期及时干预,延缓疾病进展。
1 资料与方法
1.1病例选择 采用回顾性分析的方法,选取南京江北医院2020年10月至2022年6月收住的T2DM患者306例。纳入标准:①年龄≥18 岁;②符合T2DM诊断标准。排除标准:①伴有急慢性感染者; ②糖尿病急性代谢紊乱并发症者;③严重肝肾功能异常者;④恶性肿瘤患者;⑤妊娠期及哺乳期妇女。根据有无早期DKD分为单纯T2DM组(n=252)和早期DKD组(n=54)。本研究经本院伦理委员会批准,所有患者均知情同意且签署告知书。
1.2方法 由内分泌科医生详细问诊以收集患者的一般资料,包括年龄、性别、糖尿病病程等基本信息,目前吸烟、饮酒情况,高血压、脑梗死、心脏病等既往病史。测定所有研究对象的收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP)、身高、体重,并计算体质量指数(body mass index, BMI),BMI = 体重(kg) /身高(m2) 。所有研究对象均需空腹8 h以上,次日清晨采集肘前静脉血,采集1 h内立即进行低温离心,送至实验室进行检测。需检测的生化指标包括空腹血糖(fasting plasma glucose, FPG)、糖化血红蛋白(glycosylated hemoglobin, HbA1c)、甘油三酯(triglyceride, TG) 、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(ligh-density lipoprotein cholesterol,LDL-C)、Hcy, 使用全自动生化分析仪(AU-5821 Chemistry System, Beckman, USA)检测TG、TC、HDL-C、LDL-C。FPG使用葡萄糖氧化酶法检测(AU-5821 Chemistry System, Beckman, USA)。Hcy使用酶循环法检测(AU-5821 Chemistry System, Beckman, USA)。取清晨中断尿利用免疫比浊法(AU-5821 Chemistry System, Beckman, USA)检测尿微量白蛋白,利用氧化酶法(AU-5821 Chemistry System, Beckman, USA)检测尿肌酐,计算尿白蛋白/肌酐比值(urine albumin creatine ratio,UACR)。
早期DKD定义为UACR为30~300 mg/g[12-13]。血清Hcy > 15 μmol/L定义为高Hcy血症[14]。
2 结 果
2.1一般资料和实验室资料 单纯T2DM组252例,早期DKD组54例,T2DM患者的DKD患病率为17.6%。与单纯T2DM组相比,早期DKD组年龄较大、糖尿病病程较长、Hcy水平较高、高Hcy血症和高血压占比较大,差异有统计学意义(均P<0.05)。见表1。
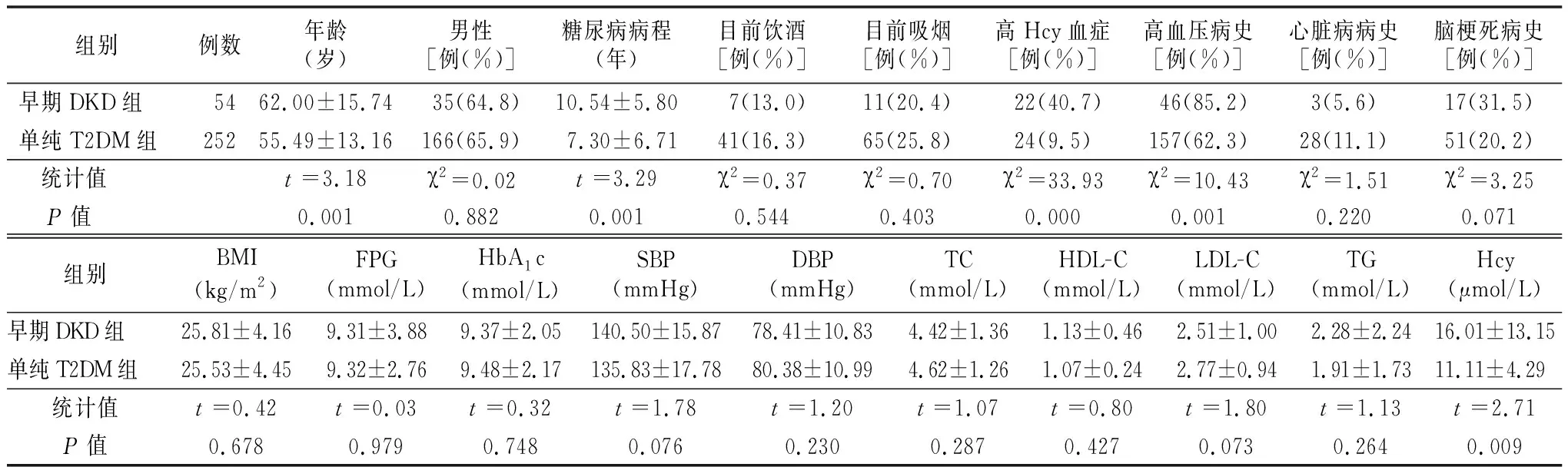
表1 两组一般资料和实验室资料比较
2.2Logistic回归分析 以 DKD为应变量(赋值:否=0,是=1),以高Hcy血症(赋值:否=0,是=1)、Hcy(赋值:实测值)、糖尿病病程(赋值:实测值)、年龄(赋值:实测值)、高血压病史(赋值:否=0,是=1)为自变量,进行多因素Logistic回归分析。结果发现,高Hcy血症、Hcy水平越高、糖尿病病程越长增加T2DM患者早期DKD患病风险,差异有统计学意义(均P<0.05)。见表2。
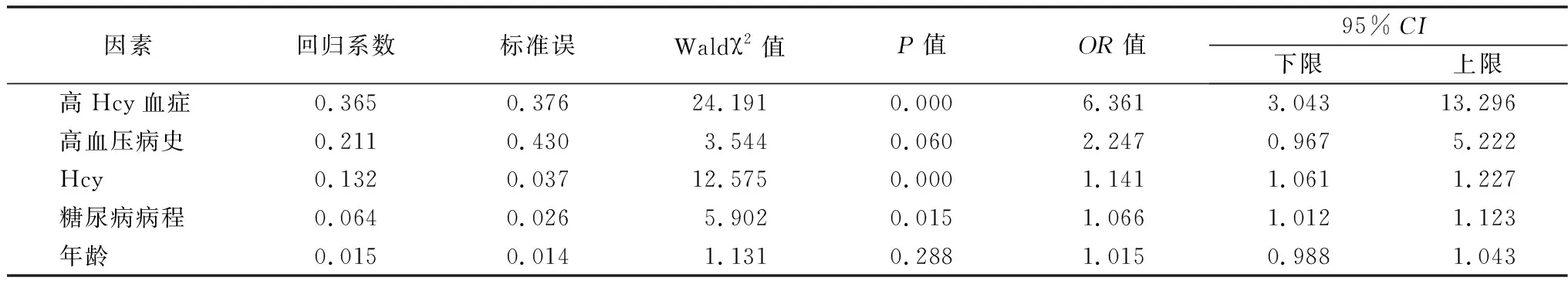
表2 T2DM患者早期DKD危险因素的Logistic回归分析
3 讨 论
Hcy是一种含硫氨基酸,主要来源于蛋氨酸,主要在肾脏和肝脏中合成, 70%在肾脏中代谢清除。随着研究的深入,Hcy被发现是T2DM患者DKD的早期预测因子及疾病进展的独立危险因素[15-19]。 Hcy可能通过诱导氧化应激直接损伤血管内皮细胞、促进血小板黏附与聚集、促进血管平滑肌细胞增生、诱导内质网应激损害肾脏足细胞、刺激肾脏单核细胞趋化蛋白-1的表达等途径加重肾功能衰竭,另外当肾功能减退后可引起肾脏细胞代谢异常,使与Hcy代谢相关的酶表达降低,Hcy水平进行性增加,形成恶性循环,使患者病情不断进展,严重影响预后[6, 20]。一项meat分析显示Hcy水平与DKD患病风险及严重程度相关,大量蛋白尿患者Hcy水平高于微量蛋白尿及无蛋白尿患者,且微量蛋白尿患者Hcy水平高于无蛋白尿患者[21]。李圣琦等[17]研究发现,与单纯T2DM患者相比,合并DKD者Hcy水平更高,且Hcy与24 h尿微量白蛋白水平呈正相关。另一项纳入1 107例中国T2DM住院患者的病例对照研究显示,Hcy水平每增加5 μmol/L,DKD的患病风险增加约4倍[18]。目前国内较多研究显示,早期DKD患者体内Hcy水平显著高于T2DM患者,提示 Hcy可作为早期DKD的预测因子[22-24], 但关于高Hcy血症与T2DM早期DKD患病风险相关性研究尚少。
本研究结果显示,早期DKD组Hcy水平高于单纯T2DM组(P<0.05),相较于单纯T2DM患者,高Hcy血症者早期DKD患病风险显著增加5.361倍左右(OR: 6.361, 95%CI: 3.043-13.296,P<0.05),并且患病风险与Hcy水平呈剂量-反应关系,Hcy水平每增加1 μmol/L,早期DKD患病风险增加14.1%左右(OR: 1.141, 95%CI: 1.061-1.227,P<0.05),与 Li等[25]研究结果相似。一项纳入183例中国T2DM患者的横断面研究显示,早期DKD患者Hcy水平显著高于对照组,且Hcy超过13.3 μmol/L者早期DKD患病风险增加67%左右,Hcy每增加4 μmol/L,早期DKD患病风险增加15%左右。高Hcy血症对早期DKD患病风险略有差异,这可能与种族差异及高Hcy血症定义不同有关。此外本研究发现,糖尿病病程与早期DKD患病风险增高有关,与Wu等[5]研究基本一致,并进一步发现病程与早期DKD患病风险之间亦存在剂量-反应关系,糖尿病病程每增加1年,早期DKD患病风险增加6.6%左右(OR: 1.066, 95%CI: 1.012-1.123,P<0.05)。
然而,本研究尚存在不足:①虽然本研究纳入的早期DKD组均为3~6个月内排除感染或应激等情况下,UACR检测结果3次中有2次达到或超出临界值,诊断真实可靠,但是样本量较小,未来可进一步扩大样本量;②本研究为单中心回顾性研究,未来需进行多中心前瞻性研究;③本研究中Hcy与UACR均采取单次测量值,可能存在偏差,后续可进行多次测量以减少偏差。
综上所述,T2DM患者高Hcy血症显著增加早期DKD患病风险,且Hcy水平与早期DKD患病风险增加呈剂量-反应关系。因此,对于T2DM患者,应规律监测并严格控制Hcy水平,以预防早期DKD的发生及发展。

