白细胞介素相关基因多态性与尘肺易感性系统评价与meta分析
郑 玲,苏晶莹,伍定辉,姚向阳
(1.福建医科大学第三临床医学院, 福建 福州 350000;2.厦门大学附属第一医院 肺科,福建 厦门 361003;3.厦门大学附属第一医院杏林分院 儿科,福建 厦门 361003)
尘肺病是一种在职业活动中长期吸入生产性矿物性粉尘并在肺内潴留而引起的以肺组织弥漫性纤维化为主的疾病[1],是目前我国职业病中最常见和危害最严重的疾病[1-2]。根据全国职业报告,我国职业性尘肺病新易感例2014年报告26 873例,2018年报告19 468例,2020年报告14 367例,分别占当年新发职业病病例总数89.66%、82.85%、84.19%,2020年因尘肺病死亡6 668例[3-5]。可见我国职业性尘肺病新易感例仍在全国各类职业病病例中居高不下。尘肺病早期可无明显症状,但晚期常常导致残疾甚至死亡。尘肺病的易感原因有很多,包括工作场所特征、宿主免疫反应和基因环境的相互作用等[6-7]。
近几年来,基因多态性与尘肺病易感性的研究越来受关注[8-10]。白细胞介素(interleukin,IL)是指在白细胞或免疫细胞间相互作用的一种细胞因子。细胞因子在广泛的生物过程中发挥作用,特别是在炎症和免疫反应中,是在接触二氧化硅和煤尘等矿物粉尘的人类中观察到的有毒和致病作用的重要介质[11]。许多研究表明,IL相关基因多态性与人类许多疾病包括肺结核[12-14]、恶性肿瘤[15-17]、哮喘[18-19]、类风湿性关节炎[20-21]、脓毒症[22-23]及尘肺[24-25]等的发生有关。近年来,有关研究对IL-1[26-27]、IL-17[24-25]等相关基因与尘肺易感的遗传易感性进行了相关探讨,然而研究结果尚存在争议。王炜等[28]曾对IL-1基因多态位点与尘肺病易感性进行系统评价,但该研究排除了少于3篇同时研究一个IL-1多态位点的文献,且仅对显性模型进行meta分析。郝艳星等[29]曾对IL-6基因-174C/G和-634C/G多态性与尘肺病易感性进行系统评价,但研究基因有限。目前关于IL相关基因与尘肺病易感风险的大样本量相关研究较少,本文将通过全面收集相关文献进行综合分析IL相关基因多态性与尘肺病的易感关联风险。
1 资料与方法
1.1文献检索策略
1.1.1计算机检索数据库 检索PubMed、the Cochrane Library、Embase、中国知网(CNKI)、WanFang Data、VIP、CBM等数据库,同时手工检索,并回溯纳入文献的参考文献,检索时间限定为建库至2022年1月8日。检索方式为主题词和自由词相结合。
1.1.2中文检索词 尘肺,矽肺,煤工尘肺,煤矽肺,石棉肺,肺尘埃沉着病,白介素,白细胞介素,IL,基因。以万方数据库为例检索式:(尘肺OR矽肺OR 煤工尘肺OR石棉肺OR煤矽肺OR肺尘埃沉着病)AND (白介素OR白细胞介素OR IL)AND 基因。
1.1.3英文检索词 “pneumoconiosis”、“Pneumoconiose”、“Bagassosis”、“coalworker pneumoconiosis”、“CWP”、“silicosis”、“asbestosis” 、“lung fibrosis”、“interleukins”、“cytokine”、“interleukin”、“IL”、“Polymorphism, Genetic”、“Genetic Polymorphism”、“Gene Polymorphism”、“Polymorphism, Gene”、“Polymorphism (Genetics)”。以PubMed为例检索式:(“pneumoconiosis”[MeSH Terms]) OR “Pneumoconiose”[All Fields]OR“Bagassosis”[All Fields]OR“coalworker pneumoconiosis”[All Fields]OR“CWP”[All Fields]OR“silicosis ”[All Fields]OR“asbestosis”[All Fields]OR“lung fibrosis”[All Fields]AND(“interleukins”[MeSH Terms]) OR“cytokine”[All Fields]OR“interleukin”[All Fields]OR“IL”[All Fields]) AND(“Polymorphism, Genetic”[MeSH Terms]OR“Genetic Polymorphism”[All Fields]OR“Gene Polymorphism”[All Fields]OR“Polymorphism, Gene”[All Fields]OR“Polymorphism (Genetics)”[All Fields])。
1.2文献筛选标准
1.2.1文献纳入标准 (1)研究类型为病例对照研究;(2)研究的病例组均为尘肺人群,均符合尘肺诊断标准,对照组为接触职业性粉尘的健康人群;(3)研究给出明确的病例组样本量和对照组样本量;(4)研究的指标为IL相关基因,从文献中可直接或间接获得不同基因型、等位基因的分布数据;(5)研究语种为中英文。
1.2.2文献排除标准 (1)合并其他疾病:如近期感染、免疫系统疾病、遗传代谢疾病等的患者;(2)研究数据无法完整获取的文献;(3)重复发表的文献或数据;(4)综述等二手文献、个案报告。
1.3文献筛选、资料提取与质量评价
1.3.1文献筛选 由郑玲和苏晶莹分别独立完成文献筛选、资料提取和文献质量评价,并交由伍定辉主任医师核对,出现意见分歧时共同协商讨论解决或由主任医师分析判定。通过阅读文献标题和摘要排除明显不符的文献,再对初筛后的文献通过阅读全文进一步排查。
1.3.2文献资料提取 纳入文献的提取资料包括:(1)一般资料:第一作者、发表年份、尘肺种类、国家、种族、样本量(病例组/对照组)、检测的单核苷酸多态性(SNPs)、基因检测方法、病例组的年龄和接尘时间、对照组的年龄和接尘时间等。(2)结局测量指标:病例组和对照组的各基因型数和等位基因数。
1.3.3文献质量评价 由郑玲和苏晶莹参照遗传关联性研究报告规范行质量评价[30]以及依据文献[31]选取的14条标准对遗传关联性研究进行质量评价, 以“是”(满足标准) 、“否”(不满足标准) 和“不清楚”(文献未描述) 进行文献质量评价。由2名评价员独立完成,意见不统一时,与伍定辉主任医师或姚向阳主任医师共同讨论,直到达成一致意见。
1.4统计学方法 应用Review Manager 5.2以及Stata 14.0软件进行统计学数据分析。关联强度用风险比(odds ratio,OR)表示,效应量用点估计及其95%可信区间(confidence intervals,CI)表示;异质性分析采用Q检验与I2检验判断,若I2≤50%,表示无统计学上异质性,采用固定效应模型;若I2>50%,表示存在统计学上异质性,则进一步分析异质性来源,在排除明显临床异质性的影响后,采用随机效应模型。明显的临床异质性采用亚组分析、敏感性分析或meta回归分析等方法进行处理。采用漏斗图、Egger’s法检验分析评估文献的发表偏倚。以P<0.05为差异有统计学意义。
2 结 果
2.1文献检索结果 初步检索获得1 486篇相关文献,102篇文献进入全文阅读筛选,最终29篇文献[24-27,32-56]共包含33组数据符合纳入和排除标准进入本研究。共计病例组5 315例,对照组5 332例。中国人群的研究20篇[24, 26-27, 32-41, 46-47, 52-56], 国外人群的研究为9篇[25, 42-45, 48-51]。其中矽肺研究16项[25-27, 32, 34, 38-41, 47-51, 54, 56],煤工尘肺研究14项[27,32, 34-37, 39, 42-44, 46, 52-53, 55],煤矽肺研究1项[45],尘肺未分类研究2项[24, 33]。文献筛选流程情况见图1, 纳入文献基本情况见表1。同一个基因位点有2项及以上研究数据时纳入meta分析,仅有单项数据报告时不能进行meta分析。纳入meta分析文献中各基因位点的基因型分布见表2。其他有29种IL基因仅有单篇文献研究,各基因型分布见表1。
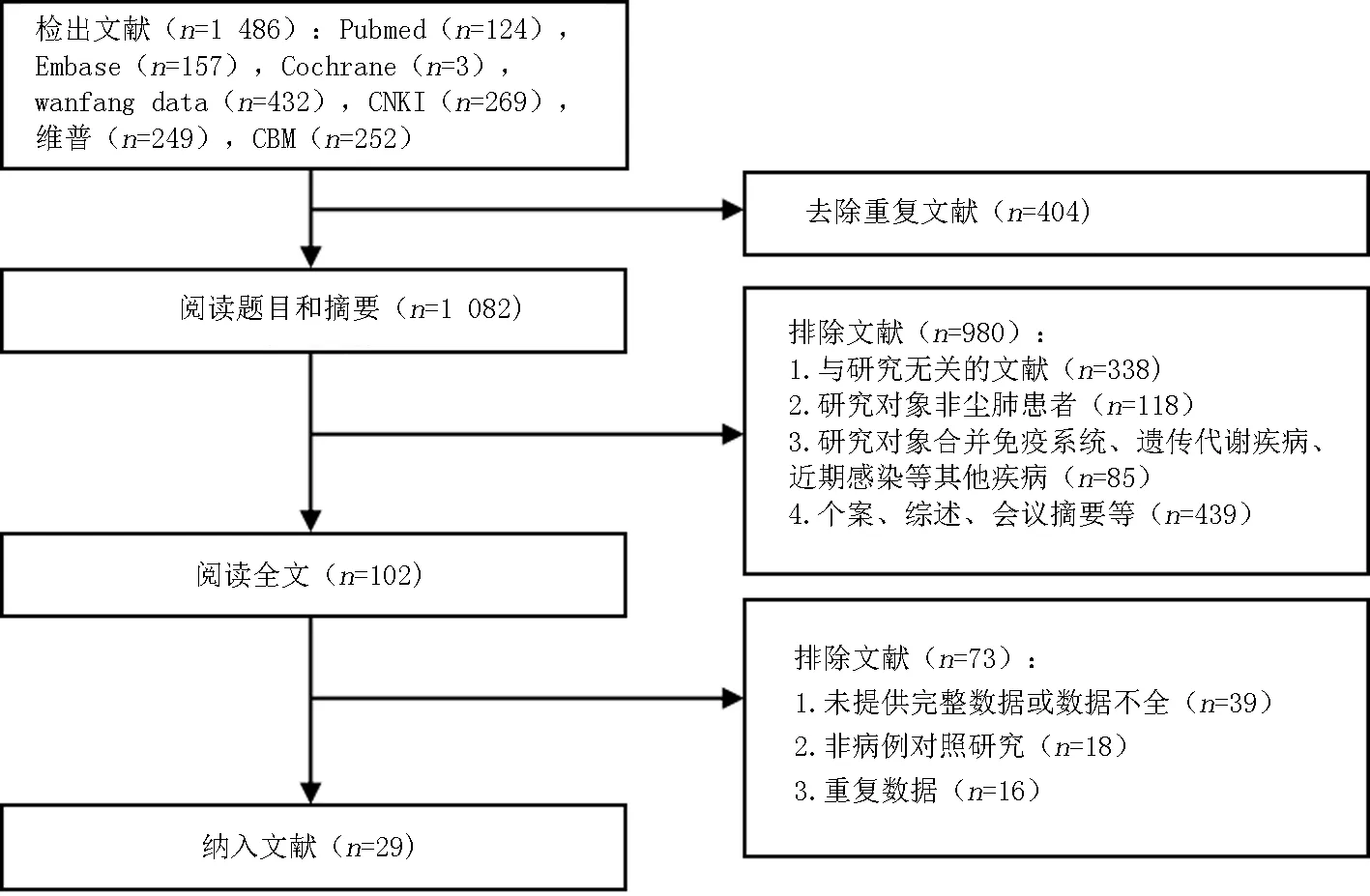
图1 文献筛选流程图
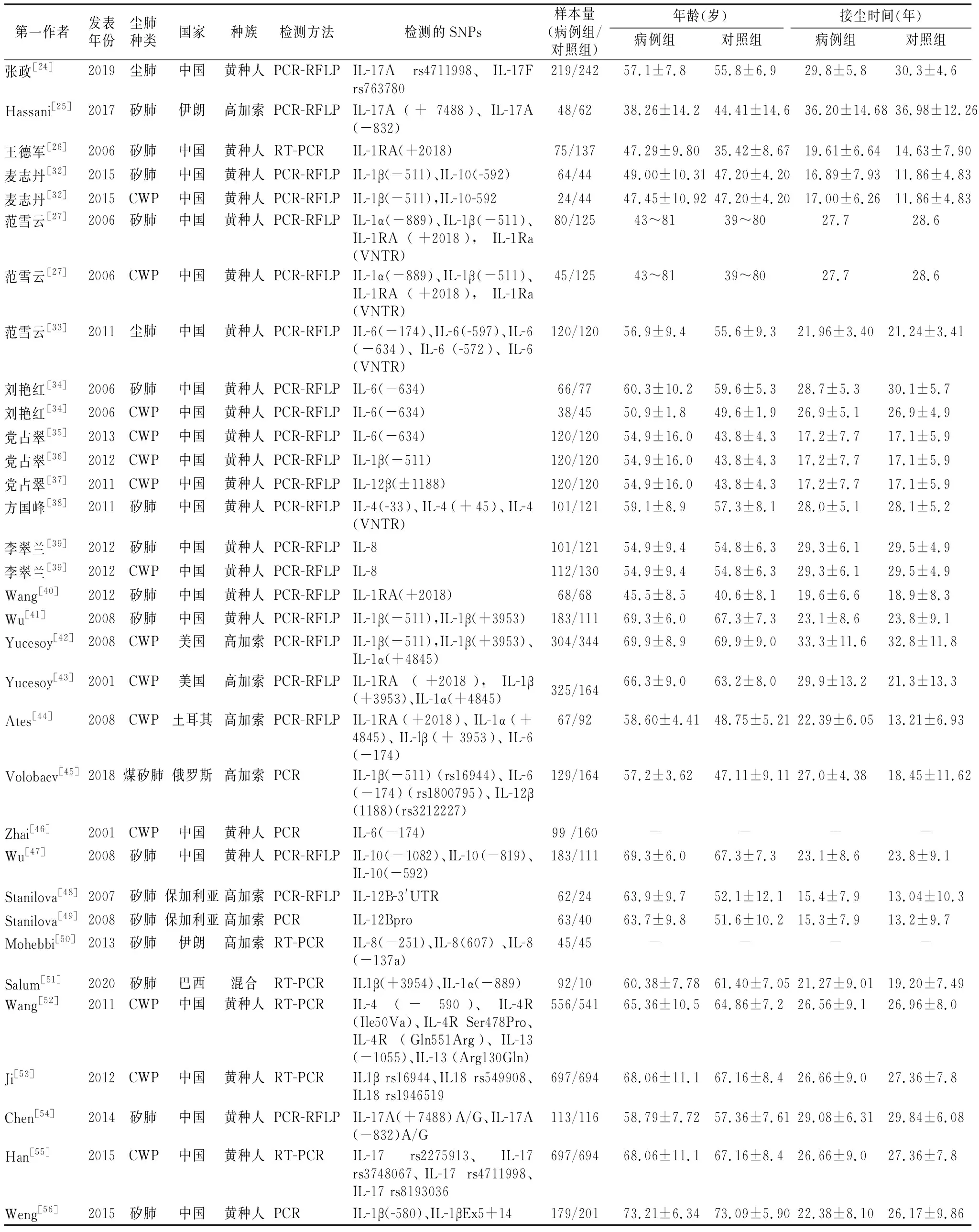
表1 纳入研究基本情况表
2.2文献质量评价结果 29篇纳入文献[24-27, 32-56]未进行计算把握度、连锁不平衡检测、计算错误率、多重检验校正、重复性以及功能验证性试验;29篇文献均未描述是否采用盲法,所有病例组和对照组均来自同一人群,同时描述了病例组人口学及临床信息。9篇文献[25, 27, 32-34, 38-39, 43, 56]未提及HWE检验情况,其余文献均符合HW平衡检测。18篇文献[25-26, 32, 34-38, 40-41, 43, 45, 47, 52-56]进行了多态性的鉴定,18篇文献[25, 40-56]描述了人群分层分析。见图2。
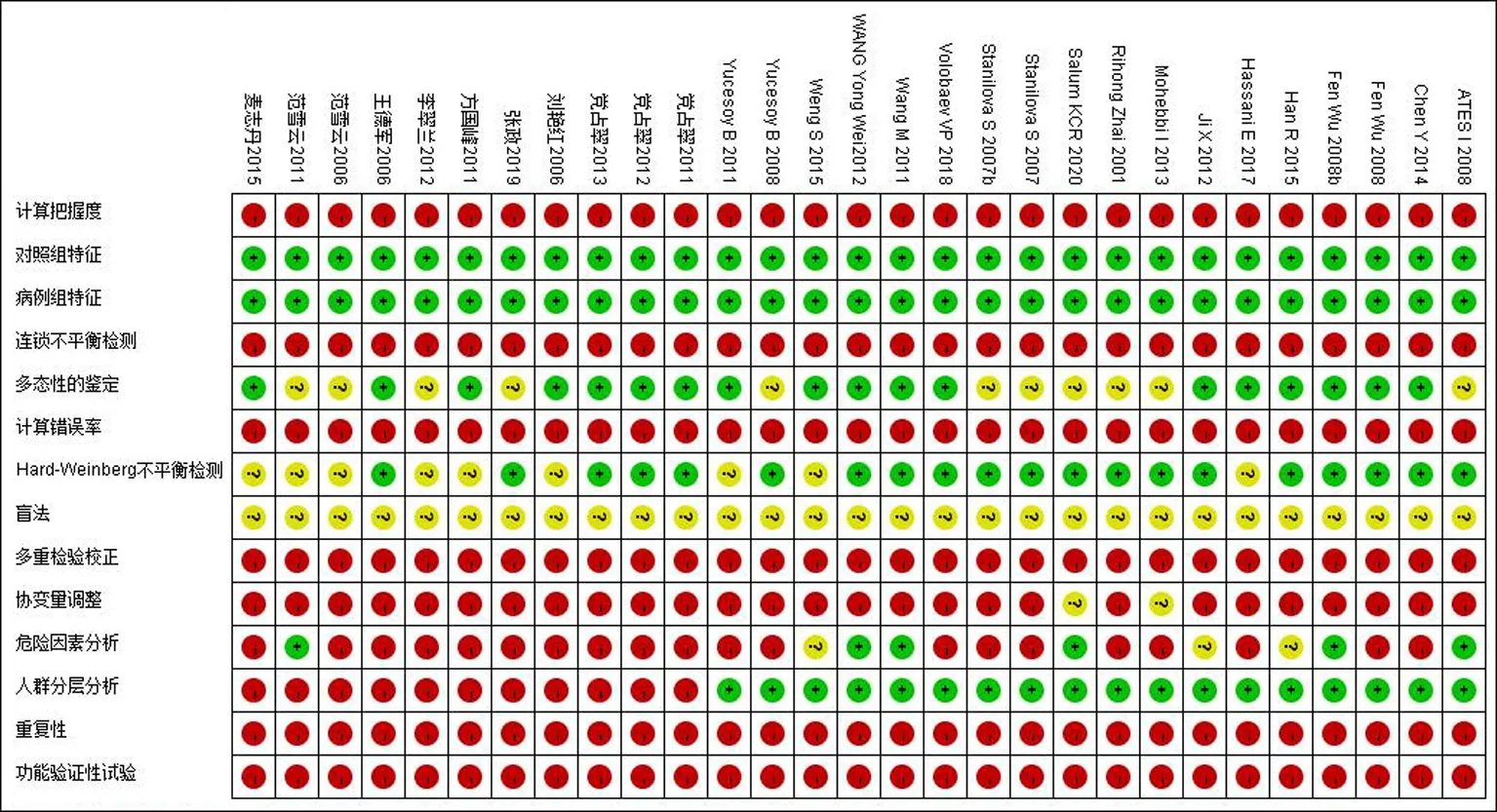
图2 29篇纳入文献的偏倚风险评价
2.3Meta分析结果 本研究对17种IL相关基因分别采用等位基因模型、显性模型、隐性模型、共显性模型、超显性模型等进行meta分析探讨其与尘肺易感性的相关性。
2.3.1IL-1β(-511)C/T多态位点与尘肺易感性的关联 29篇纳入文献[24-27,32-56]中有6篇文献[27, 32, 36, 41-42, 45]包括8组数据提供了IL-1β(-511)C/T多态位点的各基因型和等位基因,包括病例组949例,对照组1 051例。对各基因模型数据进行异质性检验,I2>50%时说明存在明显异质性,采用随机效应模型,I2<50%,无明显异质性,采用固定效应模型。Meta分析结果见表3。对各基因模型进一步行敏感性分析,隐性模型(CC+CT vs TT)和共显性模型(TT vs CC)分别剔除Volobaev等[45]等的研究后,异质性检验I2分别降低为50.3%、62.8%, meta分析结果发生明显改变(OR=1.36, 95%CI=0.97~1.92,P=0.079)、(OR=1.43, 95%CI=0.89~2.31,P=0.137),剔除其他研究meta分析结果明显改变。而其他模型,剔除任意一项研究对meta分析结果无明显改变。对各基因模型进一步回归分析显示,尘肺种类、种族P值均<0.05,可能是异质性来源。
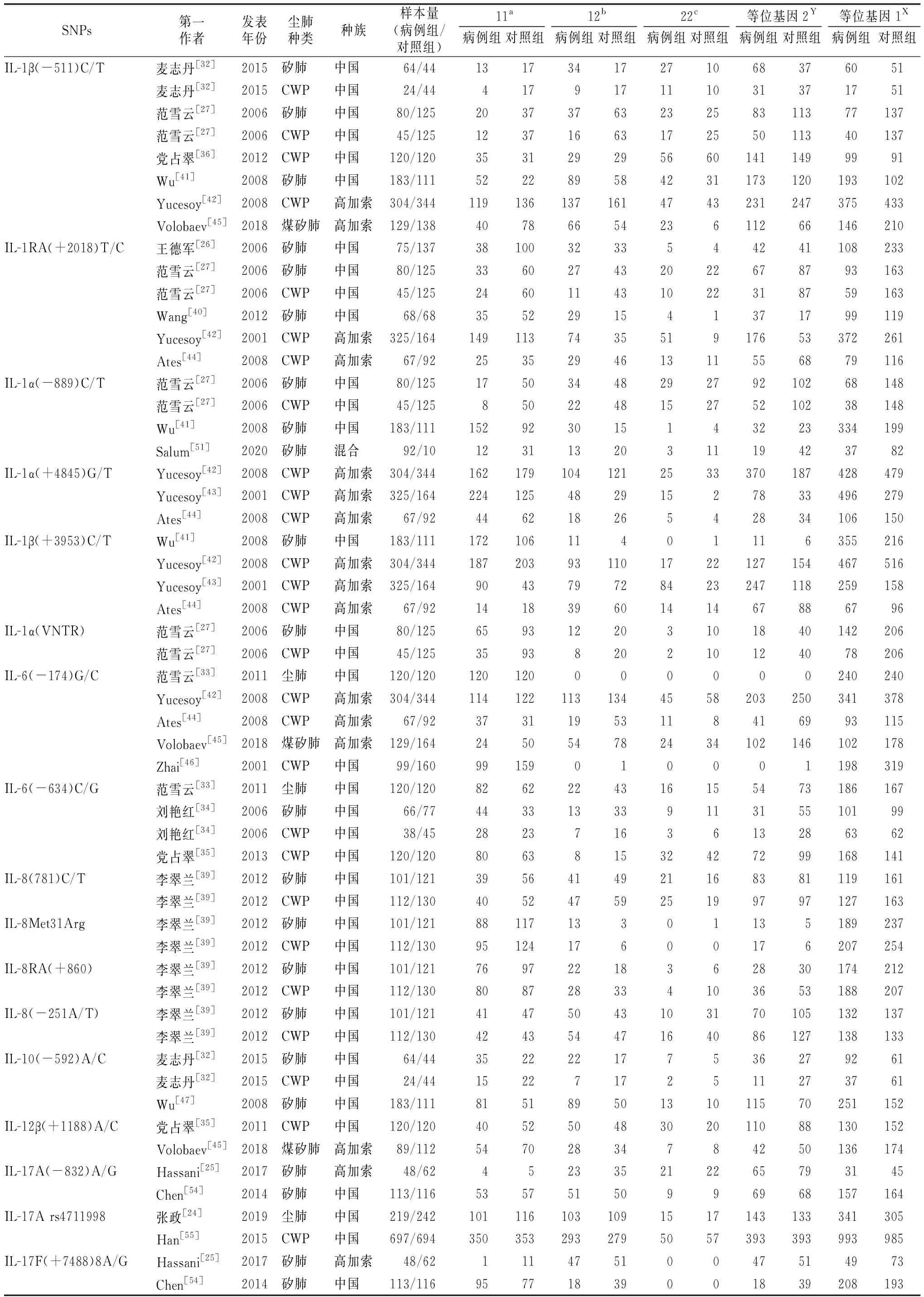
表2 纳入meta分析文献的IL基因多态位点的基因型分布汇总
2.3.2IL-1RA(+2018)T/C多态位点与尘肺易感性的关联 5篇文献[26-27,40, 43-44]包括6组数据提供了IL-1RA(+2018)T/C多态位点的各基因型和等位基因,包括病例组660例,对照组711例。对各基因模型数据进行异质性检验,I2>50%时说明存在明显异质性,采用随机效应模型,I2<50%,无明显异质性,采用固定效应模型。Meta分析结果见表4。对各基因模型进一步行敏感性分析,剔除任意一项研究对meta分析结果无明显改变。进一步回归分析显示,除共显性模型、显性模型外,其余模型显示尘肺种类、种族P值均<0.05,提示尘肺种类、种族可能为异质性来源。

表3 IL-1β(-511)C/T多态性与尘肺易感性的meta分析和亚组分析结果
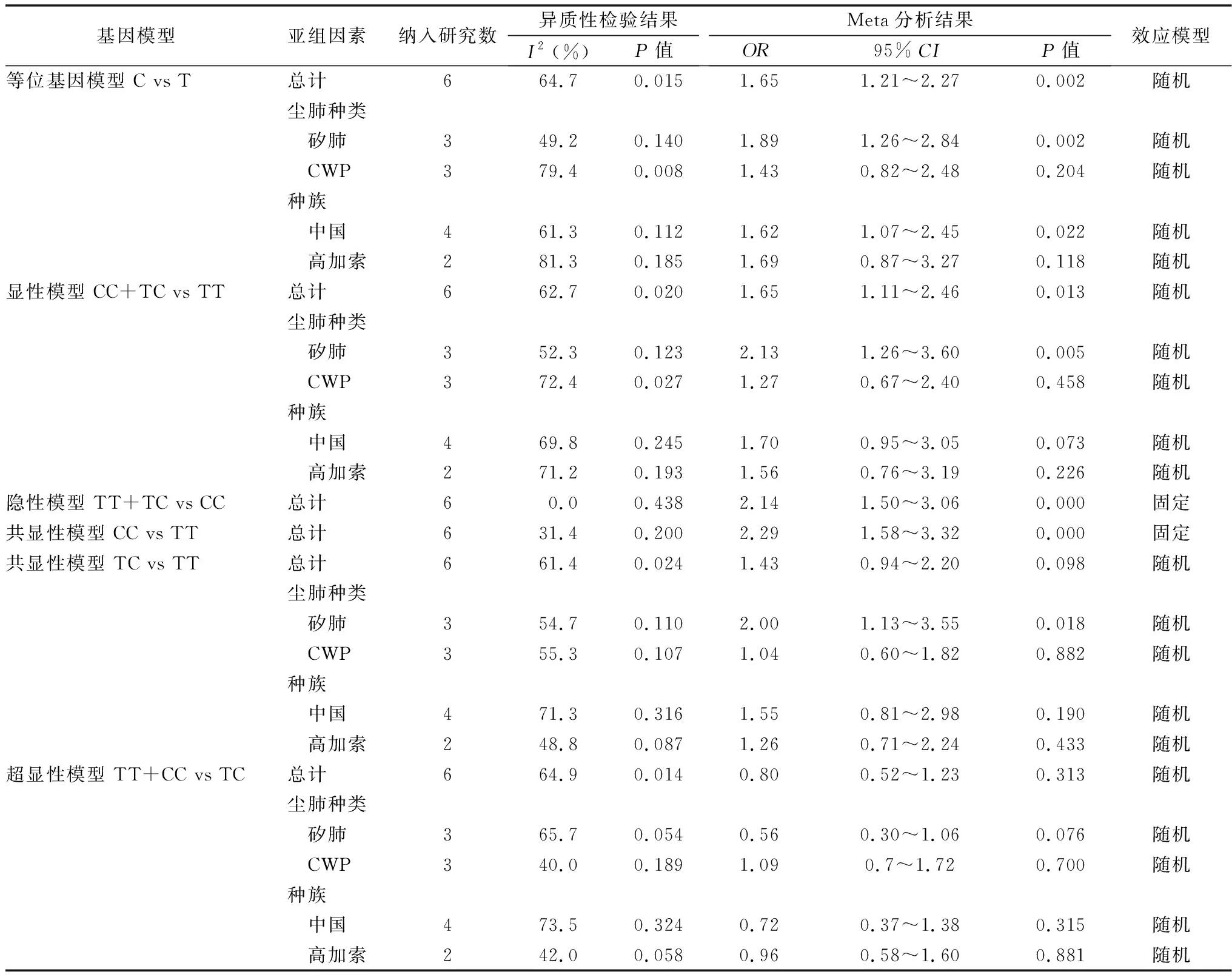
表4 IL-1RA(+2018)T/C多态性与尘肺易感性的meta分析和亚组分析结果
2.3.3IL-1α(-889)C/T多态位点与尘肺易感性的关联 3篇文献[27, 41, 51]包括4组数据提供了IL-1α(-889)C/T多态位点的各基因型和等位基因,包括病例组400例,对照组371例。对各基因模型数据进行异质性检验,I2>50%时说明存在明显异质性,采用随机效应模型,I2<50%无明显异质性,采用固定效应模型。Meta分析结果见表5。对异质性较高的基因模型进行回归分析,尘肺种类、种族P值均>0.05,未找到异质性来源。进一步行敏感性分析,剔除任意一项研究对meta分析结果无明显改变。
2.3.4IL-1α(+4845)G/T多态位点与尘肺易感性的关联 3篇文献[42-44]包括3组数据提供了IL-1α(+4845)G/T多态位点的各基因型和等位基因,包括病例组696例,对照组600例。对各基因模型数据进行异质性检验,I2>50%时说明存在明显异质性,采用随机效应模型,I2<50%,无明显异质性,采用固定效应模型。Meta分析结果见表2。
2.3.5IL-1β(+3953)C/T多态位点与尘肺易感性的关联 4篇文献[41-44]包括4组数据提供了IL-1β(+3953)C/T多态位点的各基因型和等位基因,包括病例组879例,对照组 711例。对各基因模型数据进行异质性检验,I2>50%时说明存在明显异质性,采用随机效应模型,I2<50%,无明显异质性,采用固定效应模型。Meta分析结果见表6。对于异质性较高的基因模型进一步回归分析,尘肺种类、种族P值均>0.05,未找到异质性来源。进一步敏感性分析,剔除任意一项研究对meta分析结果无明显改变。
2.3.6IL-6(-174)G/C多态位点与尘肺易感性的关联 5篇文献[33, 42, 44-46]包括5组数据提供了IL-6(-174)G/C多态位点的各基因型和等位基因,包括病例组719例,对照组880例。对各基因模型数据进行异质性检验,I2>50%时说明存在明显异质性,采用随机效应模型,I2<50%,无明显异质性,采用固定效应模型。Meta分析结果见表7。对异质性较高的基因模型进一步回归分析显示,尘肺种类、种族P值均<0.05,未找到异质性来源。进一步敏感性分析,共显性模型(GC vs GG) 分析中剔除Volobaev等[45]的研究后,meta分析结果发生明显改变(OR=0.72, 95%CI=0.52~0.98,P=0.079),而逐一剔除任意一项研究,其他基因模型的meta分析结果无明显改变。
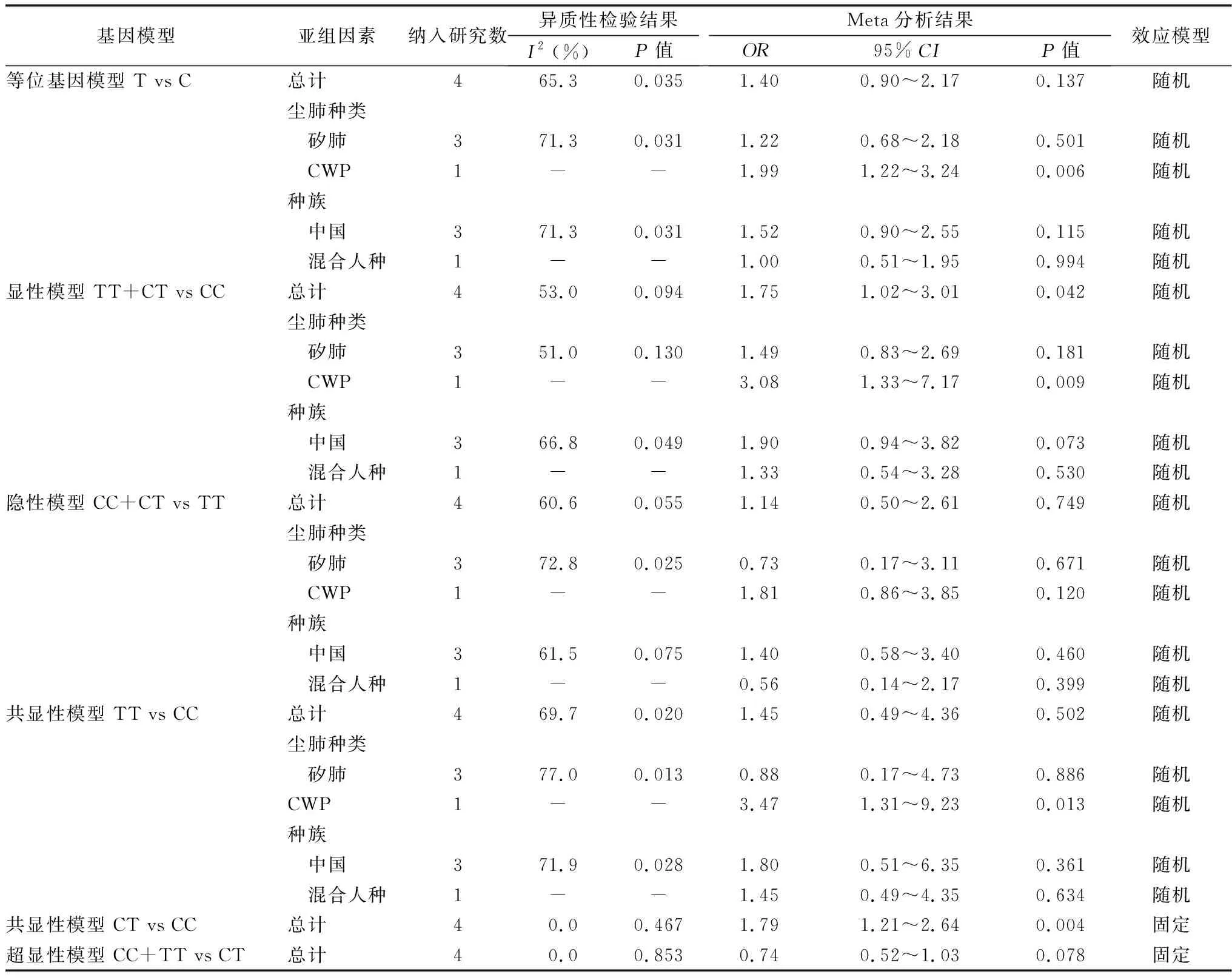
表5 IL-1α(-889)C/T多态性与尘肺易感性的meta分析和亚组分析结果
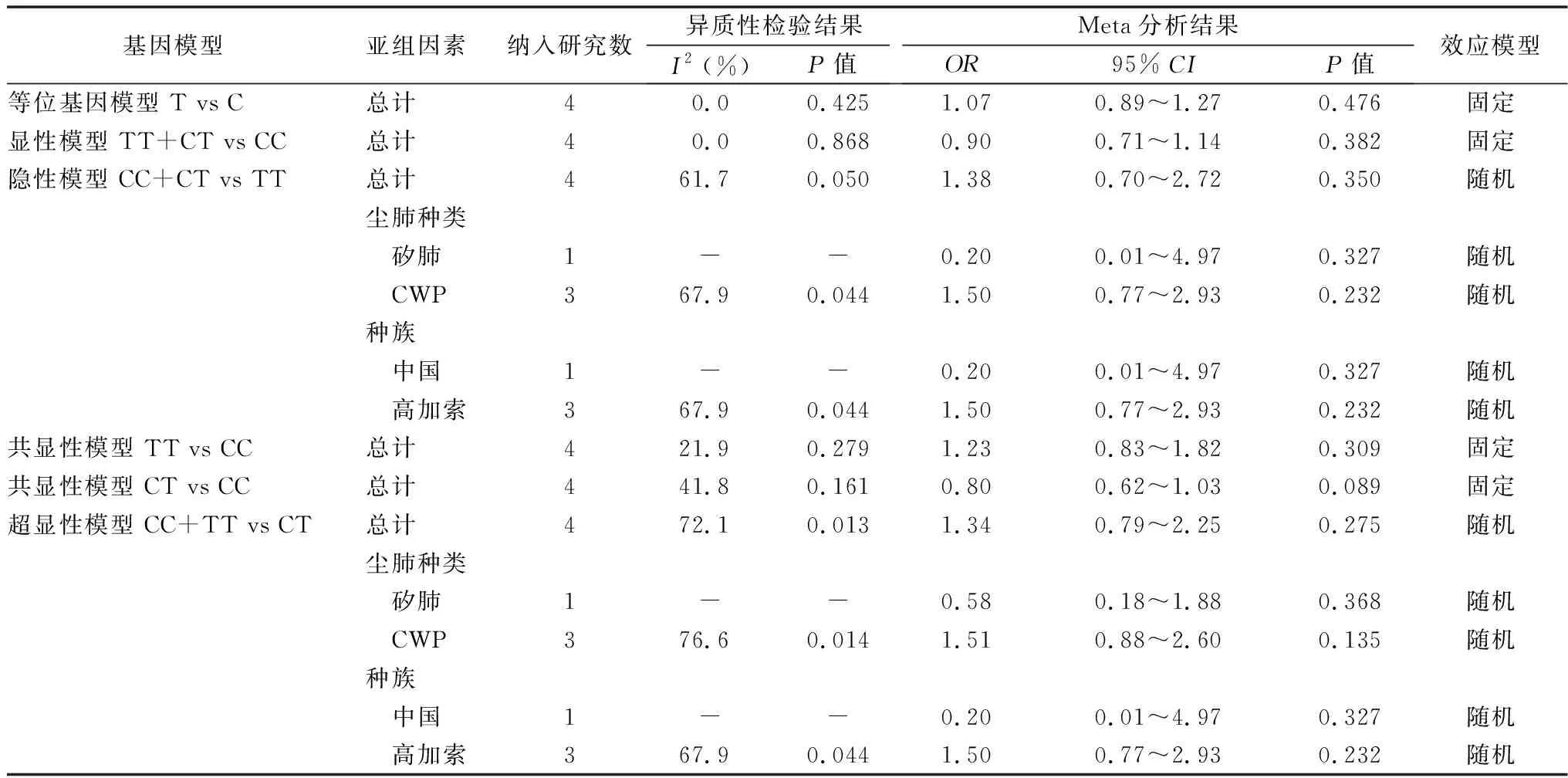
表6 IL-1β(+3953)C/T多态性与尘肺易感性的meta分析和亚组分析结果

表7 IL-6(-174)G/C多态性与尘肺易感性的meta分析和亚组分析结果
2.3.7IL-6(-634)C/G多态位点与尘肺易感性的关联 有3篇文献[33-35]包括4组数据提供了IL-6(-634)C/G多态位点的各基因型和等位基因,包括病例组344例,对照组362例。对各基因模型数据进行异质性检验,I2>50%时说明存在明显异质性,采用随机效应模型,I2<50%,无明显异质性,采用固定效应模型。Meta分析结果见表3。
2.3.8其他基因多态位点与尘肺易感性的关联 1篇文献[27]包括2组数据提供了IL-1α VNTR多态位点的各基因型和等位基因,包括病例组125例,对照组125例。1篇文献[39]包括2组数据提供了IL-8(781)C/T、IL-8 Met31Arg T/G、IL-8RA(+860)G/C、IL-8(-251)A/T多态位点的各基因型和等位基因,包括病例组213例,对照组251例。2篇文献[32, 47]包括3组数据提供了IL-10(-592)A/C多态位点的各基因型和等位基因,包括病例组271例,对照组199例。2篇文献[37, 45]包括2组数据提供了IL-12β(+1188)A/C多态位点的各基因型和等位基因,包括病例组209例,对照组232例。2篇文献[25, 54]包括2组数据提供了IL-17A(-832)A/G和IL-17F(+7488)A/G多态位点的各基因型和等位基因,包括病例组161例,对照组178例。2篇文献[24, 55]包括2组数据提供了IL-17A rs4711998 A/G多态位点的各基因型和等位基因,包括病例组916例,对照组936例。对各基因模型数据进行异质性检验,I2>50%时说明存在明显异质性,采用随机效应模型,I2<50%,无明显异质性,采用固定效应模型。Meta分析结果见表4。
2.3.9发表偏倚 对纳入研究≥4项的各基因位点不同基因模型进行发表偏倚检测,IL-1β(-511)C/T隐性模型漏斗图不对称,显示可能存在发表偏倚, Egger法检验进一步分析显示,t=3.33,P=0.016,均显示发表偏倚可能性大,对其进行剪补法结果显示,剪补前后合并效应值和P值无明显变化,说明此meta分析结论相对稳定;其余研究漏斗图大致对称,Egger检验P值大于0.05,显示发表偏倚可能性小。见图3。

图3 IL-1β(-511)C/T隐性模型与尘肺易感关联的发表偏倚 a.漏斗图;b. Egger图;c. 剪补法图
3 讨 论
尘肺病是一种肺纤维化疾病,按照《职业病分类和目录》,主要包括矽肺、煤工尘肺、石墨尘肺、炭黑尘肺、石棉肺、滑石尘肺,水泥尘肺、云母尘肺、陶工尘肺、铝尘肺、电焊工尘肺、铸工尘肺等十二种[5]。其中矽肺和煤工尘肺是我国最常见的尘肺种类。尘肺病发生大多需要10~20年甚至更长的接尘工龄,且脱离粉尘接触后仍然可以易感,一旦易感,将难以治愈,给个人和社会造成严重的经济负担[5, 57]。尘肺病是可防可控的疾病[5]。尘肺的发生发展及病变程度主要受工人接触粉尘的种类、浓度、分散度、工龄、个体因素、以及防护措施的影响[58]。虽然职业粉尘暴露是尘肺易感的首要因素,但尘肺易感并不完全取决于粉尘暴露,据报道,遗传在尘肺的病因和易感机制中起着重要作用[59-61]。近年来,基因多态性与尘肺病易感风险的相关研究越来越多,包括IL[24-27,32-56]、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)[62]、转化生长因子-β(transforming growth factor box1,TGF-β)[63]、高迁移率族蛋白 B1 (high mobility group box-1 protein,HMGB-1)[64]、基质金属蛋白酶(matrix metalloproteinases,MMP-2)[65]、热休克蛋白70(heat shock protein,HSP70)[66]、免疫相关鸟苷三磷酸酶 M(immunity related GTPase M,IRGM)[67]等。IL属于细胞因子,是一种具有重要的免疫调节的炎症介质,在参与肺纤维化中扮演重要角色。IL-1在尘肺发生过程中主要刺激成纤维细胞,促使其分泌胶原及胶原酶,并且可以调节免疫介导的肺损伤[68]。矽尘导致矽肺的易感进程中肺泡巨噬细胞、T细胞等通过IL-4Ra通道发挥免疫功能[69],IL-4在尘肺易感中起重要作用。IL-8 是一种白细胞趋化因子,通过趋化作用使炎症细胞向肺组织迁移并释放活性物质参与肺纤维化,可作为单独的细胞因子对肺纤维化发挥作用[70]。目前研究与尘肺易感相关的IL基因主要有:IL-1、IL-4、IL-6、IL-8、IL-10、IL-12、IL-13、IL-17、IL-18等[24-27,32-56,68]。王炜等[28]曾对IL-1基因多态位点与尘肺病易感性进行系统评价和meta分析,但该研究仅对一种基因模型进行分析,不够全面。本文通过全面搜索目前已发表的IL相关基因与尘肺病易感风险的相关研究,以多种遗传基因模型进行进行综合分析,结果可能更加全面可靠。
本文纳入29篇关于IL相关基因多态位点与尘肺易感的病例对照设计研究,包括33组数据,共计病例组5 315例,对照组5 332例。中国人群的研究20篇[24,26-27,32-41, 46-47,52-56], 国外人群的研究为9篇[25,42-45, 48-51]。除了Salum等[51]研究为混合人种以外,其他国外研究的人群均为高加索人种。王炜等[28]曾对IL-1相关基因进行了meta分析研究结果显示,IL-1β(-511)C/T、IL-1α(+4845)G/T等多态位点与矽肺及煤工尘肺的易感无明显关联。但本研究meta分析发现,IL-1β(-511)C/T、IL-1α(+4845)G/T等多态位点可能与尘肺病的易感风险有关。本研究纳入的6篇[27, 32, 36, 41-42, 45]有关IL-1β(-511)C/T多态位点与尘肺病易感的研究meta分析显示,隐性模型(CC+CT vs TT)、共显性模型(TT vs CC)均提示IL-1β(-511)C/T多态位点可能增加尘肺病的发生风险,这与范雪云等[27]、Volobaev等[45]的研究结果一致,与王炜等[28]及大多数研究[32, 36, 41-42]结果不一致。结合尘肺种类的亚组分析结果,剔除Volobaev等[45]的研究后,meta分析结果发生明显改变,提示Volobaev等[45]研究的煤矽肺种类可能为异质性来源。因煤矽肺研究只有1篇,样本量有限,对本研究产生了局限性。而等位基因模型(T vs C)、显性模型(TT+CT vs CC)、共显性模型(CT vs CC)、超显性模型(CC+TT vs CT)等遗传模式分析结果均提示IL-1β(-511)C/T多态位点可能与尘肺病的易感性无关联,这与大多数研究结果一致[28,32, 36, 41-42]。本研究纳入的3项有关IL-1α(+4845)G/T多态位点与尘肺病易感的等位基因模型(T vs G)分析结果提示等位基因T可能会增加尘肺病的易感风险,虽其异质性高,但3项研究均为高加索人种煤工尘肺,且研究较少,无法进行亚组分析[42-44]。由于研究数和样本量少,对研究结果的可靠性有待未来更多相关研究进一步证实。因此,结合多种遗传模型的分析结果,提示IL-1β(-511)C/T、IL-1α(+4845)G/T等多态位点与尘肺病的易感风险可能有关。本研究结果显示IL-1RA(+2018)T/C多态位点中,带TC或CC基因型的个体可增加煤工尘肺或矽肺的易感风险,同时等位基因模型(C vs T)、隐性模型(TT+TC vs CC)、共显性模型(CC vs TT)等的阳性结果更加证实了IL-1RA(+2018)T/C多态位点与尘肺病的易感风险相关,这与大多数研究结果一致[26,28,40, 43,71]。此外,高加索人种IL-1RA(+2018)T/C多态位点与尘肺易感风险无关,但是该位点可增加矽肺或中国人群的尘肺病易感风险,这提示尘肺种类和种族可能是临床异质性来源。IL-1α(-889)C/T多态位点的显性模型(TT+TC vs CC)、共显性模型(TC vs CC) 均提示携带TC基因型可能增加尘肺病的易感风险,这与范雪云等[27]研究结果一致,但与Wu等[41]、Salum等[51]研究结果不一致。本研究亚组分析表明携带TC基因型能增加煤工尘肺的易感风险,携带TC基因型不能增加矽肺的易感风险,提示尘肺种类可能是其临床异质性来源。
IL-6是机体重要的免疫-神经-内分泌调节因子,既可以通过诱导胶原合成又可以抑制胶原降解从而影响尘肺发生发展[68]。本研究中IL-6(-174)G/C多态位点各遗传基因模型与尘肺病的易感风险无关,这与大多数研究结果一致[29,33, 42, 44-46]。相比于郝艳星等[29]的研究结果,本研究显示除了等位基因模型、显性模型和超显性模型提示IL-6(-634)C/G多态位点可能与尘肺病易感有关外,共显性模型(GG vs CC) 、共显性模型(CG vs CC)也提示CC基因型可能增加尘肺的易感风险,等位基因C可能为尘肺等位基因的风险因素,而等位基因G可能为尘肺病的保护因素。Chen 等[54]研究发现,IL-17F 7488A/G与矽肺易感性有关,G等位基因可能具有保护作用。但本研究分析显示IL-17F(+7488)A/G多态性与矽肺的易感风险可能无关,这与Hassani 等[25]研究一致。IL-8(781)C/T、IL-8 Met31Arg T/G多态性可能增加尘肺病的易感风险,IL-8(-251)A/T多态性可能降低尘肺病的易感风险。IL-1α(VNTR)、IL-8RA(+860)G/C、IL-10(-592)A/C、IL-12β(+1188)A/C、IL-17A(-832)A/G、IL-17A rs4711998 A/G、IL-17F(+7488)A/G等IL相关基因多态性的研究均未发现与尘肺病的易感风险有关。而其他如Wang 等[52]研究发现IL-4C -590 T的功能性多态性与中国黄种人群煤工尘肺的易感风险降低相关;Han 等[55]研究发现,IL-17 rs3748067 G>A和rs8193036 C>T多态性降低了煤工尘肺易感风险等。由于这些基因多数仅有单篇文献报告,缺乏多中心数据,证据等级相对不足,期待未来有更多相关研究进一步探讨分析。
本文部分纳入研究的异质性较高,未能找到异质性来源。遗传基因关联性研究异质性来源可能是种族、民族、对照组来源、基因分型检测方法,疾病表型、样本量等等。本文仅对尘肺种类、种族进行亚组分析,由于纳入研究较少,总体样本量相对不多等种种局限性,未能进一步对民族、基因分型检测方法、样本量等进一步亚组分析。因此,本meta分析结果的异质性来源可能与临床多种因素相关,期待未来有更多相关研究、更大样本量,以及更好的研究设计,以进一步探讨IL相关基因与尘肺易感关联性。
IL-1RA(+2018)T/C多态位点与尘肺的易感风险显著相关,等位基因C可能是尘肺发病的风险基因,携带CC或CT基因型可能会增加尘肺的发病风险,对矽肺的发病风险可能更为显著。IL-6(-634)C/G多态位点与尘肺的易感风险有关,等位基因C可能是尘肺发病的风险基因,突变等位基因G可能为尘肺的保护因素,携带GG或GC基因型可能会减少尘肺的发病风险。IL-1β(+3953)C/T、IL-6(-174)G/C多态位点与尘肺病的易感风险无关联。IL-1α(+4845)G/T多态位点与尘肺病的易感风险可能有关,等位基因T可能是尘肺发病的风险基因;IL-1β(-511)C/T多态位点与煤矽肺的易感风险可能有关;IL-1α(-889)C/T 多态位点与煤工尘肺的易感风险可能有关;IL-8(781)C/T、 IL-8 Met31Arg T/G、IL-8(-251)A/T多态性与尘肺的易感风险可能有关,需要更多相关研究进一步证实,期待后续多中心大样本量、以及更好的研究设计进一步探讨分析遗传基因多态位点与尘肺易感性关联。

