海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶的研究
于晓婷,陈晓艺,李 苗,王淑婧,王添誉,李 佥,李宪臻
(大连工业大学 生物工程学院,辽宁 大连 116034)
酶是一种生物催化剂,因其拥有绿色、环保和可持续发展的优势而受到广泛关注。但是,由于其物理和化学特性的不稳定,使得在实际使用中不能长时间维持其催化活性,因而不能充分发挥其催化作用[1]。酶固定化技术是通过采用合适的固定化工艺,将游离酶固定到易于循环利用的载体上,固定化材料、制备方法、酶用量以及固定化条件等皆会影响酶的固定化效果[2]。
从1910 年开始,随着新型固定化载体的不断涌现,固定化酶领域发展迅速。载体通常需要根据固定化酶的应用要求进行选择[3]。固定化酶常用的载体可以分为以下4 类:无机载体(二氧化硅、活性炭等[4])、天然有机物(纤维素、壳聚糖、海藻酸钠等[5-6])、合成高分子材料(环氧树脂、聚丙烯腈膜等[7])和复合载体(有机物质与无机物质混合构成的载体,例如磁性复合微球等[8])。常用的固定化酶方法有以下几种:1)吸附法是指通过范德华力作用,酶和载体进行结合,但是这样的力常常不是很强,造成酶和载体之间反应不够牢固,在使用时,酶很容易脱落进入反应溶液中,造成回收困难[9]。2)交联法是通过两种或多种功能的交联剂,将酶分子和载体连接起来的固定化方式。为了避免酶从载体上掉落,通常不单独使用交联法,而与包埋法或吸附法组合应用[10]。3)共价偶联法(又称为共价结合法)是通过在酶和载体之间形成共价键来固定酶的一种工艺。和其他方法相比,该方法反应条件较复杂,不仅在一定程度上会引起酶蛋白在空间上特定结构的变化,还有可能破坏酶的活性中心,从而导致酶活力降低。
柚皮苷是一种二氢类黄酮化合物,口感苦涩,在柑橘类果品中十分常见。为了改善其苦涩味道,柚苷酶通常用于去除柚柑类产品(如果汁等)的苦味[11]。柚苷酶是一种复合酶,具有α-L-鼠李糖苷酶(EC 3.2.1.40)和β-D-葡萄糖苷酶(EC 3.2.1.21)两种活性[12-14],其在自然界中的动物、植物、微生物中普遍存在[13]。柚苷酶水解柚皮苷主要经过两个步骤:第一步,柚皮苷经过α-L-鼠李糖苷酶水解为α-L-鼠李糖和普鲁宁两种物质,普鲁宁的苦味远低于柚皮苷(其苦味值仅为柚皮苷的一半);第二步,普鲁宁被β-D-葡萄糖苷酶水解生成葡萄糖及柚皮素,这两种产物均没有苦味[14]。迄今为止,柚苷酶在柑橘类水果脱苦、葡萄酒调味、医药工业等方面发挥着重要作用[15-18]。
在已有固定化柚苷酶的报道中,壳聚糖是一种较为常用的固定化载体,是广泛存在于自然界的天然高分子物质,具有生物相容性好[19]、安全无毒、易降解等优点[20]。段志涛等分别用壳聚糖和海藻酸钠微球对柚苷酶进行共价键合,其酶比活力分别为14.34 U/g 和12.18 U/g[21]。此外,作为壳聚糖的衍生物,羧甲基壳聚糖是将羧甲基等基团加入到壳聚糖的内部,其中富含大量的羧基和氨基等功能基团,在中性和碱性条件下,水溶性较好,因此有效改善了壳聚糖的溶解性能[22]。并且与单纯的壳聚糖材料相比较,羧甲基壳聚糖表现出更优异的生物相容性,同时能够与Ca2+交联产生致密结构,对活性化合物的吸附和控制释放有非常好的效果。肖安风等用聚乙烯醇和海藻酸钠形成的复合材料进行固定化柚苷酶的相关研究,酶比活力达到19 U/g[23]。与此同时,海藻酸钠也是一种天然多糖类物质,同样可以与Ca2+交联形成网络结[24]。虽然海藻酸盐微球羟基和羧基含量丰富,但由于其强度不高,导致微球结构相对不稳定,最好引入一些无机载体来增强其机械强度,例如二氧化硅,是最受欢迎的无机载体之一,具有良好的物理和机械稳定性,无膨胀,耐有机物、高酸度和高温等显著优点[25]。与此同时,海藻酸钠、硅胶、羧甲基壳聚糖均为绿色、对环境友好、价格相对便宜的原料,能够有效降低工业化生产成本。
迄今为止,鲜有关于羧甲基壳聚糖和海藻酸钠引入硅胶为材料对柚苷酶进行固定化的报道,作者以羧甲基壳聚糖、海藻酸钠、硅胶为基材制备微球,对柚苷酶进行固定化,优化了硅胶/羧甲基壳聚糖质量比、交联时间、固定化温度、偶联时间等条件,并探索和分析了固定化柚苷酶和游离柚苷酶发生酶解反应的最适反应pH、最适反应温度、重复使用性等,为创新酶固定化载体,不断拓宽柚苷酶在食品、医药等领域的应用和发展提供了技术准备和数据支持。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
DENVER INSTRUMENT TP-213 精密天平:美国丹佛仪器有限公司产品;78-1 型磁力加热搅拌器:江苏省金坛市荣华仪器制造有限公司产品;DF-101S 集热式恒温加热磁力搅拌器:河南省予华仪器有限公司产品;知楚三层立式摇床:上海知楚仪器有限公司产品;PHS-3C 型pH 计:上海仪电科学仪器股份有限公司产品;HH-8 型恒温水浴锅:常州菲普实验仪器厂产品;Tecan 酶标仪:勒菲生物科技(上海)有限公司产品。
1.3 方法
1.3.1 微球载体及固定化柚苷酶的制备
1)滴入法制备海藻酸钙/硅胶/羧甲基壳聚糖复合微球 首先配制1.5 g/dL 海藻酸钠溶液(溶液A),将100 mL 去离子水和1.5 g 海藻酸钠加入到250 mL 的烧杯中,置于磁力加热搅拌器上进行搅拌至溶解后,再加入1.0 g 硅胶和1.5 g 羧甲基壳聚糖,继续剧烈搅拌待其形成均一溶液后停止。配制2 g/dL CaCl2溶液(溶液B),称取4 g CaCl2于烧杯中加水溶解,转移到200 mL 容量瓶中定容。将溶液B 转移至三口烧瓶中,加入磁子后,将其置于恒温加热磁力搅拌器上,在温度为25 ℃条件下进行低速搅拌。利用1 mL 的注射器将溶液A 缓慢逐滴加入到溶液B 中,滴入瞬间在溶液B 中可以看到生成的微球,注意滴入速度不能过快,防止微球粘连。溶液A 全部加入后,微球滤出加入新的CaCl2溶液,同样的低转速持续搅拌1 h,结束后,用去离子水将微球洗涤数次。最后,将微球平铺在滤纸上,吸干其表面水分,4 ℃冷藏。
2)戊二醛交联海藻酸钙/硅胶/羧甲基壳聚糖复合微球的制备 将0.4 g 上述微球放入到1 mL 体积分数为6%的戊二醛溶液中,在25 ℃摇床中交联2.0 h。反应结束后,用去离子水洗涤数次,将微球平铺在滤纸上,吸干其表面水分,即得到戊二醛交联的海藻酸钙/硅胶/羧甲基壳聚糖复合微球,冷藏备用。
3)固定化柚苷酶的制备 取0.4 g 已交联的微球载体,加入4 mL 柚苷酶酶液,置于25 ℃摇床上振荡2 h,并于4 ℃冰箱中静置吸附偶联4 h。用去离子水清洗数次,将载体表面未固定化的剩余酶液冲洗干净,滤纸吸干水分获得固定化柚苷酶,于4 ℃冰箱中储存备用。
1.3.2 酶学性质表征
提高学生学习兴趣,可帮助学生改善学习效率,并使生物成绩快速提升。在教学实践中,教师可通过引导学生观察大自然的方式提升学生对于生物课程的兴趣。首先教师可利用假期时间,邀请学生进入到大自然中开展活动,在活动中,教师可开展相关的生物实验,以帮助学生认识到大自然的魅力与生物的多样性。之后教师可组织学生在课堂中将活动的体会进行分享。通过这样的活动学生将对自然环境产生新的认识,并将在教师的引导下对生物课程产生较为浓厚的兴趣。
1)酶解反应条件的优化 研究了海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶酶解反应温度、最适反应pH、pH 稳定性以及热稳定性。通过测定4 ℃、30 d 内酶活力变化,研究了固定化柚苷酶的储藏稳定性,同时计算了固定化柚苷酶的载酶率和酶活力回收率。
2)酶活力的测定 选择改进的Davis 法[26-29],称取0.4 g 固定化柚苷酶或移取0.2 mL 游离柚苷酶于1.5 mL 离心管中,加入0.8 mL 的柚皮苷溶液(0.8 mg/mL),混合均匀并置于恒温水浴锅中,在温度为55 ℃条件下加热30 min,反应停止后,取0.1 mL 上清液,加入到提前配制好的溶液C(体积分数95%一缩二乙二醇5 mL 和4 mol/L 氢氧化钠0.1 mL)中,振荡混匀,待其反应10 min 后,在波长为420 nm 条件下测定OD 值。
柚苷酶酶活力:在最适反应pH 和最适反应温度条件下,在1 min 内酶解质量为1 μg 的柚皮苷所需要的酶量称作一个酶活力单位,其单位为U。
酶比活力:在最适反应pH 和最适反应温度条件下,1 g 固定化柚苷酶或1 mL 游离柚苷酶具有的酶活力,其单位为U/g 或U/mL。
3)相关计算公式[30]固定化柚苷酶的载酶率由下式(1)计算得出:
式中:B 为载酶率,%;A0为柚苷酶固定前游离柚苷酶的总酶活力;A1为柚苷酶固定后上清液中剩余的酶活力。
酶活力回收率由下式(2)计算得出:
式中:R 为酶活力回收率,%;A2为固定化柚苷酶的总酶活力。
固定化柚苷酶相对酶活力计算公式如下式(3):
式中:Q 为相对酶活力,%;P 为某一条件下的酶活力;K 为该条件下的最高酶活力。
1.3.3 动力学参数测定 取0.2 mL 游离柚苷酶,加入0.8 mL 柚皮苷溶液中(质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL),在pH 为4.5,温度为55 ℃条件下,进行酶解反应,测定酶活力;取40 mg 固定化柚苷酶,加入0.8 mL 柚皮苷溶液中(质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL),在pH 为7.5、温度为55 ℃条件下,进行酶解反应,测定酶活力。最大反应速度(Vmax)和表观米氏常数(Km)由Lineweaver-Burk 方程计算得出,如下式(4):
2 结果与分析
2.1 海藻酸钙/硅胶/羧甲基壳聚糖复合微球制备工艺的优化
2.1.1 硅胶/羧甲基壳聚糖质量比对固定化柚苷酶酶活力的影响 首先,研究了硅胶/羧甲基壳聚糖质量比对固定化柚苷酶酶活力的影响,结果如图1(a)所示。当硅胶/羧甲基壳聚糖质量比为1.0∶1.5 时,酶活力达到最大值。当羧甲基壳聚糖质量增大时,酶活力随之减小,这可能是由于微球通过静电作用形成了复杂的空间网状结构[31],当羧甲基壳聚糖含量过高时,所产生的微球结构相对牢固,壁膜结构致密[32],减少了酶分子与载体结合的位点数量。因此,采用硅胶/羧甲基壳聚糖的质量比1.0∶1.5 进行后续实验。如图1(b)所示,在最佳工艺条件下制备出了机械强度高、表面光滑且成球性好的海藻酸钙/硅胶/羧甲基壳聚糖复合微球。
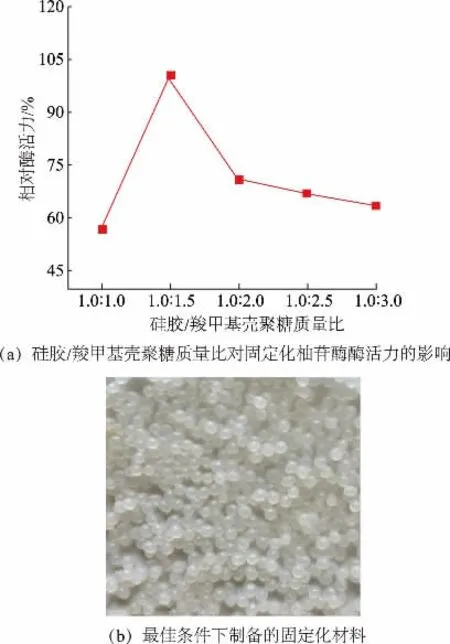
图1 硅胶/羧甲基壳聚糖质量比对固定化柚苷酶酶活力的影响及最佳条件下制备的固定化材料Fig.1 Effect of silica gel/carboxymethyl chitosan mass ratio on the activity of immobilized naringinase and immobilized materials prepared under the optimum conditions
2.1.2 交联时间对固定化柚苷酶酶活力的影响 作者以海藻酸钙/硅胶/羧甲基壳聚糖复合微球为载体,进行固定化柚苷酶。结果如图2 所示,载体加入戊二醛溶液后,交联时间在1.0~3.0 h 时,交联反应2.0 h 达到最大酶活力,这是因为交联时间过短,会引起酶的脱落[33];交联时间过长,会造成过高交联度,使微球内部网状结构孔径过小,不利于酶促反应进行,所以交联时间超过2.0 h 后,固定化柚苷酶的酶活力会明显降低。综上所述,采用2.0 h 作为交联时间进行后续研究。

图2 交联时间对固定化柚苷酶酶活力的影响Fig.2 Effect of crosslinking time on the activity of immobilized naringinase
2.2 海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶的工艺研究
2.2.1 固定化温度对固定化柚苷酶酶活力的影响 由图3 可以看出,当固定化温度在20~40 ℃时,固定化柚苷酶最佳的固定化温度为25 ℃,酶活力达到最高;大于25 ℃后,酶活力随之下降,温度对于柚苷酶的性质影响较大,酶分子的构象由此可能发生变化,导致游离柚苷酶酶活力下降,不能与载体更好地进行结合,进而使固定化柚苷酶的酶活力下降。故选择25 ℃为柚苷酶的最佳固定化温度。
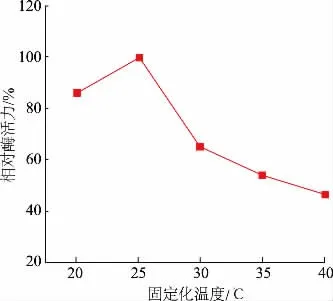
图3 固定化温度对固定化柚苷酶酶活力的影响Fig.3 Effect of immobilization temperature on the activity of immobilized naringinase
2.2.2 偶联时间对固定化柚苷酶酶活力的影响将已交联的海藻酸钙/硅胶/羧甲基壳聚糖复合微球与柚苷酶酶液充分混合并使其结合,因其孔道中存在大量的活性基团,可以使酶分子与载体逐步连接。由图4 可以看出,当交联时间小于4 h 时,偶联时间越长,固定化柚苷酶酶活力越大,在4 h 时达到最高;偶联时间大于4 h 时,酶活力随时间的延长不增反而降低。这是由于偶联时间过长材料表面的酶分子过于聚集,形成立体效应,致使酶分子不能与底物充分接触,从而使酶活力下降;同时,一部分酶分子深入到载体微球的孔隙中,致使底物难以和孔道内部的酶进一步反应,导致酶活力降低[34]。
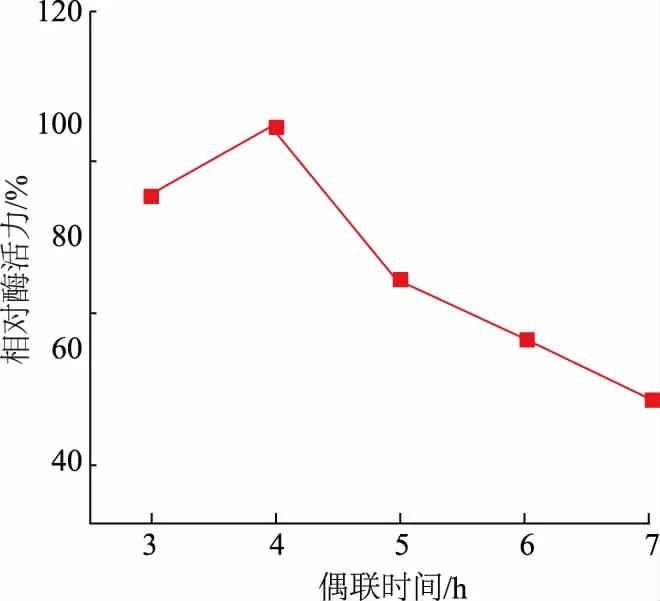
图4 偶联时间对固定化柚苷酶酶活力的影响Fig.4 Effect of coupling time on the activity of immobilized naringinase
2.2.3 给酶量对固定化柚苷酶酶活力的影响 如图5 所示,一定范围内,固定化柚苷酶的酶活力随着给酶量的增加逐渐增加,当给酶量为465.6 U/mL时,酶活力达到最高,之后随着给酶量进一步增加,酶活力降低。这是因为当给酶量为465.6 U/mL 时,载体的反应位点可能被酶分子完全占据,而给酶量的进一步增加,会使过多酶分子通过挤压现有酶分子覆盖的孔位置来扩大其与载体的连接[35],致使酶和底物不能进一步发生反应,最终导致酶活力降低。作者所在研究团队前期对固定化柚苷酶的相关研究及其他相关文献中也出现了类似的实验规 律[12,21,35-41]。
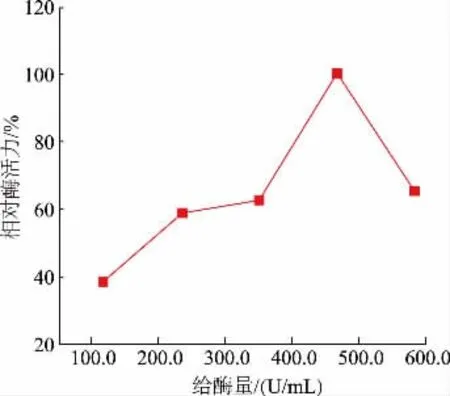
图5 给酶量对固定化柚苷酶酶活力的影响Fig.5 Effect of enzyme dosage on the activity of immobilized naringinase
2.3 海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶酶学性质的研究
2.3.1 海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶的最适反应pH 及pH 稳定性 如图6(a)所示,游离柚苷酶在pH 为3.0~6.0 时,酶活力变化比较大,在pH 为6.0 时仅剩余32%的酶活力,当pH 为8.0 时酶活力非常低(接近于0);而固定化柚苷酶在pH 为4.5~8.0 时,一直保持46%以上的酶活力。与游离柚苷酶相比,固定化柚苷酶有更好的耐碱性,且随pH 的增加,变化趋势较为缓和。
固定化柚苷酶的最适反应pH 与材料性能及其所在的微环境有较大关系。本研究中,固定化柚苷酶的最适pH 向碱性方向发生了偏移,这可能是由于羧甲基壳聚糖带有游离氨基,为阳离子型载体,当柚苷酶被固定在微球上时,表面会带有一定的负电荷,从而吸附溶液中的部分阳离子特别是氢离子[42],使固定化柚苷酶扩散层的氢离子浓度稍高于外部溶液,即呈弱酸性,因此外部溶液的pH(即固定化柚苷酶的最佳pH)需要调节为弱碱性(即pH为7.5,如图6(a)所示),才能抵消微环境的作用[43]。作者所在研究团队在前期工作中制备了多种固定化柚苷酶,其中部分固定化柚苷酶的最佳pH 在4.5~5.5[12,36-37],主要应用于一些酸性柚柑果汁的脱苦处理和酒类增香等;另外一部分固定化柚苷酶的最佳pH 在7.0~8.0[38-40],可用于碱性医药中间体(如普鲁宁等)的制备。进一步结合柚苷酶具有α-L-鼠李糖苷酶和β-D-葡萄糖苷酶两种酶活性的特性,固定化柚苷酶的最适反应pH 变化较大,非但不会限制柚苷酶的应用,反而在很大程度上拓宽了其在食品和医药方面的应用范围。
同时,在图6(b)中可以看出,将固定化柚苷酶和游离柚苷酶分别加入到pH 为3.0、4.0、5.0、6.0、7.0、8.0 的磷酸氢二钠-柠檬酸缓冲液中。将其放在4 ℃冰箱内保存2 h,测定酶活力。固定化柚苷酶酶活力的变化比游离柚苷酶的缓和,说明固定化柚苷酶比游离柚苷酶具有更好的pH 稳定性。
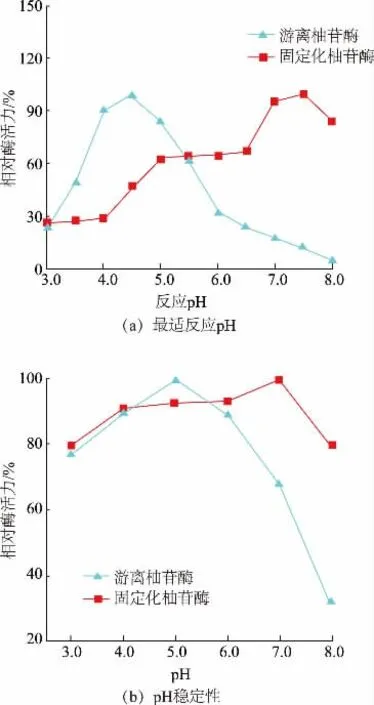
图6 游离柚苷酶和固定化柚苷酶的最适反应pH 和pH 稳定性Fig.6 Optimum reaction pH and pH stability of free enzyme and immobilized naringinase
2.3.2 海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶的最适反应温度及热稳定性 如图7(a)所示,固定化柚苷酶和游离柚苷酶的酶活力均随着反应温度的升高表现出先上升后下降的趋势。游离柚苷酶和固定化柚苷酶的最适反应温度均为55 ℃,但当温度在40~65 ℃时,固定化柚苷酶酶活力保持在80%以上,而游离柚苷酶在温度低于45 ℃和高于60 ℃时酶活力小于80%。与此同时,由图7(b)可以看出,将固定化柚苷酶和游离柚苷酶,同时置于55 ℃的恒温水浴锅内反应0、2、4、6、8 h,分别测其酶活力。与游离柚苷酶相对比,随着时间的变化,固定化柚苷酶的酶活力变化更缓和,故固定化柚苷酶比游离柚苷酶表现出更优异的热稳定性。
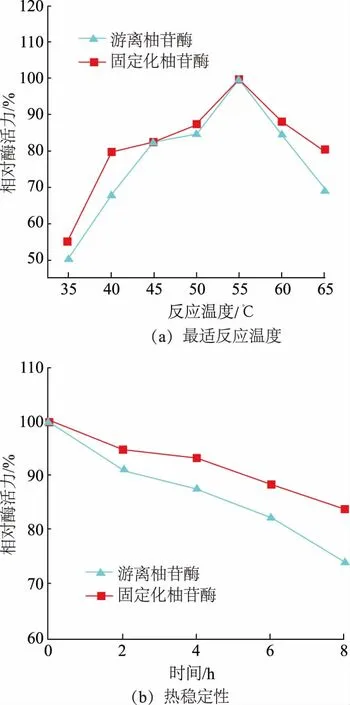
图7 游离柚苷酶和固定化柚苷酶的最适反应温度和热稳定性Fig.7 Optimum reaction temperature and thermal stability of free enzyme and immobilized naringinase
2.3.3 海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶的储藏稳定性 如图8 所示,固定化柚苷酶在4 ℃的条件下储藏30 d 后,仍然剩余70%以上的酶活力;而游离柚苷酶在储藏期间酶活力显著降低,在储藏15 d 后酶活力迅速下降,保存30 d 后只剩余25%的酶活力。结果表明,固定化柚苷酶比游离柚苷酶具有更好的储藏稳定性[44],尤其是在酶需要长时间保存和长距离运输上有巨大的潜力。
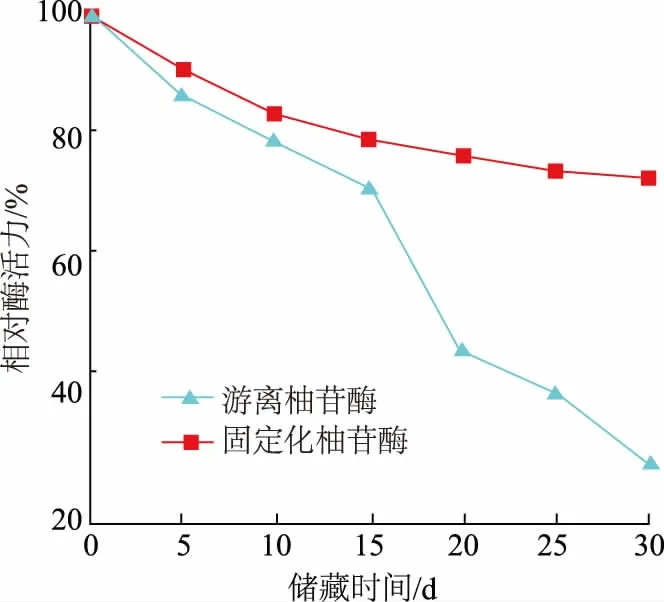
图8 固定化柚苷酶的储藏稳定性Fig.8 Storage stability of immobilized naringinase
2.4 海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶的载酶率、酶活力回收率及重复使用性
在最佳条件下,利用海藻酸钙/硅胶/羧甲基壳聚糖复合微球对柚苷酶进行固定化,其酶比活力、载酶率和酶活力回收率分别为203.33 U/g、36.80%以及62.15%。同时,在弱碱性条件下(pH 为7.5),固定化柚苷酶经过3 次重复使用后,仍能保持46.90%的初始酶活力,比作者所在团队之前研究中固定化柚苷酶在碱性条件下制备普鲁宁的实验结果(pH为8.0 时,经过3 次重复使用后,固定化柚苷酶的酶活力剩余38.80%[40])有显著提高。这也在很大程度上表明,碱性条件下应用固定化柚苷酶进行催化反应的难度始终较大,但是对于制备碱性医药中间体(如普鲁宁等)具有十分重要的研究意义,需要进一步突破研究瓶颈。
2.5 动力学参数的研究
游离柚苷酶与固定化柚苷酶酶解反应的双倒数曲线如图9 所示。经计算,固定化柚苷酶水解柚皮苷的Km值为0.94 g/L,高于游离柚苷酶水解柚皮苷的Km值(0.81 g/L),可以得出,相对于游离柚苷酶而言,固定化柚苷酶对柚皮苷的亲和力更低;海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶与底物发生酶解反应的最大反应速率Vmax(0.51 g/(L·min))比游离柚苷酶水解反应的Vmax(1.88 g/(L·min))小,这是因为固定化柚苷酶具有空间效应,使底物难以与酶接触,进而使得酶促反应速率下降[45]。进一步由Vmax=kcat[E]可得kcat=Vmax/[E],固定化柚苷酶的最大反应速率Vmax虽然比游离柚苷酶小,但固定化柚苷酶的[E]也比游离柚苷酶小得多,实验结果显示,固定化柚苷酶与游离柚苷酶对底物降解的kcat值分别为1.41 min-1和1.33 min-1,表明固定化柚苷酶具有更高的催化效率。

图9 游离柚苷酶与固定化柚苷酶酶解反应的双倒数曲线Fig.9 Double reciprocal curve of enzymatic hydrolysis of free naringinase and immobilized naringinase
3 结语
以海藻酸钠、羧甲基壳聚糖及硅胶为原材料制备的微球为载体,以体积分数为6%的戊二醛作交联剂,对柚苷酶进行固定化。结果表明,最佳固定化条件:硅胶/羧甲基壳聚糖微球质量比1.0∶1.5、交联时间2.0 h、最佳固定化温度25 ℃、偶联时间4 h、给酶量465.6 U/mL,此时海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶的酶比活力、载酶率和酶活力回 收率分别为 203.33 U/g、36.80% 以 及62.15%。同时,固定化柚苷酶在弱碱性条件下,循环利用3 次之后,依然剩余46.90%的酶活力,在制备碱性医药中间体(如普鲁宁等)方面具有较大的应用潜力。另外,对海藻酸钙/硅胶/羧甲基壳聚糖复合微球固定化柚苷酶的酶学性质研究结果显示,相比游离柚苷酶,固定化柚苷酶对pH 和温度都表现出更好的稳定性,具有良好的操作稳定性和储藏稳定性。作者将羧甲基壳聚糖和海藻酸钠引入硅胶作为载体进行柚苷酶的固定化研究,所取得的实验结果为创新酶固定化载体,进一步拓宽柚苷酶在食品、医药等领域的应用和发展提供了充分的技术准备和数据支持。

