基于PI3K/PTEN/Akt信号通路探讨Hp阳性萎缩性胃炎的作用机制
周海娟 陈刚 李枝锦 黄少君 王松海
(海口市中医医院,海南 海口 570216)
慢性萎缩性胃炎(CAG)是一种临床比较多见的一种慢性胃部疾病,胃黏膜的慢性炎症和固有腺体萎缩是其主要的病理特征〔1〕。CAG 的发生与幽门螺旋杆菌(Hp)感染密切相关,流行病学调查结果显示,慢性胃炎中60%~80% 患者均显示为Hp 阳性〔2〕。由于Hp 具有黏附性、运动性强等特点,极易产生抗生素耐药,在治疗上具有一定的难度,所以寻找新的作用靶点对于临床防治CAG意义重大。第 10 号染色体缺失的磷酸酶和张力蛋白同源物(PTEN)及磷脂酰肌醇 3-激酶(PI3K)/ 蛋白激酶 B(Akt) 信号通路在调控细胞增殖、生长代谢等方面具有重要作用〔3,4〕。研究报道Hp 可能诱导PTEN高表达,并通过PI3K/Akt信号途径抑制 Akt 磷酸化,促进胃黏膜细胞的凋亡〔5〕。本研究以PTEN/PI3K/Akt信号通路为作用靶点,探讨其在Hp阳性CAG中的发病机制。
1 材料与方法
1.1动物 70只8周龄SPF级Wistar 大鼠,雌雄各半,体质量180~200 g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK (湘) 2017-0003。
1.2试剂 胃蛋白酶测试盒、大鼠胃泌素(GAS)、胃蛋白酶原(PG)Ⅰ、PGⅡ试剂盒,均购自南京建成生物工程研究所;PI3K、Akt小分子RNA、PTEN慢病毒载体购自上海吉凯基因化学技术有限公司;羊抗大鼠PI3K、PTEN、Akt、B细胞淋巴瘤2蛋白(Bcl-2)、Bcl-2相关X蛋白(Bax)、半胱氨酸蛋白酶(Caspase)-9、β-actin抗体购自美国 Santa Cruz 公司。
1.3仪器 低温高速离心机〔赛默飞世尔科技(中国)有限公司〕;X73型倒置荧光显微镜(日本OLYMOUS公司);超声匀浆器(日本SANYO公司);凝胶成像系统(美国BIO-RAD公司)。
1.4大鼠Hp阳性萎缩性模型制备 取50只大鼠,灌胃抗生素溶液2 ml,连续3 d,1次/d,清除胃内杂菌;第4天灌胃吲哚美辛1 ml,共2 d,1次/d,破坏胃黏膜屏障;第6天灌胃 50 g/L碳酸氢钠溶液2 ml,15 min后灌胃Hp菌悬液(菌量为1×1012CFU/L)1 ml,隔日1次,共6次;间隔28 d后灌胃水杨酸钠和乙醇混合溶液 2 ml,连续8 w,1次/d;灌胃前禁食12 h、灌胃4 h后进食。
1.5实验分组 取10只健康大鼠作为对照1组,另外取10只Hp阳性CAG模型大鼠,检测胃蛋白酶活性、胃液分泌量;血清GAS、PGⅠ、PGⅡ水平; 取胃黏膜组织检测PI3K、PTEN、Akt蛋白表达。取10只健康大鼠作为对照2组,另外取40只Hp阳性CAG模型大鼠,随机分为阴性对照(NC)组,PI3K基因沉默(sh-PI3K)组,Akt基因沉默(sh-Akt)组、PTEN过表达(miR-PTEN)组,每组10只。NC、miR-PTEN通过尾静脉分别注射空白载体及PTEN慢病毒载体,sh-PI3K、sh-Akt组通过尾静脉注射PI3K-shRNA、Akt-shRNA,连续 2 次,每月 1 次。检测胃蛋白酶活性、胃液分泌量;血清GAS、PGⅠ、PGⅡ水平;Hp 检测胃组织 Hp 阳性率;取胃黏膜组织检测凋亡相关蛋白Bcl-2、Bax、Caspase-9 表达。
1.6检测指标
1.6.1测定胃蛋白酶活性及胃液分泌量 实验结束后,10% 水合氯醛腹腔注射,大鼠麻醉后仰位固定,垫高头部,暴露胃部,在幽门下方 0.3 cm 处结扎,5 h 后剪开结扎处,收集胃液,4 000 r/min离心15 min,测量上清液体积,取2 ml上清液,13 000 r/min离心10 min,取上清液,测定胃蛋白酶活性。
1.6.2检测血清中 PGⅠ、PGⅡ、GAS水平 大鼠麻醉后腹主动脉采血,3 500 r/min离心 15 min,取血清,酶联免疫吸附试验(ELISA)检测PGⅠ、PGⅡ及GAS水平,计算PGⅠ/PGⅡ比值。测定时严格按照试剂盒说明书进行操作。
1.6.3检测Hp 阳性情况 大鼠麻醉后剖腹,摘出全胃,沿胃大弯剪开,取前后胃窦部及部分胃体胃壁3 mm×10 mm,10%多聚甲醛固定,石蜡包埋,5 μm切片,HE染色,光镜下观察Hp 阳性情况。
1.6.4Western印迹检测胃组织PI3K、PTEN、Akt、Bcl-2、Bax、Caspase-9蛋白表达 取大鼠胃组织,加入放射免疫沉淀(RIPA)裂解液充分匀浆,离心15 min(4℃、12 000 r/min),BCA蛋白定量法测定上清液蛋白浓度,加上样缓冲液和样品,上样量100 μg蛋白,经电泳、转膜、脱脂、封闭后,加入一抗PI3K、PTEN、Akt、Bcl-2、Bax、Caspase-9、β-actin,4℃ 孵育过夜,TBST洗涤,加入二抗,室温孵育 2 h,TBST 洗涤, 电化学发光(ECL)显影并扫描,化学发光仪成像。
1.7统计学方法 采用SPSS17.0软件进行t检验、χ2检验。
2 结 果
2.1胃液分泌量及胃蛋白酶活性 与对照1组相比,模型组胃蛋白酶活性明显降低,胃液分泌量明显减少(P<0.05),见表1。
2.2血清PGⅠ、PGⅡ及GAS水平 与对照1组相比,模型组血清PGⅠ/PGⅡ比值、GAS含量明显降低(P<0.05),见表1。
2.3PI3K、Akt、PTEN蛋白表达 与对照1组相比,模型组胃组织PI3K、Akt 蛋白表达明显升高,PTEN蛋白表达明显降低(P<0.05),见表1、图1。
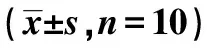
表1 两组胃蛋白酶活性及胃液分泌量、血清PGⅠ/PGⅡ、GAS水平、胃组织PI3K、Akt、PTEN蛋白表达
图1 Hp阳性CAG大鼠胃组织PI3K、Akt、PTEN蛋白表达
2.4调节PI3K、Akt、PTEN表达后胃蛋白酶活性及胃液分泌量 与对照2组比较,NC组胃蛋白酶活性明显降低,胃液分泌量明显减少(P<0.05);与NC组比较,sh-PI3K、sh-Akt、miR-PTEN组胃蛋白酶活性明显升高,胃液分泌量明显增加(P<0.05),见表2。
2.5调节PI3K、Akt、PTEN表达后血清PGⅠ/PGⅡ、GAS水平 与对照2组比较,NC组血清PGⅠ/PGⅡ、GAS含量显著降低(P<0.05);与NC组比较,sh-PI3K、sh-Akt、miR-PTEN组血清PGⅠ/PGⅡ、GAS含量显著升高(P<0.05),见表2。
2.6调节PI3K、Akt、PTEN表达后胃组织 Hp 阳性情况 与对照2组比较,NC组胃组织 Hp 阳性率明显升高(P<0.05);与NC组比较,sh-PI3K、sh-Akt、miR-PTEN组胃组织 Hp 阳性率明显降低(P<0.05),见表2。
2.7调节PI3K、Akt、PTEN表达后胃黏膜组织Bcl-2、Bax、Caspase-9 蛋白表达 与对照2组比较,NC组胃组织Bcl-2、Bax、Caspase-9表达明显升高(P<0.05);与NC组比较,sh-PI3K、sh-Akt、miR-PTEN组胃组织Bcl-2、Bax、Caspase-9表达明显降低(P<0.05),见表2、图2。
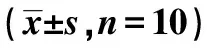
表2 各组胃蛋白酶活性及胃液分泌量、PGⅠ/PGⅡ、GAS水平、胃组织Hp阳性率、胃黏膜组织Bcl-2、Bax、Caspase-9 蛋白表达
1~4:对照2组、NC组、sh-PI3K组、sh-Akt组、miR-PTEN组图2 调节PI3K、Akt、PTEN表达后胃黏膜组织Bcl-2、Bax、Caspase-9 蛋白表达
3 讨 论
PI3K/Akt 信号通路由 PI3K、Akt 及下游相关分子组成,PI3K 通过调控磷脂酰肌醇三磷酸(PIP3)参与细胞内的信号转导,具有抑制细胞凋亡的作用〔6,7〕,而PIP3 又会导致 PI3K/Akt 信号通路的失衡,进而介导 NF-κB 等炎症因子的释放、抑制细胞的凋亡〔8,9〕。PTEN 可以调控多种细胞信号转导通路,具有促进细胞凋亡、降低细胞存活率、调控细胞周期等作用〔10〕。PTEN 作为PI3K/Akt 信号通路的重要负性调控因子,可以拮抗 PI3K的作用,它通过下调 PIP3 水平,使得PI3K功能丧失,从而对 PI3K/Akt 通路介导的细胞凋亡起调控作用〔11,12〕。诸多研究报道,在 Hp 所致的胃黏膜损伤过程中,增殖和凋亡的紊乱是关键原因〔5〕。Hp 可能诱导 PTEN高表达,并通过PI3K/Akt 信号途径促进胃黏膜细胞的凋亡〔13〕,Dunn 等〔14〕研究发现,Hp培养上清液可以抑制胃黏膜上皮细胞的增殖,并促进细胞凋亡,其机制可能是诱导PTEN 高表达,并通过 PI3K/Akt 信号途径抑制 Akt 磷酸化。Tsugawa 等〔15〕研究显示,PTEN 过表达后,可抑制 PI3K/Akt 信号通路的激活,从而导致门脉高压性胃黏膜愈合延迟。PG可以反映胃体黏膜的泌酸功能,胃体萎缩时会影响 PGⅠ的分泌情况〔16,17〕;GAS可以促进胃酸分泌,保护和营养胃肠道黏膜,CAG患者由于胃分泌功能不足,GAS 分泌减少,因此,GAS含量也可以反映胃黏膜萎缩的情况〔18〕。
本研究说明Hp阳性CAG的发病可能与PI3K、Akt、PTEN表达异常有关,PI3K、Akt、PTEN可以通过调控胃黏膜上皮细胞增殖、凋亡等途径参与Hp阳性CAG病变的发生。

