两种常见大鼠心肌缺血再灌注损伤模型造模方法比较
胡建春
(贵州工业职业技术学院,贵阳 551400)
心肌缺血再灌注损伤模型(MIRI)是在动物体内阻断左冠状动脉前降支(LAD)造成的急性心肌缺血,并在预定时间内恢复血供予以再灌注,是模拟人类缺血性心脏病恢复供血治疗必需的实验方法。由于大鼠在进化关系上比较接近人类,冠状动脉侧支循环少,心肌坏死出现早,心律失常发生率高,稳定性好且制作模型费用低,成为了制作心肌缺血再灌注损伤模型的首选。
结扎大鼠LAD形成心肌梗死是目前国内外公认的模型制备方法[1]。通用的造模方法为常规开胸法和快速手术法,但MIRI模型制备过程中存在诸多难点,如常规手术需要断肋骨,造成实验动物严重创伤,术后预后不良,死亡率升高。手术时反复多次将心脏牵拉到胸腔外,造成动物死亡率增加。术后胸腔空气未排尽,引发气胸,导致死亡率升高,再灌注时结扎线不易解开(剪断),轻者再灌注失败,重则可能导致左心耳破裂,造成大出血,动物死亡。文献[2-4]报道了冠状动脉的定位部位不一,造成模型缺血损伤部位及损伤程度不一致等。
通过对常规开胸手术和快速手术两种造模方式作横向对比,对模型成功率、死亡率、手术时间等进行统计分析,为科研提供依据。
1 材料与方法
1.1 实验动物与主要试剂
实验动物:健康SD大鼠,雄性,250±20 g,购买自重庆腾鑫生物技术有限公司,动物许可证号SCXK(渝)2012-0008。
主要仪器与试剂:BL-420生物机能实验系统,水合氯醛(天津市科密欧化学试剂有限公司生产,批号20191011),TTC(SIGMA,批号BCBP3272V),DW-20002小动物呼吸机(上海嘉鹏科技有限公司生产)。
1.2 实验方法
1.2.1 实验分组与模型建立
20只SD大鼠随机分为快速操作组和常规开胸手术组,每组10只。由专人饲养管理,以标准饲料喂养并每日更换新鲜纯净水。动物室光照充足,通风良好,室温18℃~25℃,相对湿度50%~70%,动物饲养室定期消毒。
常规开胸手术组[2-4]:健康大鼠0.4 mL/100 g腹腔注射10%水合氯醛麻醉,仰卧位固定于手术台上,连接生物机能实验系统,二导联下实时测心电图。经口插气管,连接呼吸机,设置潮气量12,呼吸比1∶2,呼吸频率90次/分。从胸中线到左腋下斜开口(5~6 cm),分离皮肤和肌肉,见肋骨。在左侧3~4肋间用手术刀轻轻划开肌肉,再用止血钳分开肋间隙,使用扩胸器扩开胸腔。用镊子撕开心包膜,暴露心脏。采用6-0缝合线,在心脏中下部穿线用于牵引固定心脏位置,左手轻轻牵拉牵引线,固定心脏位置,右手从左心耳下沿稍靠右的位置进针,结扎LAD。观察心电图ST段是否抬高,若抬高,则结扎成功。 将牵引线拔出,撤出扩胸器,闭合胸腔,缝合肋骨,用手挤压大鼠胸腔排除腔内空气,缝合肌肉和皮肤。结扎LAD时,将结扎线打活节,一段露在皮肤表面。60 min后,轻拉线头,将活结打开,减掉外露线头,实现再灌注。
快速操作组[5-6]:健康SD大鼠按0.4 mL/100 g腹腔注射10%水合氯醛麻醉,仰卧位固定于手术台上,连接生物机能实验系统,二导联下实时测心电图。左胸部备毛,消毒,于胸骨左缘心脏搏动处纵行切开皮肤约2 cm,用止血钳逐层分离皮下组织、肌肉,再用拉钩拉开剥离开的肌肉,暴露手术视野。在心脏搏动明显的3~4肋间打开胸腔,左手从右前区沿心脏跳动方向挤压,同时右手用止血钳深入胸腔引导,使心脏弹出胸腔,左手拇指、食指和中指轻捏住心脏,在左心耳下方以心脏表面左冠状静脉主干为标志,用6-0无创缝合针于左心耳根部下方2 mm处穿过心肌表层,在肺动脉圆锥旁出针,作一活结以结扎左冠脉前降支,迅速将心脏塞回胸腔,用力挤压胸腔排空腔内空气,观察心电图,Ⅱ导联下ST段抬高,表明缺血成功,缝合皮肤。60 min后松结扎线,心电图ST段下降表明心肌组织恢复再灌注。
1.2.2 观测指标
造模存活率。以手术成功且再灌注24 h仍存活的大鼠计算两组的造模存活率。
ST段抬高幅度。通过观察二导联下大鼠心电图ST段的变化,确认大鼠是否存在心肌缺血现象,以ST段抬高幅度作为判定指标之一。
心脏TTC染色结果[7-8]。手术再灌注24h后,股动脉采血,立即取心脏,经0.9%氯化钠溶液清洗干净,于-20℃冷冻20 min,取出切片,置于1%TTC PBS溶液中,37℃水浴避光染色10 min,可见缺血灶呈苍白色,正常组织为红色肌肉组织,取出置4%多聚甲醛中固定24 h,以梗死区域重量除以心肌组织总重,计算梗死率。
心脏HE染色结果[8-9]。手术结束,再灌注24 h后,股动脉采血,立即取心脏,冷冻后进行HE染色。
2 结果
A.造模存活率。常规开胸组10只大鼠中,造模成功9只,存活的共5只,造模存活率50%;快速操作手术组10只大鼠中,存活8只,造模成功7只,造模存活率70%。
B.大鼠心电图变化。通过二导联监测,两种方法造模成功的大鼠心电图均呈现ST段抬高的现象。
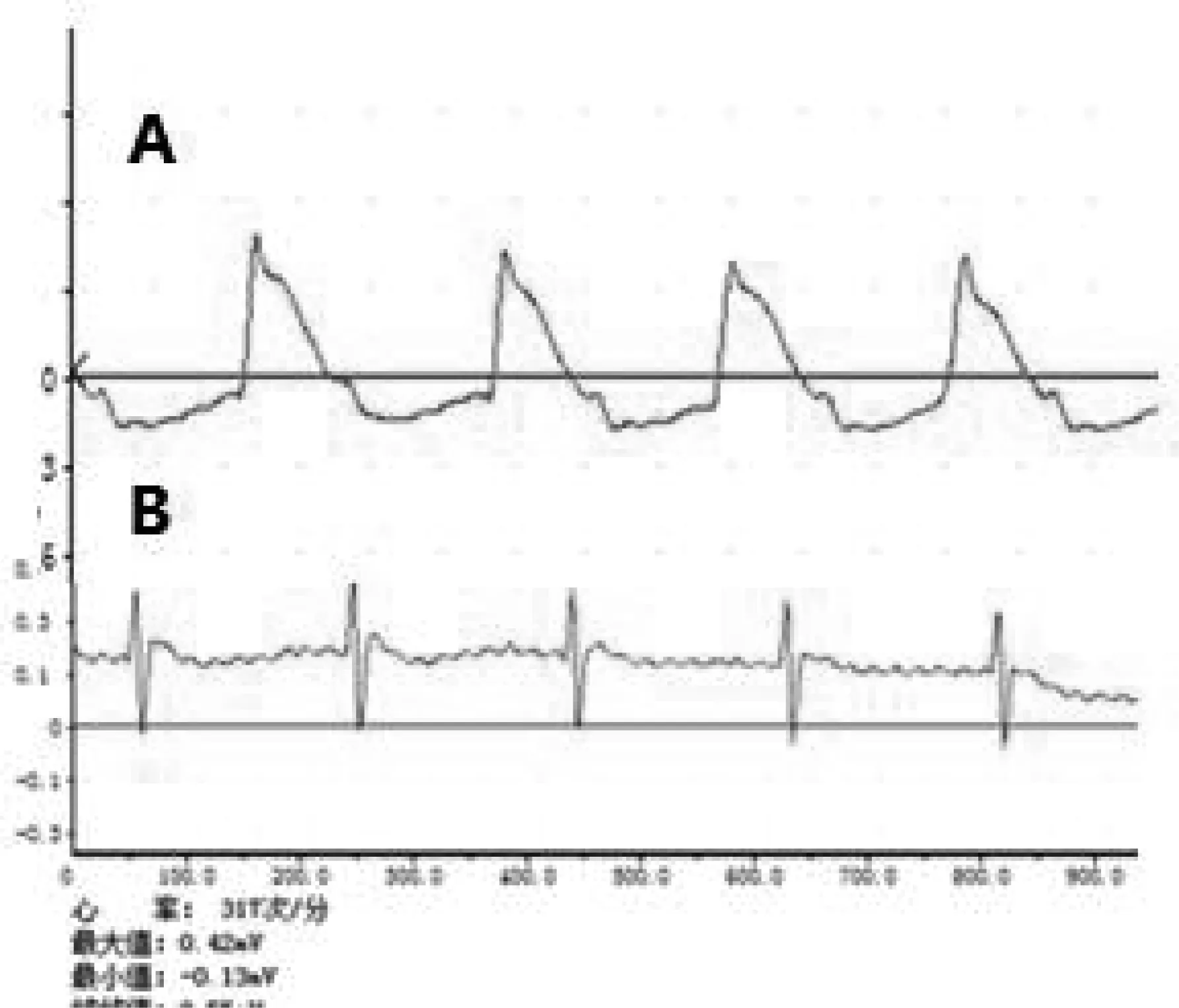
图1 MIRI大鼠心电图变化(A:心肌缺血,ST段抬高;B:正常心电图)Fig.1 MIRI rats ECG changes(A: myocardial ischemia, ST segment elevation; B: normal ECG)
对比两种造模方法ST段抬高幅度,常规开胸组ST段平均抬高0.158 mV,快速操作手术组ST段平均抬高0.154 mV,无明显差异,具体数据见表1。

表1 两种造模方法下大鼠ST段变化统计表Tab.1 Statistics of ST segment changes in rats under two modeling methods
C.TTC染色结果[10]。TTC染色时,梗死区域心肌组织呈苍白色,正常心肌组织呈红色,具体见图2。以梗死区域心肌组织重量/心肌总重量计算梗死率,两组大鼠梗死率见表2。经统计,常规操作组平均心肌梗死率为36.84%,快速操作组为37.49%。结果中个别大鼠心肌梗死率相较更高,可能是由于结扎手法、位点不统一,引发心脏缺血位置不一致导致的。
D.HE染色结果。 HE染色可见正常心肌细胞形态规则、排列整齐。病变区肌纤维排列紊乱,部分区域性变性坏死,部分核固缩,心肌间质可见灶性水肿及炎症细胞浸润。

图2 MIRI大鼠心脏TTC染色结果(左为常规手术法,右为快速操作法)Fig.2 Results of MIRI rats heart TTC staining(the left is the conventional operation, and the right is the rapid operation)

表2 两种造模方法下大鼠心肌梗死率统计表Tab.2 Statistics of myocardial infarction rate in rats under two modeling methods

图3 MIRI大鼠心脏HE染色结果(左为正常心肌组织,右为病变区域)Fig.3 Results of MIRI rats heart HE staining(the left is normal cardiac muscle tissue, and the right is lesion region)
3 讨论
两种手术操作比较:常规手术组直接在胸腔结扎LAD,不牵拉心脏,不变动心脏位置,利于准确结扎LAD位点。但其操作时间长(约15~20 min),必须气管插管或经口插管,采用呼吸机辅助手术,才能保证存活率。手术过程步骤多,较复杂。快速手术组需要将心脏牵拉出胸腔,快速结扎后将心脏返回胸腔,整个过程在1~2 min完成,难以保证结扎位置的重复性和准确性,对实验人员熟练度要求更高。快速操作法由于手术时间短,熟练操作后可不需要呼吸机辅助手术操作,快速结扎后挤压胸腔排气、缝合皮肤即可获得较好的手术效果。
大鼠术后恢复:常规手术组胸部开口较大,肌肉和肋骨是经锐器(刀片)分离,不能自主闭合,必须缝合。快速手术组开口小,肌肉经钝器分离,无需缝合即可闭合。二者相比,快速手术组更利于动物术后伤口愈合和恢复。
对后续研究的影响:常规手术组缝合时会使用头孢类等消炎药抗感染,确保动物存活率,可能会因为药物相互作用而影响后续的实验结果。快速手术组钝性分离肌肉,无需使用消炎药即可获得较高的存活率,且对后续实验影响较小。
通过同步实验,对常规开胸手术和快速操作手术两种造模方法成功的大鼠进行造模存活率、心机梗死率、心电图ST段变化等指标的比较,发现二者在存活率、梗死率及心电图变化上无显著差别,但快速操作组在手术时间、造模存活率、对后续实验的影响等方面显著优于常规操作组,因此经过反复练习、熟练手术操作的情况下,选择快速操作法,可快捷、有效地完成MIRI模型的制备。

