SADS-CoV S1蛋白的原核表达及多克隆抗体制备
张睿玉,李龙驹,李 程,周 玲,马静云
(华南农业大学 动物科学学院 畜禽健康养殖与疾病防控研究室,广东 广州 510642)
2017年1-4月份在我国南部几个规模化猪场的新生仔猪群中相继暴发猪急性腹泻综合征(SADS),感染仔猪临床表现为严重水样腹泻,伴随剧烈呕吐,极度脱水,5日龄以下仔猪死淘率高达100%,造成重大经济损失[1-2]。通过病毒的分离鉴定,高通量测序技术获得病毒基因组序列,初步确认该病毒是一种新发冠状病毒,并与蝙蝠冠状病毒HKU2基因组序列高度相似,将其命名为猪急性腹泻综合征冠状病毒(swine acute diarrhea syndrome coronavirus,SADS-CoV)。回顾性检测发现,至少自2016年8月开始,SADS-CoV已在广东省多个猪场流行[3]。截止目前,其他国家和地区尚无SADS-CoV的相关报道。
SADS-CoV属于冠状病毒科、α冠状病毒属,是截至目前为止发现的第6种猪源冠状病毒。SADS-CoV的基因组全长约为27 kb,两端为5′- UTR与3′- UTR,其间约有1/3的区域编码4个结构蛋白,分别为刺突蛋白(S)、核衣壳蛋白(N)、膜糖蛋白(M)和包膜蛋白(E),这4种结构蛋白对于维持病毒颗粒的完整性有着重要的生理意义。其中,SADS-CoV S蛋白作为最大的结构蛋白位于病毒粒子的表面,是由1 130个氨基酸构成的Ⅰ型跨膜糖蛋白,大小为180~250 kDa。S蛋白由S1和S2两个亚基组成,S1亚基作为吸附细胞的前提条件,不仅拥有病毒进入宿主细胞的受体结构域,在病毒感染宿主的过程中发挥着重要作用,并且能够介导宿主机体产生病毒中和抗体,是研发抗SADS-CoV感染高效疫苗的理想靶标。此外,S1亚基的三聚体结构和糖基化位点可以帮助病毒逃避宿主免疫系统的监视[4-5]。S2亚基主要介导病毒-细胞以及细胞-细胞膜融合,仅可诱发较弱的中和抗体。
本研究根据SADS-CoV/GDGL/2017毒株序列设计引物,通过PCR扩增S1基因,构建原核表达载体后表达并纯化S1蛋白,利用该重组蛋白免疫小鼠,最终制备出针对S1蛋白的多克隆抗体,为实现SADS-CoV血清学诊断、致病机制深入研究等奠定了基础。
1 材料与方法
1.1 毒(菌)株、细胞与实验动物SADS-CoV毒株由本实验室保存;感受态细胞DH5α和BL21(DE3)购自上海唯地生物技术有限公司;原核表达载体pGEX-6P-1源于Addgene;Vero E6细胞购自通派(上海)生物科技有限公司;6~8周龄雌性BALB/c小鼠购自广东省医学实验动物中心。
1.2 主要试剂病毒RNA提取试剂(Axygen),PrimeSTARTMHS DNA聚合酶、DL2000 DNA Marker、PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit购自宝生物工程(大连)有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自上海阿拉丁生化科技股份有限公司;氨苄青霉素、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FICA)购自Sigma公司;蛋白酶抑制剂、RIPA裂解液、SDS-PAGE试剂盒购自江苏康为世纪生物科技股份有限公司;Glutathione Sepharose 4B(GE)、山羊抗鼠HRP-IgG购自武汉三鹰生物技术有限公司;预染蛋白Marker、BCA蛋白定量试剂盒、ECL曝光液购自上海雅酶生物医药科技有限公司;胶回收试剂盒(Omega)购自广州飞扬生物工程有限公司。
1.3 引物设计与合成参考SADS-CoV/CN/GDGL/2017毒株序列S蛋白基因序列(GenBank:MG605090.1),选择S蛋白S1结构域N-CTD(18-402AA)设计引物,引物设计遵循无缝克隆原则,引物序列信息见表1。
1.4 扩增SADS-CoV S1基因和线性pGEX-6P-1载体提取病毒RNA,按照PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit说明书合成cDNA,以合成的cDNA为模板,进行PCR扩增S1基因。同时以全长pGEX-6p-1载体为模板,PCR扩增获得线性载体片段。反应体系:PrimeSTAR Max Premix(2×)25 μL,S1-F/6p-1-F(10 μmol/L)、S1-R/6p-1-R(10 μmol/L)各2 μL,模板2 μL,ddH2O 补足50 μL。反应条件:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 15/50 s,共34个循环;72℃ 5 min。将PCR产物经TAE琼脂糖凝胶电泳后胶回收,纯化得到带有载体同源臂的S1(N-CTD)基因和线性载体备用。
1.5 重组质粒的构建和鉴定利用无缝克隆试剂盒说明书进行S1基因和载体的同源重组。无缝克隆程序为50℃反应15 min。将产物转化至感受态细胞DH5α中,37℃培养箱倒置培养12 h。随机挑取单菌落,经菌液PCR鉴定为正确的重组菌送至生工生物工程(上海)股份有限公司测序。将测序结果正确的菌液扩大培养,使用质粒小提试剂盒提取质粒,并命名为pGEX-6p-1-S1,并置于-20℃保存备用。
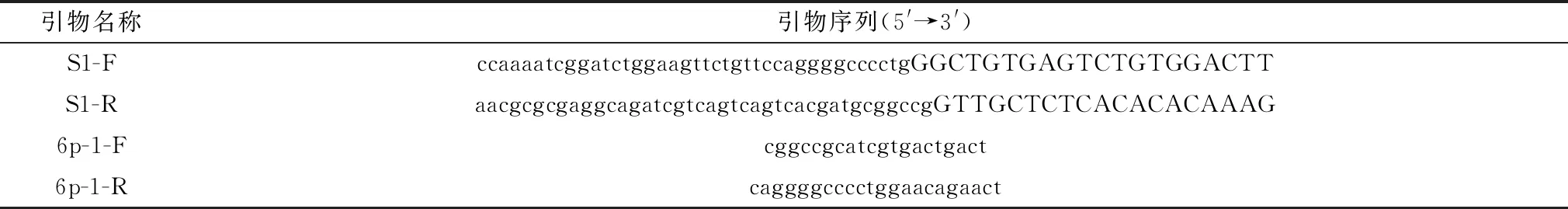
表1 构建pGEX-6p-1-S1重组质粒的引物信息
1.6 S1蛋白的诱导表达及纯化将pGEX-6p-1-S1质粒转化至BL21(DE3)感受态细胞,取适量菌液,以1∶100的比例接种到含氨苄抗性的LB液体培养基中,37℃扩摇至菌液D600 nm值至0.4~0.6,加诱导剂IPTG至终浓度为0.6~1.0 mmol/L,16℃、150 r/min扩摇24 h,以诱导蛋白的表达。同时设立空载体转化至BL21的菌液作阴性对照。收获菌液后离心收集沉淀,加适量PBS缓冲液重悬细菌沉淀,加入蛋白酶抑制剂,吹打混匀,超声破碎细胞30 min,10 000×g分别收集上清、沉淀。分别加SDS上样缓冲液煮沸10 min,随后进行SDS-PAGE凝胶电泳检测分析。将蛋白胶置于考马斯亮蓝染色液中至条带清晰,观察试验结果后,大量表达S1重组蛋白,用GST标签琼脂糖凝胶进行蛋白纯化,BCA法测定纯化后S1蛋白浓度。
1.7 动物免疫及多克隆抗体的制备将纯化后的重组S1蛋白(200 μg/只)与弗氏完全佐剂按照等体积比例混合制成试剂,对6~8周龄雌性BALB/c小鼠进行皮下注射。后续免疫分别间隔2周进行,剂量同初次免疫,使用弗氏不完全佐剂。第3次免疫后7 d进行尾部采血收集血清以测定血清抗体效果。
1.8 多克隆抗体反应性测定
1.8.1Western blot鉴定 SADS-CoV病毒液经超速离心浓缩后加SDS上样缓冲液煮沸变性进行蛋白凝胶电泳。蛋白转印至PVDF膜,5%脱脂奶粉封闭1 h,1×TBST清洗3次,以制备的SADS-CoV S1蛋白的多克隆抗体为一抗,室温孵育2 h,1×TBST清洗3次,以山羊抗鼠HRP-IgG为二抗,进行Western blot分析。
1.8.2间接免疫荧光试验(IFA)分析 Vero细胞提前接种至24孔板,待汇合后每孔以0.1 MOI SADS-CoV感染,感染后24 h,弃培养液,PBS清洗3次,加入4%多聚甲醛溶液,4℃固定30 min,PBS洗涤3次,加入0.1% Trition100穿膜剂后室温放置15 min,洗涤,加5% BSA室温封闭1 h后清洗3次。S1蛋白阳性血清用PBS以1∶100比例稀释后加入24孔板,并用小鼠阴性血清设立对照组,4℃孵育2 h后洗涤。用PBS缓冲液以1∶400稀释FITC-羊抗鼠-IgG,加入到24孔板中,常温避光孵育1 h,弃二抗后洗涤,加DAPI,置于荧光显微镜下观察。
2 结果
2.1 S1基因的PCR扩增S1基因PCR胶回收产物和pGEX-6p-1载体经无缝克隆后,转化至DH5α感受态细胞。将构建好的重组质粒进行PCR鉴定,用琼脂糖凝胶电泳对扩增产物进行检测。结果显示,扩增片段大小与S1基因的预期大小相符,约为1 155 bp(图 1)。
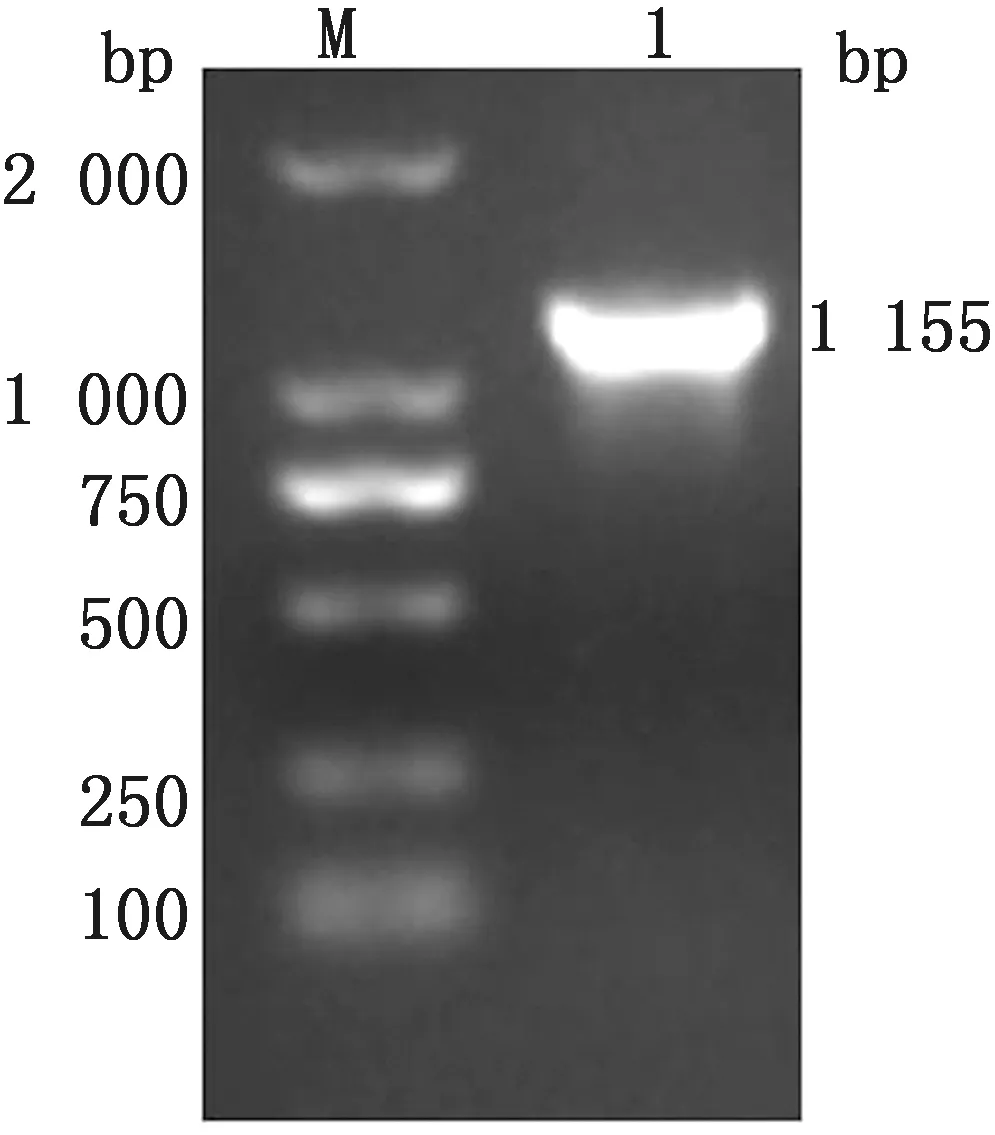
M.DL2000 DNA Marker;1.S1基因PCR产物
2.2 S1蛋白的诱导表达及纯化重组质粒pGEX-6p-1-S1转化至大肠杆菌BL21(DE3)感受态细胞中,加入终浓度为0.6~1.0 mmol/L的IPTG进行诱导表达,诱导产物经超声破碎后进行 SDS-PAGE 鉴定。结果显示,重组S1蛋白(GST-S1)以可溶性形式大量表达,相对分子质量约为70 kDa,与预期蛋白大小相符(图 2)。
利用GST琼脂糖凝胶纯化蛋白,可得到纯度较高的S1蛋白,BCA蛋白定量试剂盒测定其质量浓度为880 mg/L。
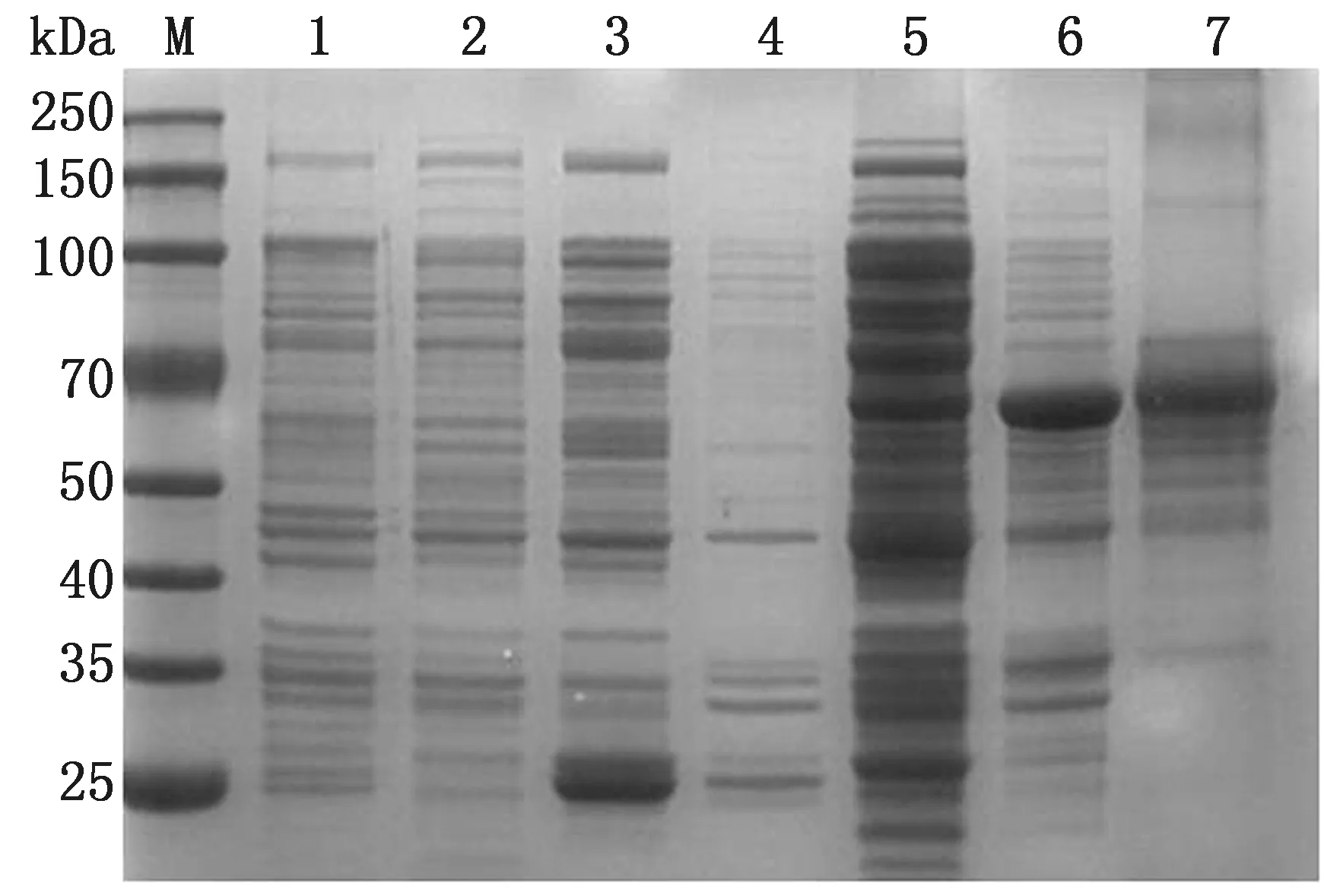
M.蛋白质Marker;1.未诱导的 pGEX-6p-1 空载体;2.未诱导的 pGEX-6p-1-S1 重组菌体;3.诱导的 pGEX-6p-1 空载体蛋白上清;4.诱导的 pGEX-6p-1 空载体蛋白沉淀;5.诱导的 pGEX-6p-1-S1 重组菌体裂解蛋白上清;6.诱导的 pGEX-6p-1-S1 重组菌体裂解蛋白沉淀;7.纯化后的重组 pGEX-6p-1-S1 蛋白
2.3 Western blot 检测以制备的SADS-CoV S1蛋白的多克隆抗体为一抗,山羊抗鼠HRP-IgG为二抗,进行Western blot分析。结果表明,制备的多克隆抗体能有效识别和结合SADS-CoV S蛋白,可用于SADS-CoV S蛋白的Western blot检测(图 3)。

M.蛋白质Marker;1.SADS-CoV浓缩病毒
2.4 IFA 检测以制备的抗SADS-CoV S1蛋白的多克隆抗体作为一抗,以荧光标记的羊抗鼠IgG作为二抗,以未感染SADS-CoV病毒的Vero E6细胞为对照(Mock),对SADS-CoV感染后的细胞进行IFA检测。结果表明,制备的鼠抗SADS-CoV S1蛋白多克隆抗体可以用于IFA检测SADS-CoV S1蛋白(图 4)。
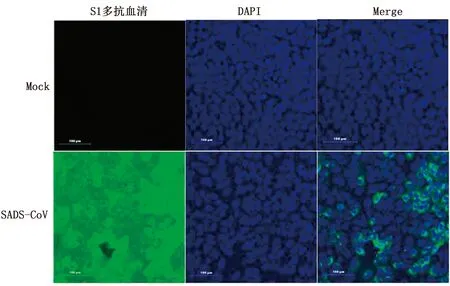
图4 鼠抗pGEX-6p-1-S1蛋白多克隆抗体识别天然SADS-CoV S1蛋白的 IFA检测
3 讨论
近年来,动物冠状病毒对人类、畜禽健康构成了严重威胁。冠状病毒在自然界广泛存在且宿主多样,故对其生物安全防控具有重要意义[6]。SADS-CoV是2017年有报道在我国南部新发现的第6种猪冠状病毒[8-9],迄今为止仅呈现区域性散发感染。秦俣等[10]对SADS-CoV的全基因组核苷酸序列和复制酶(RdRp)、ORF1a/1b、M、N蛋白的氨基酸序列进行系统发育分析及S蛋白结构同源性比对分析,发现SADS-CoV很可能属于甲型和乙型冠状病毒之间的重组。LI等[11]对2018年在福建省暴发的SADS-CoV的毒株CH/FJWT/2018进行全基因组序列比对后,发现该毒株可能来源于当地蝙蝠,而非由广东传播。该研究提示SADS-CoV可能不仅只有一种基因型,若不同分离株的S蛋白的基因组序列有较高的差异性,其抗原表位也造成较大不同;这可能导致其抗体无法抵抗新流行的病毒株。YANG等[12]发现SADS-CoV在体外可感染人、猪、蝙蝠、鸡、鼠及非人灵长类等20余种动物细胞,呈现出广泛的细胞种属嗜性。此外,EDWARDS等[13]验证了SADS-CoV能在来自人类呼吸道和胃肠道等原代细胞中有效复制,提示SADS-CoV在人类和动物群体中具有潜在的跨物种传播风险,所以预防和控制SADS-CoV的传播,具有极为重要的公共卫生意义[9,14]。
目前,SADS-CoV的检测方法主要有RT-PCR、间接ELISA、IFA、免疫组织化学(IHC)等[15],但至今尚未研制出针对SADS-CoV的特效药物和有效疫苗。考虑到感染该冠状病毒的仔猪具有极高的发病率和病死率,对养猪业造成极大的经济损失,因此在疫苗研发上市之前,SADS-CoV的早期诊断对其防控有着至关重要的作用。
鉴于SADS-CoV S1蛋白能够有效诱导宿主的免疫应答,是疫苗研制的关键蛋白。根据多克隆抗体血清具有周期较短、操作简单、成本较低、检测灵敏度高等优势[16],同时利用大肠杆菌原核表达系统繁殖快、抗污染能力强,表达产量高、分离纯化简单、稳定性良好等特点[17],本试验构建出了pGEX-6p-1-S1原核表达载体,优化诱导表达的条件后,利用GST凝胶纯化出了可溶性表达的S1重组蛋白,其大小为70 kDa。SDS-PAGE和Western blot试验结果表明S1重组蛋白可与SADS-CoV阳性血清发生特异性反应,并且具有较高的纯度和良好的反应原性。利用S1重组蛋白免疫BALB/c小鼠制备的多克隆抗体血清,Western blot和IFA结果显示其反应性和特异性良好。综上,本研究为进一步探索SADS-CoV S1蛋白功能及相关血清学检测方法的建立奠定了基础。

