猪萨佩罗病毒对仔猪的致病性
刘佳佳,李本强,陶 洁,石 迎,程靖华,乔长涛,刘惠莉*
(1.上海市农业科学院 畜牧兽医研究所/上海市农业遗传育种重点实验室,上海 201106;2.上海海洋大学 水产与生命学院,上海 201306;3.上海市种猪工程技术中心,上海 201106)
猪萨佩罗病毒(porcine sapelovirus,PSV)属于小RNA病毒科,萨佩罗病毒属,直径25~30 nm,病毒粒子呈微球状,为无囊膜的单股正链RNA病毒[1]。PSV全基因组7.5~8.3 kb,含有1个大的开放阅读框(ORF),编码1个长度约2 330个氨基酸的多聚蛋白前体,多聚蛋白前体随后被自身编码的蛋白酶裂解为4个结构蛋白(VP1、VP2、VP3、VP4)和7个非结构蛋白(2A、2B、2C、3A、3B、3C、3D)[2]。
1958年,英国首次报道PSV,目前该病毒已在全世界范围内流行[3]。2011年,LAN等[4]首次报道在我国猪场分离出PSV。近年来有较多PSV的研究报道[4-6]。仔猪感染PSV后临床主要引起腹泻、肺炎、脑脊髓灰质炎等症状[7-9]。PRODLALOV[7]报道,PSV存在无症状感染现象,且PSV无症状感染存在较高比例,这可能也是人们对PSV关注不高的原因。但近年发现PSV感染比例升高,且与猪流行性腹泻病毒、猪细小病毒、猪瘟病毒、猪星状病毒、猪肠道病毒等混合感染较为普遍,从而引起研究人员对PSV的关注[10-12]。2017-2019年华东地区临床猪腹泻样品检测发现PSV病原感染阳性率为3.87%[13]。董馨等[14]对宁夏不同区域猪场检测发现PSV猪场感染率为100%,且PSV总体平均阳性率达61.25%。在江西调查发现2018-2019年仔猪腹泻样品中PSV阳性率达11.22% (33/294)[15];此外,我国华南、华东、四川、湖南地区均有PSV感染的报道及相关研究,猪场阳性率高达46.39%[16-18],提示我国猪场PSV感染普遍存在。本团队自2015年开始,对上海及周边地区猪场腹泻病原进行监测,发现PSV阳性率上升趋势明显,2015年为15.87%,2019年为21.58%,2021年为34.11%,并分离到多种PSV病原[6]。
本研究建立了分离株SHCM2019感染仔猪模型,并对病毒感染后组织定位和致病变作用进行研究,为深入了解PSV在仔猪腹泻疾病中的作用提供参考依据。
1 材料与方法
1.1 病毒株与实验动物PSV毒株SHCM2019(GenBank登录号:MN685785)由上海市农业科学院畜牧兽医研究所分离、鉴定、保存。病毒由PK-15细胞扩增。5日龄仔猪购自江苏某猪场,健康状况良好,PSV抗体阴性。
1.2 主要试剂与仪器TRIzol试剂、PrimeScriptTMRT试剂盒、TB Green Premix Ex TaqTMⅡ试剂盒均购自TaKaRa公司;其他常规试剂均为分析纯。实时荧光定量PCR仪购自美国ABI公司;台式离心机购自上海宝赛生物科技有限公司。
1.3 试验分组与PSV感染将10头仔猪随机分为2组,试验组与对照组。试验组仔猪每头颈部肌肉注射5 mL(107TCID50/mL)病毒液,对照组注射等剂量DMEM,并进行隔离饲养。所有仔猪均保证充足饮水,喂料。
1.4 样品采集与检测每天统计仔猪腹泻、饮水、采食、体温、死亡等临床表征;采集仔猪粪便(肛拭子),检测排毒情况;腹泻后,继续观察2 d,症状不明显时剖检,采集仔猪各脏器(心脏、肝脏、脾脏、肺脏、肾脏、淋巴结)及肠组织(十二指肠、空肠、回肠),一部分组织样品用40%甲醛固定用于制作切片,HE染色;另一部分组织样品,液氮研磨后,利用荧光定量RT-PCR检测病毒含量。试验组与对照组仔猪分别在感染0,3,7,10,14 d采集抗凝血1 mL,分离外周血单核细胞。
1.5 RNA提取和反转录TRIzol法提取细胞总RNA,以总RNA为模板,参照PrimeScriptTMRT说明书进行基因组反转录,反转录合成的cDNA作为荧光定量RT-PCR模板。
1.6 引物和相对定量PCR实时荧光定量PCR引物信息参照文献[3,10]。荧光定量PCR反应体系:样品cDNA 1 μg、TB Green Premix Ex TaqTMⅡ 10 μL、ROX Reference DyeⅡ 0.4 μL、灭菌水7 μL,上、下游引物(10 μmol/L)各0.8 μL,共20 μL。每个样品3个重复孔,瞬间离心后,放入实时荧光定量PCR仪进行扩增。反应条件:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环。反应结束后先加热至95℃,然后降至60℃,开始以0.5℃/s递增至95℃检测荧光信号得出扩增产物的溶解曲线。以猪β-actin基因作为内参,将感染病毒前细胞因子表达量设为1倍。
1.7 数据分析采用SPSS 25.0软件对试验数据统计分析;各时间点之间采用F检验对数据进行差异显著性分析,P<0.05表示差异显著,每个试验重复3次,制图由Graphpad 5.0完成。
2 结果
2.1 临床观察每天测量猪只体温,试验组仔猪体温明显低于对照组(图1)。试验组4头仔猪出现腹泻症状,48 h死亡1头。剖检可看出肠管鼓气,肠壁变薄呈透明状,肠道内容物稀软;肺部肿胀,左肺尖叶有大面积出血;淋巴质地变软,严重充血(图2)。对照组仔猪临床表现正常,剖检肠道正常,内容物无异常。
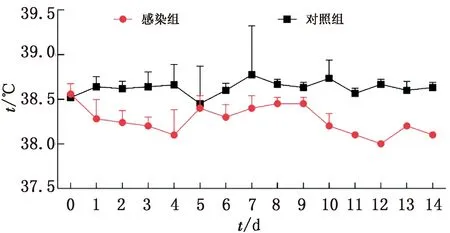
图1 体温监测

A.对照组肛门干净,无附着物;B.试验组肛门周围有粪便附着;C.对照组肠管厚实有弹性,内容物无异常;D.试验组肠管鼓气呈透明状;E.对照组肺正常;F.试验组肺部肿胀,左肺尖叶大面积出血;G.对照组淋巴正常;H.试验组淋巴肿胀充血
2.2 组织病毒载量测定采集临床腹泻症状明显的仔猪组织脏器,包括淋巴结、肺脏、十二指肠、空肠、回肠、盲肠、结肠、直肠等,利用实时荧光定量PCR技术检测病毒载量。试验组仔猪肠道及肺部病毒含量较高,且盲肠、结肠、直肠中的病毒含量略高,淋巴结病毒含量较低,心脏、肝脏、肾脏未检测到病毒核酸 (图3)。
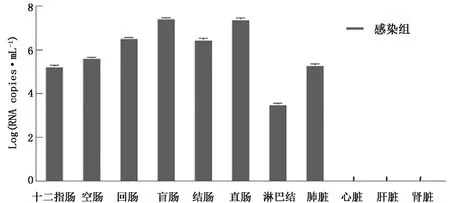
图3 组织病毒载量检测
2.3 组织病理学变化采集攻毒仔猪肠道及肺脏组织进行切片及HE染色。结果显示,试验组肺泡间隔增宽,肺泡壁增厚,肺泡壁毛细血管及肺间质血管高度扩张充血(图4B);盲肠局部黏膜上皮细胞坏死、脱落、部分变性,淋巴增生、炎性细胞浸润(图4D);直肠试验组黏膜上皮细胞脱落,有细胞变性、坏死、空泡化等特征,淋巴细胞增生、颗粒变性分不清(图4F)。

A.对照组肺泡间隔均匀;B.试验组肺泡间隔增宽,肺泡壁增厚;C.对照组盲肠正常;D.试验组盲肠炎症细胞浸润,大量红细胞聚集;E.对照组直肠正常;F.试验组直肠肠绒毛上皮细胞断裂脱落,固有层单核炎症细胞浸润
2.4 细胞因子检测采集仔猪外周血,检测细胞因子水平,发现试验组仔猪炎性因子与对照组比较均有升高。IL-1α在3 d时因子水平上升显著(P<0.05);IL-6在3 d升高显著,14 d表达水平均存在显著性差异(P<0.05)。IL-2表达水平在10 d后显著升高(P<0.05)。MX1在攻毒后表达持续上升,与对照组差异显著 (P<0.05) (图5)。结果显示,PSV感染仔猪,先诱导Th2型抗炎反应,刺激体液免疫应答;后期诱发Th1型细胞促炎性免疫反应,通过细胞免疫系统活化释放细胞因子对抗病毒;与MX1抗病毒因子表达规律一致,显示攻毒前期水平较低,后期持续升高,14 d达到最高水平,发挥炎性因子抗病毒效应。
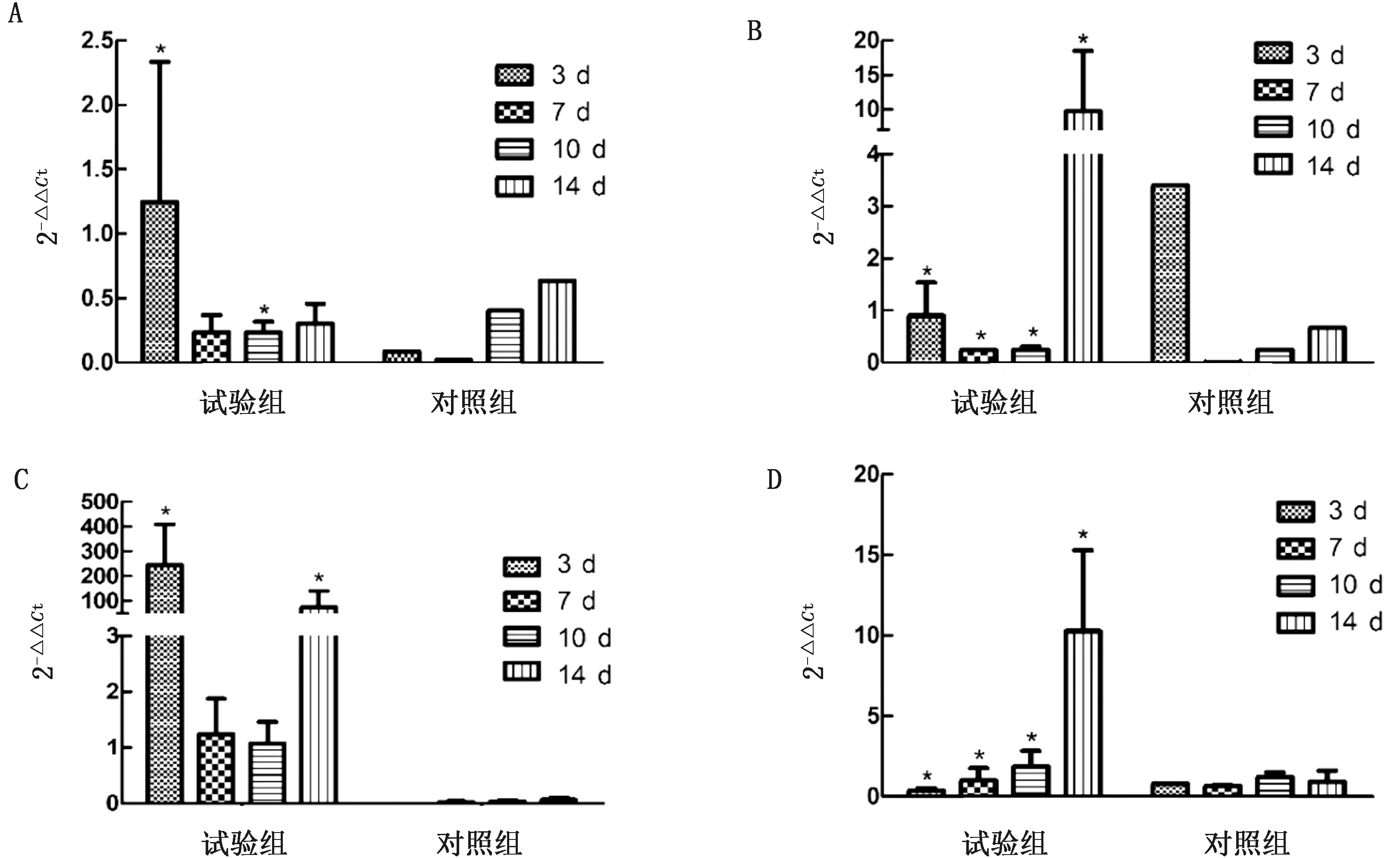
A.IL-1α;B.IL-2;C.IL-6;D.MX1。与0 dpi细胞因子水平比较,*表示差异显著(P<0.05)
3 讨论
对PSV致病性研究结果显示,PSV感染仔猪引起以腹泻为主的临床症状,还包括食欲减退、共济失调、精神迟钝、对外界环境刺激反应降低[19-20]。LAN等[4]用PSV感染断奶仔猪第2天出现腹泻及呼吸窘迫综合征,7 d出现脑脊髓灰质炎,表现为共济失调和双腿麻痹。本研究感染仔猪表现明显的腹泻症状,没有出现脑脊髓灰质炎,脑组织中也并未检测到PSV核酸,显示不同PSV毒株致病作用存在一定差异,或者与感染剂量有关,分离毒株SHCM2019感染仔猪导致体温下降,显示可能抑制了机体免疫应答。
肠黏膜是肠道病原感染和入侵的最外侧屏障,肠道病毒通过黏膜上皮细胞受体进入肠道上皮细胞,进而定植到相应的靶组织。研究发现PSV在感染仔猪肠道内各段均有分布,且病毒载量较高,表明PSV对肠道亲嗜性高。剖检也发现肠道病变最为明显,包括肠管肿胀且肠壁变薄,是典型的肠炎症状,与临床腹泻症状吻合。与前面报道一致的是,PSV可引起类似的肠道病变与肺部病变,如小肠和大肠黏膜增厚,回肠黏膜褶皱明显,形成纵向结节状结构或波纹;肺下叶部分实变,左肺上叶出现出血点[11,21]。
机体对PSV感染进行免疫应答的过程中,PBMC细胞群体及其分泌的白介素类细胞因子起着重要作用,是机体抵抗病毒感染的第一道防线。本研究中,IL-1α、IL-6在攻毒初期,表达水平显著升高,显示诱导Th2型免疫应答;10 d后IL-2水平显著提升,TH1型免疫反应激活。
由此可知,PSV攻毒仔猪,能诱导TH1、TH2型免疫应答,且先活化Th2型免疫反应刺激体液免疫应答,随后活化TH1型细胞免疫应答,发挥病毒杀灭作用。MX1是由Ⅰ型干扰素诱导宿主细胞产生的抗病毒蛋白,可在没有干扰素诱导蛋白时单独阻止病毒复制[22-23]。本研究PSV 感染仔猪后,MX1表达量逐渐升高,以应对病毒感染,发挥其抗病毒效应。
本研究证实仔猪感染SHCM2019分离株后,仔猪出现明显腹泻症状,并出现死亡,病毒感染的主要靶器官为肠道、肺脏及淋巴结。剖检可见明显的肠道病变、肺部病变以及淋巴结质地充血变软。PSV感染仔猪后同时激活体内TH1和TH2型细胞免疫反应。

