PD-1 抑制剂联合化疗治疗晚期胃癌的临床效果及毒副反应分析
汤巧云 高义玲
恶性肿瘤对人类健康水平产生严重影响,属于恶性疾病,研究数据表明,恶性肿瘤患者数量不断增多,其有效诊断与治疗成为临床研究的重点[1]。胃癌作为恶性肿瘤,具有发病迅速、起病隐匿等特点,侵袭性强,在早期无明显症状,在发现时多为中晚期,错过最佳治疗时间。晚期胃癌患者若无法实施手术治疗或者术后复发,可实施系统化疗,其中一线治疗方案为以铂类、氟尿嘧啶为基础的化疗方案,生存时间约为8~11 个月[2]。免疫治疗是指通过将自体防御机制激活或者采用外源性物质进行机体调节从而作用于肿瘤的方法,能够刺激机体发生免疫反应,从而将肿瘤细胞杀伤。当前,临床关于免疫检查点抑制剂的研究最多,该抑制剂包含两种,分别为细胞毒性T 淋巴细胞相关抗原4 抑制剂、PD-1 与配体抑制剂。本院在晚期人表皮生长因子受体-2(HER2)阴性胃癌患者的治疗中采用PD-1抑制剂联合放化疗取得一定效果,详细报告如下。
1 资料与方法
1.1 一般资料 选取2018 年8 月~2022 年8 月本院收治的70 例晚期胃癌患者为研究对象,根据治疗方法不同分为参照组及研究组,每组35 例。参照组男17 例,女18 例;年龄32~74 岁,平均年龄(56.18±5.82)岁;Ⅲ期、Ⅳ期分别为5、30 例;病理类型:HER2 阴性,腺癌。研究组男16 例,女19 例;年龄42~62 岁,平均年龄(56.18±5.82)岁;Ⅲ期、Ⅳ期分别为4、31 例;病理类型:HER2 阴性,腺癌。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准[4]:以国际妇产科联盟(FIGO)分期标准为依据,分期为Ⅲ~Ⅳ期;卡氏功能状态量表(KPS)评分>70 分;实施放化疗;资料齐全;认知正常;熟知本研究,自愿参加。排除标准:精神异常;其他恶性肿瘤;血液系统疾病,输血治疗者;全身感染;资料不全;免疫性疾病;依从性差。
1.2 方法
1.2.1 参照组 实施化疗治疗:一线化疗采用奥沙利铂、卡培他滨方案化疗,第1 天,取奥沙利铂静脉滴注,130 mg/m2;口服卡培他滨,2 次/d,1000 mg/m2,持续用药14 d;二线及以上化疗采用白蛋白结合型紫杉醇+替吉奥5-氟尿嘧啶(5-FU)方案化疗:第1、8 天,取白蛋白结合型紫杉醇静脉滴注,120 mg/m2;口服替吉奥,2 次/d,40 mg/m2,持续用药14 d。
1.2.2 研究组 实施化疗联合PD-1 抑制剂治疗:化疗方案与参照组相同,在各化疗周期的第1 天,取PD-1 抑制剂静脉滴注,采用信迪利单抗注射液[信达生物制药(苏州)有限公司,国药准字S20180016]200 mg/次,或者替雷利珠单抗注射液[勃林格殷格翰生物药业(中国)有限公司,国药准字S20190045]200 mg/次。所有患者每2 个周期进行1 次评估。
1.3 观察指标及判定标准 ①比较两组疾病控制率。病灶完全消失,无新病灶,且肿瘤标记物水平正常,即为完全缓解;肿瘤体积缩小>30%,即为部分缓解;肿瘤体积缩小25%~30%,即为病情稳定;不满足以上情况,即为病情进展。疾病控制率=(完全缓解+部分缓解)/总例数×100%。②比较两组免疫功能。抽取患者静脉血,检测免疫功能指标,包括IgA、CD4/CD8水平。③比较两组肿瘤标志物,包括CA199、CEA 及CA125 水平。④统计并比较两组毒副反应发生情况,包括骨髓抑制、皮疹、腹泻、高血糖、甲减。
1.4 统计学方法 采用SPSS20.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者疾病控制率比较 研究组疾病控制率80.00%明显高于参照组的57.14%,差异有统计学意义(P<0.05)。见表1。

表1 两组患者疾病控制率比较[n(%)]
2.2 两组患者免疫功能比较 治疗前,两组患者IgA、CD4+/CD8+比较,差异无统计学意义(P>0.05);治疗后,两组患者IgA、CD4+/CD8+均低于本组治疗前,但研究组患者IgA、CD4+/CD8+均高于参照组,差异具有统计学意义(P<0.05)。见表2。
表2 两组患者免疫功能比较()
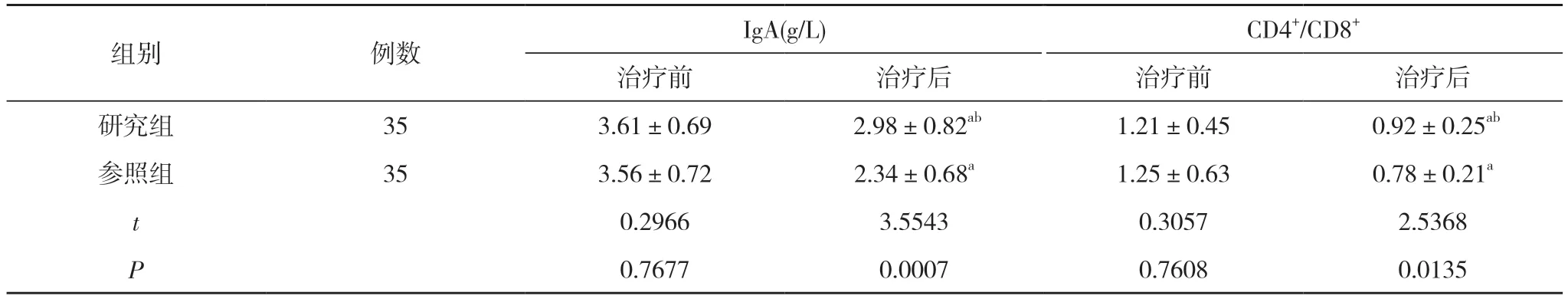
表2 两组患者免疫功能比较()
注:与本组治疗前比较,aP<0.05;与参照组治疗后比较,bP<0.05
2.3 两组患者肿瘤标志物比较 治疗前,两组患者CEA、CA199、CA125 比较,差异无统计学意义(P>0.05);治疗后,研究组患者CEA(4.17±1.64)ng/ml、CA199(31.81±7.56)U/ml、CA125(18.16±4.98)U/ml 均低于参照组的(14.32±3.73)ng/ml、(41.27±6.73)U/ml、(28.17±4.87)U/ml,差异具有统计学意义(P<0.05)。见表3。
表3 两组患者肿瘤标志物比较()

表3 两组患者肿瘤标志物比较()
注:与参照组治疗后比较,aP<0.05
2.4 两组患者毒副反应发生情况比较 两组患者骨髓抑制、皮疹、腹泻、高血糖、甲减发生率比较,差异无统计学意义(P>0.05)。见表4。
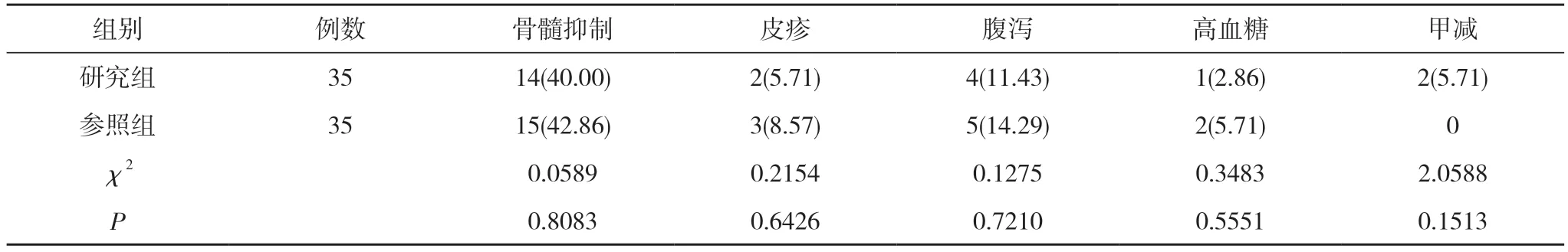
表4 两组患者毒副反应发生情况比较[n(%)]
3 讨论
胃癌常用治疗方法包括中医治疗、手术治疗、药物治疗、化疗、放疗等,其中放疗为胃癌首选治疗方案,然而,该治疗方式存在毒副作用,极易引起白细胞减少、胃肠道不适等情况[3]。化疗为胃癌常用治疗方案之一,对放疗引起细胞损伤有效抑制,促使化疗敏感性差细胞数量降低,且在肿瘤不同周期均可发挥作用[4,5]。然而,化疗在治疗疾病同时,还存在多种毒副反应,给患者带来痛苦,在长期治疗过程中,极易出现抗拒治疗情绪,降低依从性,影响后续治疗。当前,我国进入了精准治疗时代,且随着免疫治疗、靶向治疗等兴起,使得晚期癌症患者的治疗方式呈多元化发展,人们通过联合多种方式治疗提高生存率,改善预后效果。
免疫治疗是指通过将自体防御机制激活或者采用外源性物质进行机体调节从而作用于肿瘤的方法,能够刺激机体发生免疫反应,从而将肿瘤细胞杀伤[6]。当前,临床关于免疫检查点抑制剂的研究最多,该抑制剂包含两种,分别为细胞毒性T 淋巴细胞相关抗原4 抑制剂、PD-1 与配体抑制剂[7]。在PD-1 与配体抑制剂被提出以后,临床学者针对其效果开展研究,如杨珂[8]将PD-1 与配体抑制剂用于非小细胞肺癌患者的治疗,提出了PD-1 与细胞程序性死亡-配体1(PDL1)信号通路抑制剂能够有效提高非小细胞肺癌者应答率。随着现代医学水平的提升,也随着肿瘤治疗得到了更深入的研究,免疫制剂也投入到了胃癌的临床应用中[9]。潘利[10]研究指出,纳武利尤单抗(Nivolumab)属于一种单克隆抗体,是针对PD-1 型抑制剂类药物,在胃癌晚期患者治疗中与PD-1 受体相结合,抑制其和配体间的作用,从而阻断其通路引导的肿瘤免疫反应。提示PD-1 抑制剂在晚期胃癌患者的治疗中能取得一定效果。但部分患者单独应用免疫检查点抑制剂治疗效果不理想,可通过联合化疗改善预后效果。PD-1 是一种Ⅰ型跨膜蛋白,所含氨基酸共计288 个,最初是在凋亡小鼠T 细胞杂交瘤中克隆而来,以激活B 细胞、T 细胞为主要表达。机体重量微环境能引起浸润T 细胞的PD-1 分子呈高表达状态,持续激活PD-1 通路,从而引起T 细胞耐受性与活化,以及免疫病理学负调节[11]。当前,临床使用的PD-1 免疫检查点抑制剂与PD-L1 免疫检查点抑制剂包括信迪利单抗、替雷利珠单抗、卡瑞利珠单抗等,与单纯化疗相比,联合抑制剂治疗的患者生存期、疾病缓解率均明显改善。研究[12]指出,晚期胃癌患者单独应用化疗时中位生存期为13.9 个月,联合免疫治疗时中位生存期为18.6 个月。可见化疗联合免疫治疗在晚期胃癌患者的治疗中效果显著。
本次研究中,研究组患者应用PD-1 抑制剂联合化疗治疗,参照组患者仅应用化疗治疗,结果显示,研究组疾病控制率明显高于参照组,差异具有统计学意义(P<0.05)。提示了PD-1 抑制剂联合化疗可有效提高疾病控制率。分析其原因是PD-1 抑制剂通过阻断PD-1 与配体的互相作用,继而对该通路的免疫抑制反应阻断,改善治疗效果[13]。本研究结果显示,治疗后,两组患者IgA、CD4+/CD8+均低于本组治疗前,但研究组患者IgA、CD4+/CD8+均高于参照组,差异具有统计学意义(P<0.05)。提示PD-1 抑制剂联合化疗可有效减轻患者的免疫抑制。有学者提出,PD-1 抑制剂联合化疗能提高晚期胃癌患者的 CD3+、CD4+水平,也提示PD-1 抑制剂联合化疗提高了晚期胃癌患者的免疫功能[14]。在人体免疫答应中,T 淋巴细胞具有重要地位,并参与肿瘤的发生与发展,积极有效提高患者的免疫功能,可促进其恢复[15]。本研究中,两组患者骨髓抑制、皮疹、腹泻、高血糖、甲减发生率比较,差异无统计学意义(P>0.05)。证实了胃癌患者采用PD-1 抑制剂联合化疗具有较高安全性。
CA199 属于糖蛋白,分布于胰腺、肠、胃等组织上皮,为胰腺癌、直肠癌标志物[12]。CEA 是胚层上皮组织细胞糖蛋白,一般情况下水平很低,在发生肿瘤时其水平逐渐升高,被视为大肠癌、胃癌、胃癌诊断标志物之一[16]。CA125 属于糖蛋白性肿瘤相关抗原,存在于肿瘤上皮细胞,当患者患子宫内膜癌、卵巢癌时,CA125 水平明显升高。在胃癌、卵巢癌、胰腺癌等恶性肿瘤中,CA153、CA125 也具有一定阳性率[17]。本次研究结果可见,治疗后,研究组患者CEA(4.17±1.64)ng/ml、CA199(31.81±7.56)U/ml、CA125(18.16±4.98)U/ml 均低于参照组的(14.32±3.73)ng/ml、(41.27±6.73)U/ml、(28.17±4.87)U/ml,差异具有统计学意义(P<0.05)。说明胃癌患者采用PD-1 抑制剂联合化疗治疗,肿瘤标志物水平明显降低。
尽管晚期胃癌患者采用PD-1 抑制剂联合化疗效果显著,但治疗中伴随多种毒副反应,如骨髓抑制、局部放射性黏膜炎等,给患者带来痛苦,因此应当重视护理干预,通过实施综合护理干预,包括心理干预、健康教育、饮食干预、体征变化、用药指导等,有效促进治疗,缓解临床症状,详细如下。①心理干预:从患者确诊第1 天起,便对其进行认知行为干预及支持,依据患者的年龄、文化程度、心理评估结果等制定不同的心理干预方案。心里干预2 次/周,20~30 min/次。②纠正患者生活行为,告知患者每天坚持进行有氧运动,25 min/次,同时强调作息规律及膳食结构合理的重要性,叮嘱患者摄入新鲜的及维生素与膳食纤维含量高的食物,饮食注意清淡,多饮水并且少食多餐。③开展健康宣教工作,在患者确诊后立即组织其参与疾病知识宣教座谈会或视频讲座,在组织宣教语言时,注重将医学专业化语言转化为日常交流性语言,使患者对疾病知识有更深入的理解,从患者及其家属的角度剖析疾病知识,使患者及其家属对疾病进展、并发症预防、临床干预手段有更全面的认知。④胃肠道功能护理:给予饮食指导,进食易消化、清淡的食物,避免腹胀感加重。为患者营造一个舒适、安静的病房环境,采用转移法缓解患者疼痛程度,缓解不适感。若患者伴随恶心现象,需及时使用止吐药物治疗,以及呼吸新鲜空气、散步等方式转移注意力;若患者发生呕吐,指导患者保持侧卧位,在呕吐以后及时漱口,对口腔进行清洁。
综上所述,晚期胃癌患者采用PD-1 抑制剂联合化疗,可缓解临床症状,减轻免疫抑制,且疾病控制率有效提高,毒副反应少,安全性高,治疗效果显著。

