多灶性分支型胰腺导管内乳头状黏液性肿瘤行全胰切除术一例
王振圣,崔云甫,李春龙
(哈尔滨医科大学附属第二医院 普通外科一病房,黑龙江 哈尔滨 150086)
胰腺导管内乳头状黏液性肿瘤是具有一定恶变潜能的胰腺囊性肿瘤,通常被认为是胰腺导管腺癌的癌前病变。其发病率约为1/10 万,多为单发,其中多发病变约占20%~41%。相对于混合型胰腺导管内乳头状黏液性肿瘤,多灶性分支型胰腺导管内乳头状黏液性瘤的病例更为少见。本例患者病变广泛分布于全胰,其中胰头部肿物直径>3 cm,及时手术探查是防止其恶变的有效手段。全胰切除风险大,术后并发症多,术后生活质量下降明显,常成为谨慎选择该术式主要困难。随着围手术期护理的加强及健康宣教的普及,胰腺内外分泌功能的缺失可以通过外源性进行有效补充。综合患者的诊断资料及具体情况,进行必要的手术干预,尽可能使患者获得最大受益,现报道如下。
病例
患者女性,60岁,因“间断性上腹胀2个月余”于2022年2月14日收住哈尔滨医科大学附属第二医院。患者2个月前无明显诱因出现上腹部胀,伴嗳气,进食后明显,间断性发作,食欲较前差,无反酸烧心,无恶心呕吐,无腹痛腹泻,无低热乏力,大小便如常,近期体重未见明显减轻。既往阑尾切除术史30 年,输卵管结扎术史40 年;无肝炎、高血压、冠心病以及糖尿病等疾病史。入院查体一般状态较好,无皮肤巩膜黄染,浅表淋巴结未及肿大。腹平坦、软,无压痛,未及明显肿块。入院后完善相关检验:血常规、生化系列、肿瘤系列、糖化血红蛋白以及免疫球蛋白亚类等检验结果均在正常参考范围。
影像学检查:三维超声(肝胆脾胰):胰头可见34 mm×18 mm混合性占位,边界欠清晰,形态不规则,呈花瓣状,内可见光带分隔,部分为囊性回声,胰尾也可见24 mm×17 mm混合性占位,边界欠清晰,形态不规则,内可见光带分隔,部分为囊性回声,其余胰腺实质回声均匀,胰管扩张,内径4 mm。胰腺增强CT:胰腺体尾部低密度结节大小26 mm×16 mm,增强的CT值34~37 Hu;胰腺头部低密度结节,大小12 mm×16 mm,增强的CT值31~34 Hu(图1)。磁共振水成像:胆道系统未见明显扩张;胰头及胰体尾多发长T2信号,与主胰管关系密切(图2)。临床诊断为胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasms,IPMN)。

图1 术前胰腺增强CT

图2 术前磁共振水成像
充分术前准备后,患者于2022年2月22日在全麻下行全胰十二指肠切除术。手术完整切除幽门及远端胃体大部、十二指肠、近段空肠、胆囊、胆总管、全胰、脾脏以及周围淋巴结,之后行胆管空肠吻合以及胃空肠吻合重建消化道。术中可见胰腺多发囊性肿物,较大者位于胰腺头部及体尾部(图3、图4)。术后诊断为:多灶性分支型胰腺导管内乳头状黏液性肿瘤。手术顺利,术后患者安返病房。给予抗感染、镇痛、抑酸、静脉营养支持等对症治疗,并监测患者生命体征及血糖变化。
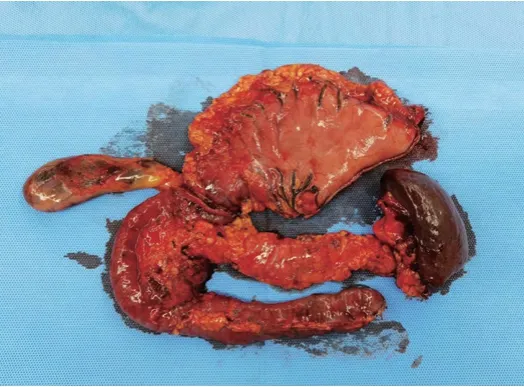
图3 术后病理标本整体图

图4 术后病理标本剖面图
术后病理(图5)结果:胰腺导管内乳头状黏液性肿瘤(IPMN)(分支胰管型)伴中度异型增生。冰冻送(胰腺断端)见病变,十二指肠乳头无著变,胃断端(-),十二指肠断端(-),肝总管断端(-),胰腺周围淋巴结反应性增生(2枚),胃大弯反应性增生(6枚),(第8A组,第9组,第11组)淋巴结反应性增生(分别为2枚,5枚,2枚)。
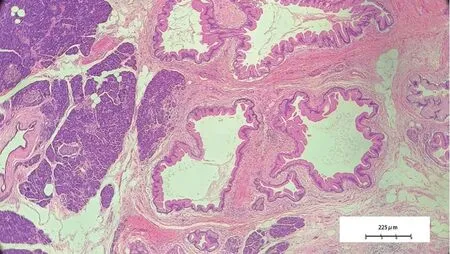
图5 术后病理切片(HE,×40)
术后给予肠外营养(卡文1 440 mL+诺和灵24 IU),采用胰岛素泵(诺和灵30 IU+生理盐水50 mL)调控血糖,每1~2 h监测指尖血糖,依据血糖调整泵速。术后首次血糖为22.8 mmol/L,后逐步控制血糖范围稳定在7.0~10.0 mmol/L。恢复肠内营养后,给予长效胰岛素诺和达12 IU临睡前皮下注射,24 h血糖波动范围控制在6.0~16.3 mmol/L,未出现低血糖。
术后3个月随访,患者血糖控制较稳定,无腹胀腹痛、脂肪泄等消化不良表现,无复发及转移,体重增加约2.5 kg。
讨论
IPMN是起源于胰腺导管上皮细胞具有恶变潜能的的胰腺囊性肿瘤,根据胰管受累情况可将IPMN分为主胰管型IPMN(main duct IPMN,MD-IPMN)及分支型IPMN(branch duct IPMN,BD-IPMN),若主胰管和分支胰管同时受累则称之为混合型IPMN(mixed type IPMN,MT-IPMN)。有研究发现,未癌变的IPMN患者10年生存率超过95%,一旦发生侵袭性癌变,5年总生存率不到前者一半[1]。因此在阐明IPMN的真正生物学性质、准确估计进展时间以及建立更准确的循证指南之前,不宜一味观察等待,在发生恶性转化之前及时切除是治疗IPMN最有效的办法。其中MD-IPMN和MT-IPMN恶变风险较高[2-3],一旦临床诊断为MD-IPMN/MT-IPMN,无论有无临床表现、肿瘤大小与位置,均建议尽早手术治疗,且要求手术切缘阴性[4]。而目前,对于低度恶性潜能的BD-IPMN的手术指征仍存在争议。根据仙台共识指南:BD-IPMN可进行保守治疗,但当肿瘤直径>3 cm、扩张胰管直径>6 mm、存在壁结节等固体物质或囊液细胞学呈阳性时,则建议切除[5]。而来自欧洲和美国的两项研究表明即使是小的、静止的BD-IPMN病变也可能存在不可忽视的恶性疾病风险[6]。因此目前有较多专家认为,对于BD-IPMN患者应适当放宽手术指征:对于年轻且身体状况尚可的患者,应尽早行手术治疗;对于年老、身体状况较差,且无法耐受手术的患者可定期观察,必要时行内镜治疗[1,4,7]。
手术方式的选择通常依据肿物的位置、范围、性质及与周围脏器的关系。近年来,随着外科技术和围手术期管理水平的提高,以及新型胰岛素制剂和胰酶制剂的广泛使用,全胰切除术在治疗胰腺疾病中的价值得到重新重视。目前,关于全胰切除术的适应证尚无统一标准,根据文献报道主要包括:(1)多灶性、弥漫性IPMN;(2)多中心或广泛浸润胰腺神经内分泌肿瘤;(3)胰腺癌(胰腺颈体部癌、全胰癌、术中胰颈切缘阳性需扩大胰腺切除范围、胰腺切除术后复发);(4)预防性全胰腺切除(高危胰瘘、高风险的家族性胰腺癌);(5)胰十二指肠切除术后胰肠吻合口发生严重胰瘘导致脓肿或出血,需二次手术者;(6)终末期慢性胰腺炎疼痛难以忍受者等[8-10]。本例患者为中年女性,身体状况可,病灶多发,胰头及体尾部均有分布,肿瘤直径>3.0 cm,因此全胰十二指肠切除术是首选治疗。
全胰十二指肠切除术后血糖范围波动较大,常以交替发生高血糖及低血糖作为其独特性并发症[11]。围术期常以高血糖为主;度过围手术应激期,随着肠内营养逐步恢复及使用胰岛素皮下注射后,常以反复发生的低血糖为主[12],定期监测并控制血糖波动成为了术后护理的重点。本病例采用指尖血糖测定进行血糖监测,高频率的监测虽然有利于调整胰岛素泵速从而控制患者的血糖波动,但这无疑增加了患者的痛苦体验,对患者的休息质量造成了一定的影响。因此未来连续血糖监测和闭合胰岛素泵的进一步研究或许可以使这一问题得到解决[13]。
BD-IPMN是一种恶性程度较低的胰腺囊性肿瘤,在选择治疗方案时,应适当放宽手术指征。对于多灶或弥漫性的IPMN,评估患者身体条件后应及时行全胰切除术。术后血糖波动及术后消化功能改变应当在术前对家属及患者进行充分宣教及训练,以提高患者生活质量。

