大豆GmPDAT1 参与油脂合成和非生物胁迫应答的功能分析
苗淑楠 高宇 李昕儒 蔡桂萍 张飞 薛金爱 季春丽 李润植
(山西农业大学农学院,太谷 030801)
大豆(Glycine max)是世界范围内重要的粮油作物和工业原料[1-2]。随着全球生态环境的恶化,低温、高盐和干旱等非生物胁迫制约大豆生产日趋严重。因此,解析大豆油脂合成及抗逆性分子机制对大豆产量、品质及抗逆性的遗传改良和可持续生产具有重要的意义。
植物油脂主要以三酰甘油(triacylglycerol,TAG)的形式贮藏于种子中[3]。植物贮藏油脂合成包括脂肪酸从头合成和三酰甘油的合成。植物合成TAG 有2 种途径:一种是依赖酰基-CoA 的Kennedy 途径[4];另一种是不依赖酰基-CoA 的合成途径。在后者中,磷脂:二酰甘油酰基转移酶(phospholipid: diacylglycerol acyltransferase, PDAT)能将磷脂(phospholipids, PC)分子中的酰基转移到二酰甘油(diacylglycerol, DAG)分子的sn-3 位碳原子上,进而合成TAG[5-6]。最早在酿酒酵母鉴定获得PDAT基因,迄今已从拟南芥(Arabidopsis thaliana)[7]、油茶(Camellia oleifera)[8]、亚麻(Linum usitatissimum)[9]、油菜(Brassica napus)[10-11]、花生(Arachis hypogaea)[12]、 向日 葵(Helianthus annuus)[13]、大豆(Glycine max)[14]、橄榄果(Olea europaea)[15]和一些藻类[16]等植物中克隆到PDAT基因并鉴定其功能。已有研究显示来自不同物种PDAT基因的功能以及编码的酶蛋白活性存在差异。Zhang 等[17]在拟南芥Atpdat1突变体中用RNAi 抑制AtPDAT1表达时,种子油含量降低70%,而沉默AtPDAT2未导致种子油含量降低,表明AtPDAT1参与种子油脂合成积累。相似地,在拟南芥叶片中过表达AtPDAT1导致油含量升高和脂肪酸组成改变[7]。与AtPDAT1 相比,拟南芥AtPDAT2[17]、蓖麻(Ricinuscommunis)RcPDAT2[18]和亚麻LuPDAT6[8](PDAT2同系物)均不参与TAG 的合成。另有研究显示,PDAT 也参与植物非生物胁迫响应。Yuan 等[19]发现亚麻荠(Camelina sativa)不同PDAT 成员分别参与亚麻荠幼苗低温、干旱和盐胁迫的应答。Mueller等[20]发现拟南芥pdat突变体在高温胁迫后无法积累TAG。Demski 等[21]在拟南芥中过表达PDAT1,增强了植物对冷热胁迫的适应性,延缓了植物衰老进程。
目前,关于大豆PDAT家族成员的功能以及是否参与胁迫应答尚不清楚。本研究基于组学分析,全基因组鉴定大豆GmPDAT1家族成员、GmPDAT1基因结构和启动子顺式作用元件,预测GmPDAT1蛋白功能结构域、理化性质、高级结构及系统发育。通过荧光定量PCR,分析GmPDAT1基因家族各成员在大豆不同组织的表达模式,特别是在大豆低温、高盐和干旱等非生物胁迫下表达谱。应用酵母TAG缺陷型突变体功能互补测试体系,分析GmPDAT1催化TAG 合成的生物学功能,为全面解析大豆GmPDAT1 成员精准生物学功能奠定基础,亦为植物油脂代谢和抗逆性遗传改良提供新的科学根据。
1 材料与方法
1.1 材料
试验选用大豆品种Jack,种植于山西农业大学农作站试验基地,分别选取大豆根、茎、叶、花、豆荚和种子,液氮速冻后置于-80℃保存备用。
选取发育良好、长势一致、展开至2 片真叶的大豆幼苗,于Hoagland 营养液中进行胁迫处理。分别用4℃、250 mmol/L NaCl、20% PEG 处理大豆幼苗,于光照16 h/黑暗8 h 的环境下培养48 h。分别取0、3、6、9、12、24 和48 h 的真叶作为检测材料,液氮速冻后置于-80℃保存备用,设置3 个生物重复。
1.2 方法
1.2.1 大豆GmPDAT1基因家族生物信息学分析 以来自拟南芥数据库(https://www.arabidopsis.org/)的AtPDAT1(AT5G13640.1)为索引序列,在Phyto zome v13 大豆基因组(https://phytozome.jgi.doe.gov/pz/portal.html)中进行Blast 分析,全基因组鉴定大豆GmPDAT1家族成员。利用NCBI 数据库的在线工具CDD(https://www.ncbi.nlmnih.gov/structure/cdd/wrpsb.cgi)对GmPDAT1 蛋白的保守结构域进行分析;利用MEME(http://memesuite.org/index.html) 预 测GmPDAT1 的Motif;利 用TBtools 软件分析GmPDAT1基因结构;通过ProtParam 在线分 析 软 件(https//web.expasy.org/protparam/) 分 析GmPDAT1 的理化性质;利用TMHM(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白跨膜结构预测;利用SOPMA 在线分析软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质二级结构,利用SWISS-MDEL 在线分析软件(https://swissmodel.expasy.org/interactive)构建蛋白质三级结构模型;使用Genedoc 软件进行多序列比对分析;使用MEGA 11.0 软件进行系统发育树的构建;利用PlantCARE 数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对GmPDAT1启动子顺势作用元件进行分析。
1.2.2 总RNA 提取及RT-qPCR 使用植物RNA 快速提取试剂盒(Aidlab 公司)提取正常培养条件下大豆不同组织和3 种非生物胁迫处里后各时间段的大豆幼苗RNA,反转录成cDNA(采用Genstar 公司的反转录试剂盒)。利用Primer 6.0 设计荧光定量引物(表1),选用GmActin为内参基因。荧光定量采用TaKaRa 的体系,反应程序为95℃ 30 s;95℃ 5 s,57℃ 30 s,39 个循环。
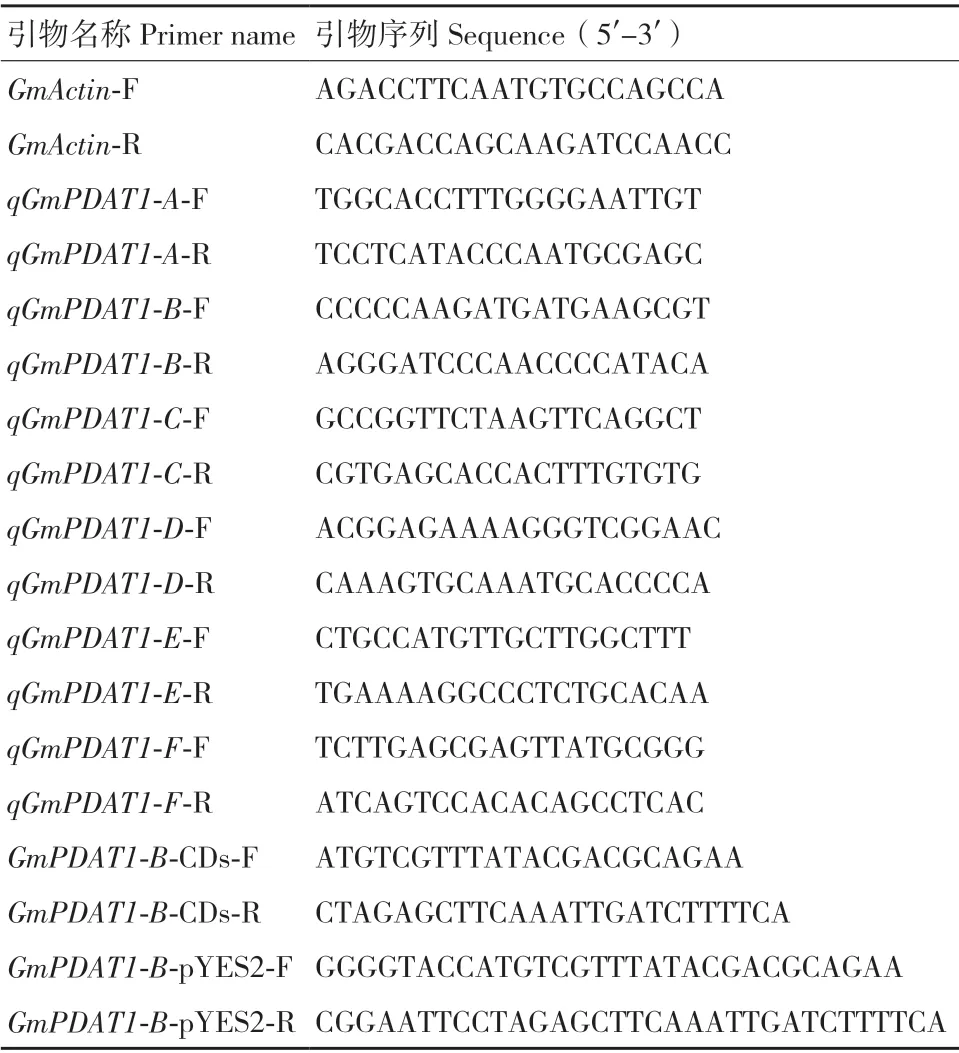
表1 引物信息Table 1 Primer information
1.2.3GmPDAT1-B的克隆 设计特异性引物扩增GmPDAT1-B的CDS 全长,程序为94℃ 2 min;94℃15 s,68℃ 45 s,68℃ 2 min,35 个 循 环;68℃ 5 min。将扩增获得的目标序列与pMD18-T 载体连接,送至擎科生物科技有限公司进行测序,鉴定获得正确的GmPDAT1-B编码序列克隆。
1.2.4 大豆GmPDAT1-B酵母表达载体的构建与转化设计带有酶切位点KpnI 和EcoR I 的扩增引物,将GmPDAT1-B亚克隆至酵母表达载体pYES2上。用醋酸锂(LiAc)转化法将重组质粒pYES2-GmPDAT1-B转化至酿酒酵母(Saccharomyces cerevisiae)TAG 缺陷型突变株H1246,使用SC-Ura(2%葡萄糖)固体培养基进行筛选,挑取单菌落进行阳性转化株检测。利用氯仿甲醇法提取酵母细胞总脂,具体步骤及油脂含量计算参考周雅莉等[22]方法,然后进行薄层层析(thin layer chromatography,TLC)分析。
2 结果
2.1 GmPDAT1的基因结构分析
以拟南芥AtPDAT1 蛋白序列为索引序列,在大豆基因组中进行BLAST 比对,共检测到6 个大豆GmPDAT1基因家族成员,分别命名为GmPDAT1-A(Glyma.17G051300.1)、GmPDAT1-B(Glyma.13G10 8100.1)、GmPDAT1-C(Glyma.07G036400.1)、GmPDAT1-D(Glyma.16G005800.1)、GmPDAT1-E(Glyma.12G084000.1)和GmPDAT1-F(Glyma.11G190400.1)。这6 个基因的蛋白和拟南芥AtPDAT1 蛋白都属于PLN02517 超家族成员,具有典型的磷脂酰胆碱-甾醇O-酰基转移酶结构域。利用MEME 对AtPDAT1和GmPDAT1 蛋白进行Motif 预测,结果(图1-A)显示,6 个大豆GmPDAT1 蛋白与拟南芥AtPDAT1 蛋白的Motif 的数量和位置基本相同,具有高度保守性。基因结构(图1-B)所示,GmPDAT1-A、GmPDAT1-B、GmPDAT1-C、GmPDAT1-D和GmPDAT1-E与AtP-DAT1类似,均含有6 个外显子,且具有5′和3′非编码区,GmPDAT1-F具有8 个外显子,不具有非编码区。
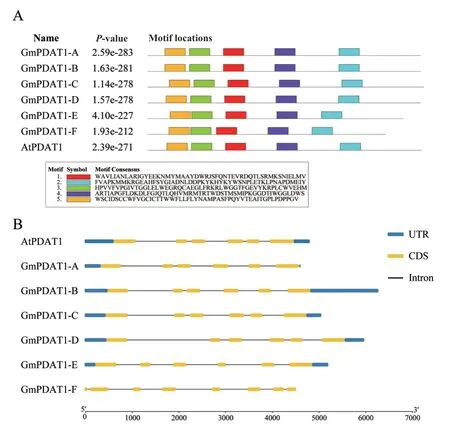
图1 GmPDAT1 和AtPDAT1 蛋白Motif 预测(A)和基因结构(B)分析Fig. 1 Motif prediction(A)and gene structure(B)analysis of GmPDAT1 and AtPDAT1 proteins
2.2 GmPDAT1蛋白的理化性质和高级结构分析
通过Protparam(https//web.expasy.org/protparam/)和TMHM(https//web.expasy.org/protparam/)在线分析软件预测大豆GmPDAT1和拟南芥AtPDAT1编码的蛋白质氨基酸组成、理化性质及蛋白跨膜结构,结果(表2)显示,这些蛋白长度介于582-676 aa,理论等电点(pI)5.91-8.59,亲水性系数均为负值,为亲水性蛋白。预测的蛋白不稳定系数均为36.12-44.95,为不稳定蛋白。GmPDAT1 和AtPDAT1 显示具有跨膜结构域,短的亲水性N 端面向细胞质基质,大部分C 端位于膜内。
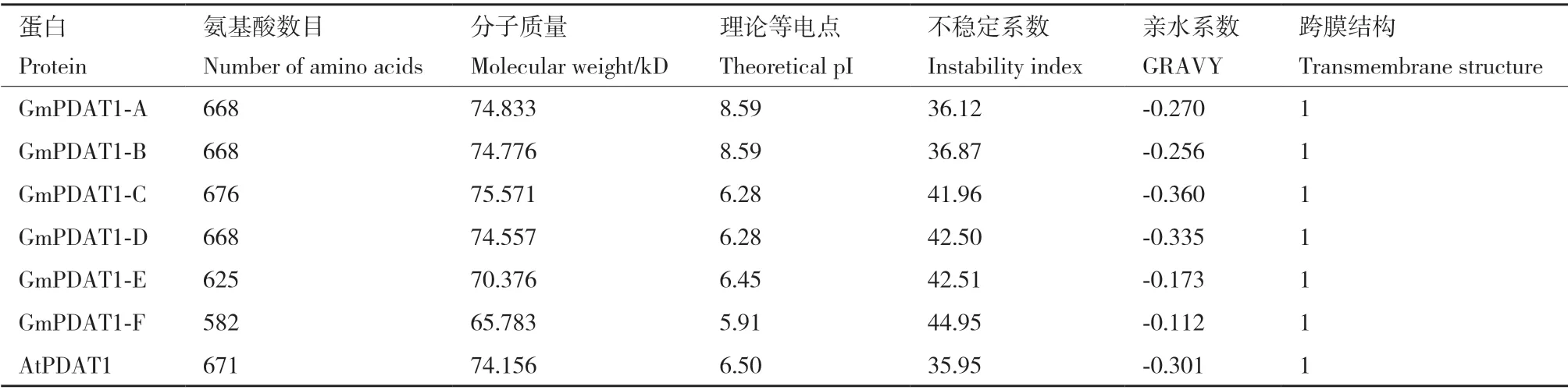
表2 大豆 Gm PDAT1 蛋白质理化性质Table 2 Physicochemical properties of GmPDAT1 proteins in G. max
二级结构预测结果表明,GmPDAT1 和AtPDAT1 蛋白主要是由α 螺旋、延伸链、β 转角和无规则卷曲组成,其中,α 螺旋和无规则卷曲占比较高,α 螺旋占比为34.43%-41.07%,无规则卷曲占比为45.51%-37.11%,β-转角占比小,为5.18%-6.72%(图2-A),说明α 螺旋和无规则卷曲是主要组成构件。以溶酶体磷脂酶A2 为模板进行三级结构蛋白质建模显示,大豆GmPDAT1-A、GmPDAT1-B、GmPDAT1-C、GmPDAT1-D、GmPDAT1-E、GmPDAT1-F蛋白氨基酸序列与模板相似度分别为24.44%、25.45%、26.94%、26.36%、24.79% 和23.08%( 图2-B)。预示这6 个来自大豆的GmPDAT1 蛋白可能具有AtPDAT1 的功能。
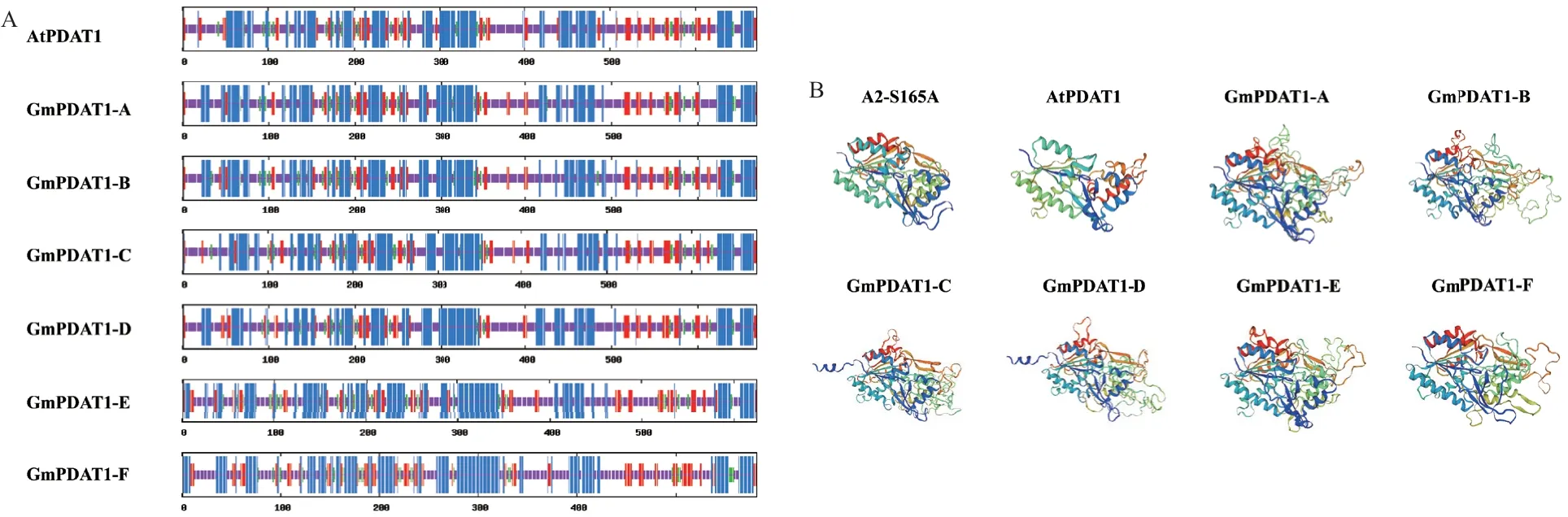
图2 大豆GmPDAT1 蛋白的二级结构(A)和三级结构(B)Fig. 2 Secondary structures(A)and tertiary structures(B)of soybean GmPDAT1 proteins
2.3 GmPDAT1蛋白的多序列比对和进化树分析
将大豆GmPDAT1 家族与拟南芥AtPDAT1 蛋白的氨基酸序列进行多序列比对,6 个大豆GmPDAT1均具有LCAT 超家族典型的保守结构域,包括盖子区域( I),盐桥区域(Ⅱ)和催化三联体结构(Ⅲ, Ⅳ,Ⅴ)。其中,盖子区域内的Trp(色氨酸)与酶活性位点中裂解的脂肪酸结合,Asp 和Arg 之间的盐桥区域可能参与到磷脂识别(图3)。

图3 大豆GmPDAT1 蛋白氨基酸序列比对Fig. 3 Amino acid sequence alignment of GmPDAT1 proteins in G. max
使用MEGA11.0 软件,将大豆GmPDAT1 与其他已知功能的植物PDAT1 蛋白序列构建系统进化树。大豆GmPDAT1-A 与GmPDAT1-B 在同一分支,与花生(Arachis hypogaea)AhPDAT1 亲缘关系较近;GmPDAT1-C 与GmPDAT1-D 在另一分支,与小桐子(Jatropha curcas)JcPDAT1、蓖麻(Ricinus communis)RcPDAT1-1 和油橄榄(Olea europaea)Oep-PDAT1 亲缘关系较近。GmPDAT1-E 与GmPDAT1-F与蓖麻RcPDAT1-2 亲缘关系较近,聚类在同一分支(图4)。

图4 大豆GmPDAT1 与其他物种PDAT1 的系统进化树Fig. 4 Phylogenetic tree of soybean GmPDAT1s and PDAT1s from other plant species
2.4 GmPDAT1启动子的顺式作用元件分析
分析发现GmPDAT1编码区上游2 000 bp 启动子中存在多个逆境和激素应答元件(图5)。所有的GmPDAT1启动子区都含有厌氧诱导元件(ARE,AAACCA)。GmPDAT1-A和GmPDAT1-E启动子区含有低温响应元件(LTR, CCGAAA),GmPDAT1-B和GmPDAT1-F存在干旱诱导元件(MBS, CAACTG),GmPDAT1-A、GmPDAT1-B、GmPDAT1-E和GmPDAT1-F存在防御与胁迫应答元件(TC-rich,ATTCTCTAAC),说明这些GmPDAT1可能与逆境应答相关。多个激素响应类元件也存在于GmPDAT1启动子中,例如所有GmPDAT1基因都存在较多的ABA 应答元件(ABRE, ACGTG);GmPDAT1-A、GmPDAT1-B、GmPDAT1-C、GmPDAT1-D和GmPDAT1-F存在茉莉酸甲酯(MeJA)响应元件(CGTCA 和TGACG);GmPDAT1-C和GmPDAT1-D存在生长素应答元件(TGA-element, AACGAC);G m P D A T 1-A、G m P D A T 1-B、G m P D A T 1-D、GmPDAT1-E和GmPDAT1-F存在赤霉素应答元件(GARE, TCTGTTG; P-box, CCTTTTG 和TATC-box,TATCCCA)。表明GmPDAT1家族基因可能受到不同激素的调控。
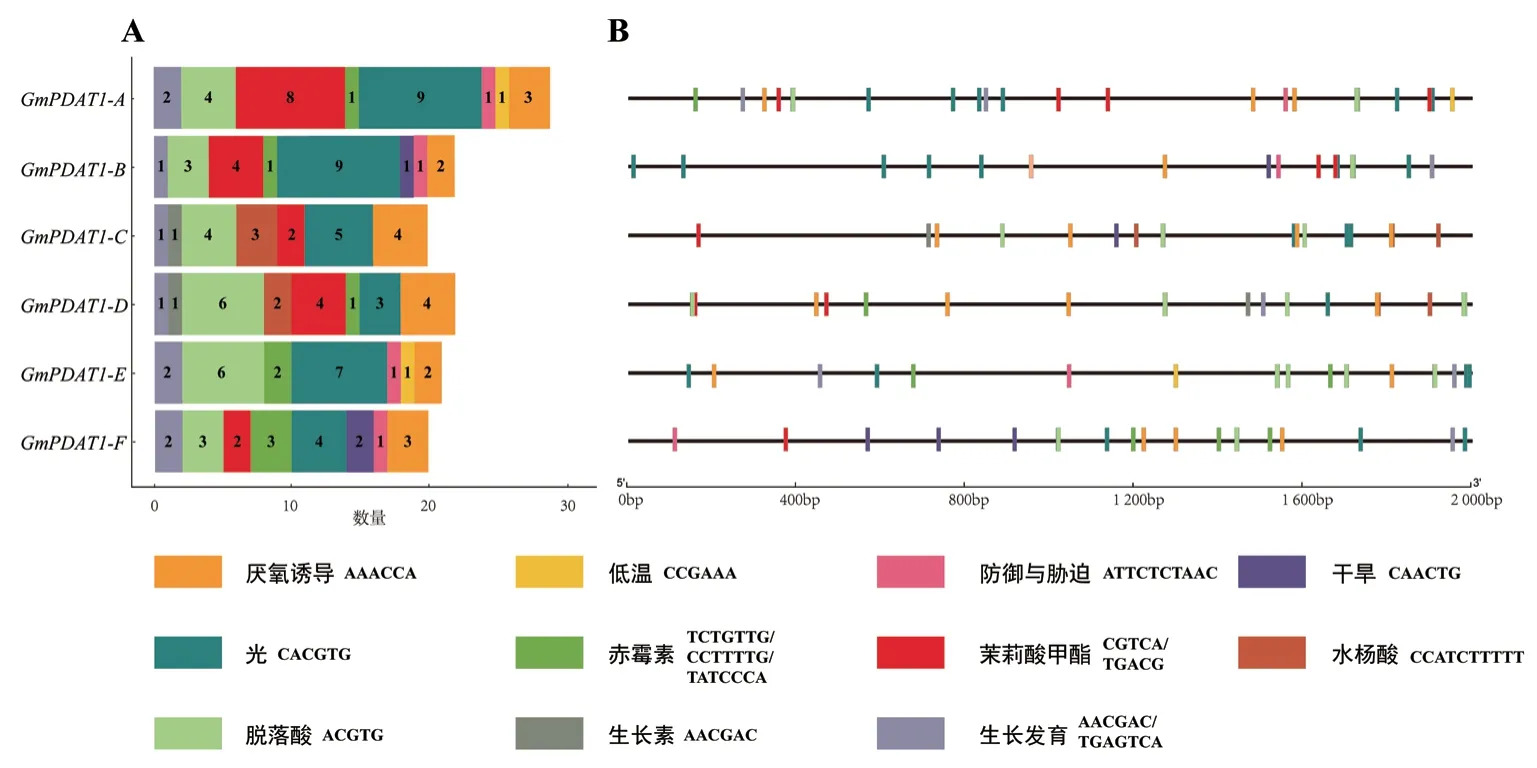
图5 大豆GmPDAT1 启动子的顺式作用元件Fig. 5 Cis-acting element identified in the promoters of soybean GmPDAT1 genes
2.5 GmPDAT1在大豆不同组织中的表达模式
RT-qPCR 结果(图6)显示,GmPDAT1在大豆不同组织中的表达量不相同,其中,GmPDAT1-A、GmPDAT1-E和GmPDAT1-F在大豆各组织中的表达量极低;GmPDAT1-B在各个组织中均表达,但在种子中的表达量高;GmPDAT1-C和GmPDAT1-D在大豆根、茎、叶、花和豆荚中高表达,但在种子中几乎不表达。
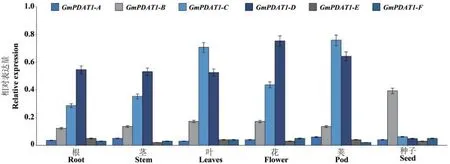
图6 GmPDAT1 在大豆不同组织中的特异性表达Fig. 6 Specific expressions of GmPDAT1 in different tissues of soybean
2.6 转GmPDAT1-B 酵母突变体H1246 恢复油脂合成能力
酿酒酵母突变株H1246 为TAG 合成缺陷株,该突变体敲除了细胞内能够合成TAG 的4 个基因,DGA1(DGAT2 家族成员)、LRO1(甘油二酯酰基转移酶)、ARE1和ARE2(酰基辅酶A:胆固醇酰基转移酶),因此缺乏合成TAG 的能力[23]。将GmPDAT1-B转入酵母H1246,分析转基因酵母细胞三酰甘油的合成积累量来验证GmPDAT1-B在TAG合成中的功能。总脂测定结果显示(图7-A),与转空载的酵母相比,GmPDAT1-B的表达提高了H1246酵母的总脂含量,但没有野生型酵母INVSc1 总脂含量高。进一步对转GmPDAT1-B酵母总脂进行TLC分析(图7-B),缺陷型酵母H1246 和转空载体的TAG 条带处均未检测到斑点,而转GmPDAT1-B的H1246 酵母明显形成TAG 斑点,说明GmPDAT1-B具有PDAT 酶活性,使H1246 酵母恢复了合成TAG的能力。

图7 GmPDAT1-B 的酵母互补功能验证Fig. 7 Complementary function assay of GmPDAT1-B gene using yeast mutant H1246
2.7 GmPDAT1响应非生物胁迫的表达分析
为探究GmPDAT1在大豆抗胁迫中的作用,进一步分析不同非生物胁迫下大豆GmPDAT1的表达特性。RT-qPCR 结果(图8)显示,在不同胁迫处理下,GmPDAT1均受到诱导表达。在4℃低温胁迫处理下,GmPDAT1-B表达量在12 h 时达到最高,为对照的7.26 倍,随后逐渐降低。GmPDAT1-C表达量在24 h 达到最高,为对照的5.24 倍。与对照相比,GmPDAT1-D表达量在处理后24 h 内明显降低,但在48 h 时又有所升高。GmPDAT1-F表达量先升高后降低又升高,在处理48 h 后的表达量达到最高,为对照的21.85 倍。然而,GmPDAT1-A和GmPDAT1-E在对照和低温胁迫处理的大豆幼苗表达量均较低、且无显著差异。

图8 大豆GmPDAT1 在不同胁迫处理下的表达谱Fig. 8 Relative expressions of soybean GmPDAT1 under different stress treatments
在250 mmol/L NaCl 处理下,GmPDAT1-B表达量先升高后降低又升高,表达量最高值出现在处理后48 h,为 对 照 的44.32 倍。GmPDAT1-A、GmPDAT1-C和GmPDAT1-E表达量均在盐胁迫48 h 时达到最高,较未胁迫时分别提高了8.16、14.02 和9.44倍。GmPDAT1-D基因表达量先降低后升高又降低,在处理9 h 后随胁迫时间继续升高,在处理48 h 后表达量为对照的1.23 倍。GmPDAT1-F在对照和盐胁迫处理幼苗中的表达量无显著变化。
在20%的PEG 模拟干旱处理下,GmPDAT1-A表达量先升高后降低又升高再降低,表达量最高值出现在处理后的24 h,为对照的13.45 倍。GmPDAT1-B表达量呈持续上调趋势,在处理48 h 后的表达量达到最高,为对照的23.58 倍。GmPDAT1-C表达量在48 h 处达到最高,为对照的5.69 倍。GmPDAT1-D表达量与对照相比明显降低,而GmPDAT1-E和GmPDAT1-F在干旱胁迫处理和对照大豆幼苗中的表达量无显著改变。
根据上述RT-qPCR 分析结果,GmPDAT1-B在低温、盐和干旱胁迫条件下表达量均显著上调,由此推测GmPDAT1-B可能在大豆抵抗低温、盐和干旱等非生物胁迫中均发挥重要作用。
3 讨论
大豆是世界上重要的油料作物,种子富含有利于人体健康的不饱和脂肪酸,培育高油品种和提高大豆油产量始终是大豆遗传育种和大豆生产主攻领域。PDAT 是TAG 合成过程中酰基辅酶A 非依赖途径中的关键酶,在拟南芥和一些重要油料作物中发现PDAT1 在TAG 合成过程中具有重要作用,但在大豆中的研究十分有限。本研究从大豆基因组中得到GmPDAT1家族的6 个成员,这6 个GmPDAT1基因均属于PLN02517 超家族。生物信息学分析表明,GmPDAT1与拟南芥PDAT1内含子/外显子数量基本一致,编码蛋白的保守基序也一致或相似,说明PDAT 基因进化过程是保守的。RT-qPCR 显示,6个GmPDAT1在大豆不同组织中的表达量存在差异,GmPDAT1-B在种子中的表达量最高,推测其参与种子的油脂合成。进一步通过酵母功能互补实验证明,GmPDAT1-B 具有催化TAG 生物合成的酶活性。
在逆境条件下,脂质成分发生变化以促进膜系统稳定从而提高植物的抗逆性[24]。已有报道显示PDAT 在植物抵御胁迫方面也发挥重要作用[25],植物体内的膜脂动态平衡与PDAT调控基因相关[7]。低温、高盐和干旱等非生物胁迫严重限制大豆的生长并导致减产。因此,培育高抗逆境胁迫且高含油的大豆品种尤为重要。本研究分析发现,大豆GmPDAT1基因启动子区域存在几种胁迫诱导的顺式作用元件,包括低温诱导元件(LTR)、干旱诱导元件(MBS)、防御和胁迫响应元件(Tc-rich)。这些顺式作用元件的存在预示着大豆GmPDAT1可能参与胁迫响应。进一步RT-qPCR 分析显示,不同GmPDAT1成员在非生物胁迫下的表达模式存在差异。GmPDAT1-B在干旱、低温和盐胁迫等3 种逆境条件下的表达水平均明显高于其他基因,预示着大豆PDAT1成员可能在大豆非生物胁迫的调控中起到重要作用。GmPDAT1-B表达特性与花生AhPDAT1[12]和拟南芥AtPDAT1[21]在非生物胁迫下的表达模式基本一致。另外据报道,有些植物中,在TAG 合成中发挥作用的DGAT基因也响应逆境胁迫,例如在三角褐指藻(Phaeodactylum tricornutum)中,PtDGAT1在氮胁迫下被上调表达[26],在氮富集条件下,DGAT2B在TAG 积累开始之前被大量表达[27]。拟南芥幼苗受到ABA、茉莉酸、水杨酸、高盐和干旱胁迫处理后,AtDGAT1的表达显著上调[28],TAG 的积累也增加。本研究显示,GmPDAT1在调控大豆油脂和抗逆境应答发挥双重功能。植物非生物胁迫诱导TAG 形成的代谢过程及脂质代谢是否有助于植物获得抗逆性仍有待阐明。尽管我们没有测试在非生物胁迫下GmPDAT1转基因株系导致的各种生理生化及基因表达的变化,后期将进一步验证GmPDAT1的功能。PDAT1在非生物胁迫中的作用可能解释是与溶血磷脂酰乙醇胺(lysophosphatidylethanolamines, LPE)相关,在TAG 合成过程中,PDAT将磷脂分子上的酰基转移至DAG 后,剩下的副产品是溶血磷脂酰胆碱(lysophospholipids: lysophosphatidylcholine, LPC)和LPE,而LPE 长期以来一直被称为植物衰老阻燃剂[29]。PDAT1过表达可能导致增加植物组织中的LPE 含量,进而促进抗逆性提高。也有研究提出,各种非生物胁迫会导致膜脂重塑,有助于TAG 合成所需的DAG 形成[20]。而PDAT 将脂肪酰基部分从PC 转移到DAG,进而合成TAG,因此显示出PDAT 对非生物胁迫下TAG 的积累是必需的,TAG 的富集亦有利于植物组织的胁迫抗性。
4 结论
鉴定获得6 个大豆GmPDAT1基因,编码蛋白由582-668 个氨基酸祖成,蛋白序列高度保守,均具有PLN02517 超家族蛋白结构域。GmPDAT1家族成员在不同组织以及低温、盐和干旱胁迫下的表达模式存在显著差异。GmPDAT1-B在发育种子中表达量最高,且在低温、盐和干旱胁迫3 种逆境条件下的表达水平均显著上调。GmPDAT1-B 具有催化TAG生物合成的酶活性。GmPDAT1-B 可能具有促进油脂合成和胁迫抗性的双重功能,可作为大豆遗传改良的一个优异候选靶标。

