OsDIS1 通过抗氧化途径负调控水稻耐旱性
杨茂 林宇丰 戴阳朔 潘素君 彭伟业 严明雄 李魏 王冰 戴良英
(1. 湖南农业大学植物病虫害生物学与防控湖南省重点实验室,长沙 410128;2. 湖南农业大学植物保护学院,长沙 410128)
水稻(Oryza sativa)作为世界一半以上人口的主要食物来源,近年来水资源短缺、土地荒漠化等外界因素严重危害了其产量和品质[1]。随着分子生物学技术在作物育种上的广泛应用,发掘抗旱相关的基因,研究其作用机制,成为培育优质高产耐旱水稻品种的重要途径[2-3]。
植物在适应干旱这一逆境过程中演化出了多种高效保护机制[4]。这些干旱调节机制极其复杂,其中有多种干旱应答相关的基因参与调节,并伴随着各种生理、生化反应以及一系列的信号转导[5]。脱落酸(abscisic acid, ABA)是一种重要的干旱胁迫响应激素,通过参与复杂的调控网络来响应干旱胁迫[6]。其参与的干旱相关调控网络分为两大类,即ABA 依赖型和非ABA 依赖型[7]。如NAC 转录因子OsNAC10 可被ABA 诱导,通过ABA 依赖途径显著提高转基因水稻对干旱和高盐的耐受性[8];拟南芥DREB1A 转录因子通过激活RD29B转录,调控基因表达,参与ABA 非依赖型信号途径[9]。除此之外,干旱胁迫使得植物体内活性氧的含量升高,进而加剧自身氧化过程,危害植物组织。因而,植物体内随之开发出一种复杂的抗氧化系统来清除活性氧维持体内平衡[10]。研究发现,油菜中过表达BrLAS基因的植株在干旱胁迫期间能够减少活性氧的积累,进而增强抗氧化酶活性[11]。拟南芥中GhTZF1通过减少活性氧的积累不仅延缓叶片衰老,还增强了植物对干旱胁迫的耐受性[12]。
E3 泛素连接酶在植物生长发育、抗病抗逆等一系列生命活动过程中发挥重要的作用。E3 泛素连接酶包含4 个亚家族:RING(really interesting new gene)亚家族、U-box 亚家族、CRLs(Cullin-RING ubiquitin ligases)亚家族、HECT(homologous to the E6-AP Car boxy terminus)亚家族。其中RING-finger型E3 泛素连接酶在应对非生物胁迫中发挥着重要的作用[13-14]。已有研究表明,在苹果中过表达E3泛素酶基因MdMIEL1后,苹果植株对盐胁迫的耐受性降低[15];E3 泛素连接酶AtAIRP3正调控拟南芥对高盐和干旱的耐受性[16];另外,大豆E3 泛素连接酶基因GmAIRP1也被发现通过激活抗氧化酶,提高渗透调节物质的积累,从而增强其抵御高盐和干旱胁迫的能力[17]。水稻中存在多种RING 型泛素连接酶基因,比如,OsSDIR1、OsRDCP1、OsDSG1等,这些基因调控水稻抵御干旱胁迫[18]。具有环指蛋白结构域的E3 泛素连接酶基因SINAT5通过泛素化NAC1,减弱生长素信号来调节植物生长发育[19]。OsDIS1是一个响应干旱胁迫的SINA 泛素连接酶基因,和拟南芥中SINAT5基因的亲缘关系较近,已有研究表明过表达该基因削弱了水稻抗旱性,而沉默增强了水稻对干旱的抗性;同时OsDIS1 与OsNeK6存在相互作用,可能通过泛素化促进OsNeK6 的降解进而负调控水稻的干旱胁迫耐受性[20]。但是,其具体影响下游哪条通路,还未被进一步验证。探究其干旱胁迫响应机制对于培育抗旱、高产水稻具有重要价值。
因此,为了进一步明确OsDIS1在负调控水稻干旱胁迫的响应途径,我们对OsDIS1-RNAi 转基因水稻进行了脱落酸敏感性试验、抗氧化酶活性测定等一系列生理生化实验及农艺性状分析。研究发现OsDIS1通过抗氧化信号途径负调控水稻的抗旱性,而并非ABA 信号途径;同时OsDIS1-RNAi 转基因水稻的生长和产量没有受到影响。为OsDIS1基因在培育抗旱水稻新品种上的应用提供更多的理论支撑。
1 材料与方法
1.1 材料
以日本晴(Nipponbare)OsDIS1-RNAi 转基因纯合株系为试验材料;RNA 提取试剂盒、逆转录试剂盒、荧光定量试剂盒均购于天根生化科技有限公司;过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)含量测定试剂盒等购于北京索莱宝科技有限公司;3,3′-二氨基联苯胺(DAB)购于美国Amresco 生物技术公司。
1.2 方法
1.2.1 转基因水稻(OsDIS1-RNAi)的获得 将转基因水稻种子播种于含有50 mg/mL 潮霉素、3%蔗糖的1/2 MS 培养基上,后期经筛选鉴定获得RNAi-8、RNAi-21、RNAi-22 三个沉默效率较高的转基因纯合株系,作为后续试验材料。
1.2.2 RNA 提取及实时荧光定量检测 使用试剂盒(TIANGEN,北京)从水稻叶片中提取总RNA。将提取的RNA 反转录成cDNA。再在荧光定量PCR 仪上进行实时荧光定量。以水稻内参基因OsUBQ作为内参对照,用3 次技术重复进行RT-PCR 扩增。反应条件:预变性95℃ 10 min;95℃ 10 s,60℃ 35 s,68℃ 15 min,40 个循环;68℃ 6 min。所用引物列于表1。

表1 实时荧光定量PCR 引物Table 1 Primers for RT-qPCR
1.2.3 脱落酸敏感性试验 将野生型和OsDIS1-RNAi 转基因水稻种子播种于含有不同浓度ABA(0、1、2、3 μmol/L)的1/2 MS 培养基上,在28℃的温室中生长7 d 后,记录发芽种子的数量。14 d 后拍照并记录野生型和OsDIS1-RNAi 转基因株系(RNAi-21)之间的表型差异,并测量根长和株高。
1.2.4 抗氧化酶活性和丙二醛含量的测定 通过估算降低氯化硝基四氮唑蓝(NBT)还原的速率来测定SOD 的活性。即在(560 ± 100)nm 波长下测定反应混合物的吸光度。抑制NBT 光还原50%所需的酶的体积为一个单位的超氧化物歧化酶活性。POD活性按照愈创木酚法进行测定。该反应混合物由30 μL 酶提取物、76 μL 愈创木酚、112 μL 30% H2O2和200 mL 乙酸钠缓冲液(pH 6.0)组成。一个单位的POD 活性即1 min 内470 nm 下的吸光值。CAT 活性通过测量H2O2在240 nm 下的吸光值来评估。该反应混合物由30 μL 酶提取物、300 μL 30% H2O2和200 mL 磷酸盐缓冲液(pH 7.0)组成。在240 nm 处每分钟0.01 吸光度单位的减少量为一个单位的CAT活性。
MDA 含量采用以下方法进行测定。向2 mL 上清液中加入含0.5%二硫代巴比妥酸的5%三氯乙酸溶液3 mL。混匀后在沸水中加热10 min,快速冷却。5 000 r/min 离心15 min 后,测定上清液在532 nm 和600 nm 波长下的吸光度。最后的脂质过氧化水平即丙二醛的含量。
1.2.5 DAB 染色 将剪下的水稻叶片浸没在含有1 mg/mL 3,3′-二氨基联苯胺(DAB)的溶液中,室温避光孵育8 h,蒸馏水冲洗一遍后加入无水乙醇,再置于96℃水浴锅中脱色20 min,然后在95%酒精中浸泡48 h,直到所有的叶绿素都被去除,拍照记录染色结果。
2 结果
2.1 OsDIS1抗旱性可能与ABA信号通路无关
已有研究表明,干旱处理后OsDIS1-RNAi 植株的存活率明显高于野生型,并且在恢复供水后能恢复正常生长,OsDIS1基因沉默的植株提高了水稻的抗旱性。为明确OsDIS1基因负调控水稻抗旱性干旱胁迫背后的分子机制,进一步分析了OsDIS1-RNAi转基因水稻对ABA 的敏感性。在不同浓度的ABA(0、1、2、3 μmol/L)处理后,野生型和转基因植株没有明显的表型差异(图1-A)。且OsDIS1-RNAi 与野生型的种子发芽率一致,均随ABA 浓度的增加而降低(图1-B)。此外,与野生型相比,OsDIS1-RNAi 转基因植物的根长和株高没有显著差异(图1-C, D)。OsDSM2和OsBZIP23两个基因在抗旱期间参与ABA途径,因此对干旱处理后RNAi 和野生型中OsDSM2和OsBZIP23的转录水平进行了评估。结果显示OsBZIP23和OsDSM2在野生型和OsDIS1-RNAi 转基因植株中都有增加,但两者之间没有显著差异(图2)。据此推断OsDIS1可能不通过ABA 信号通路调节水稻抗旱性。
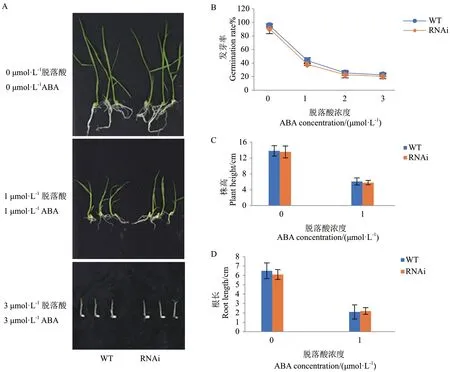
图1 脱落酸处理下OsDIS1-RNAi 转基因植株的表型Fig. 1 Phenotypes of OsDIS1-RNAi transgenic plants treated with abscisic acid (ABA)
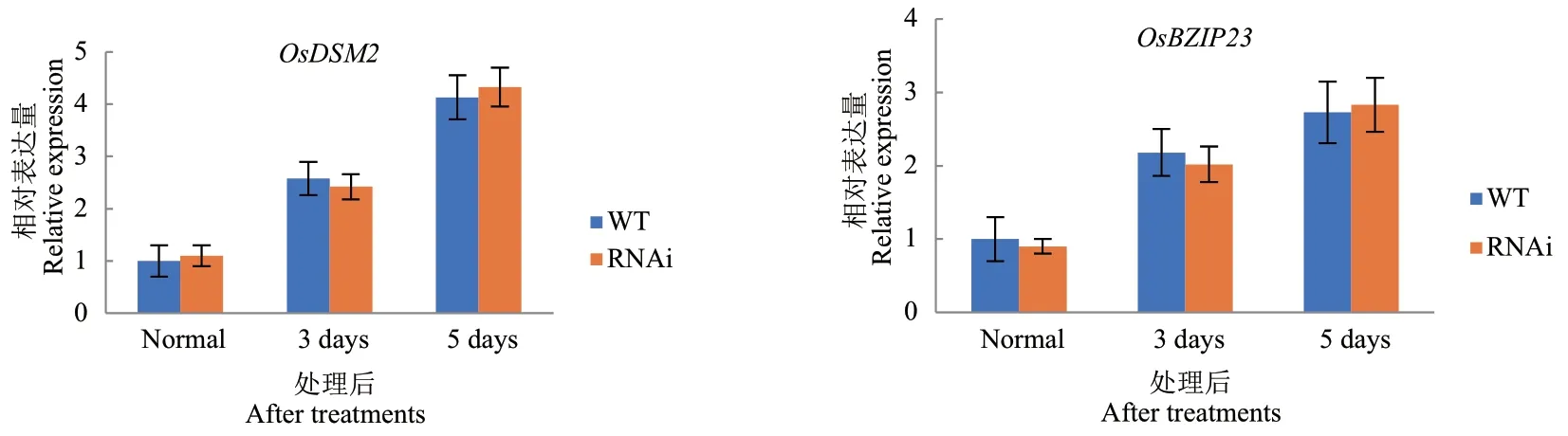
图2 RT-qPCR 检测ABA 途径基因在OsDIS1-RNAi 植株中的表达量Fig. 2 Expressions of ABA pathway genes in OsDIS1-RNAi plants detected by RT-qPCR
2.2 OsDIS1负调控水稻的抗氧化能力
干旱胁迫期间植物体内产生活性氧,并通过氧化胁迫对其造成损伤。而SOD、CAT 和POD 有助于清除细胞内活性氧。前面实验证明OsDIS1不通过ABA 信号通路调节水稻抗旱性,因而进一步分析了抗氧化途径是否参与其中。为了研究OsDIS1基因对于水稻抗氧化能力的影响,首先使用DAB 染色法检测了OsDIS1-RNAi 转基因和野生型水稻中的活性氧含量;结果发现,干旱胁迫下OsDIS1-RNAi 转基因植株显示出更深、更大面积的染色(图3)。同时检测了干旱处理后OsDIS1-RNAi 转基因和野生型中SOD、CAT、POD 酶的活性。结果显示,与野生型相比,OsDIS1-RNAi 转基因植物的3 种抗氧化酶活性显著增强(图4-A, B, C)。干旱胁迫期间,植物可以通过调节活性氧含量从而进行渗透调节,MDA是活性氧破坏细胞膜脂质的副产物。因此,对干旱处理后植株体内的MDA 含量进行了检测,发现干旱处理后OsDIS1-RNAi 植株中MDA 的含量明显降低(图4-D)。

图3 野生型和RNAi 的活性氧含量检测Fig. 3 Detection of reactive oxygen content of wild-type and RNAi
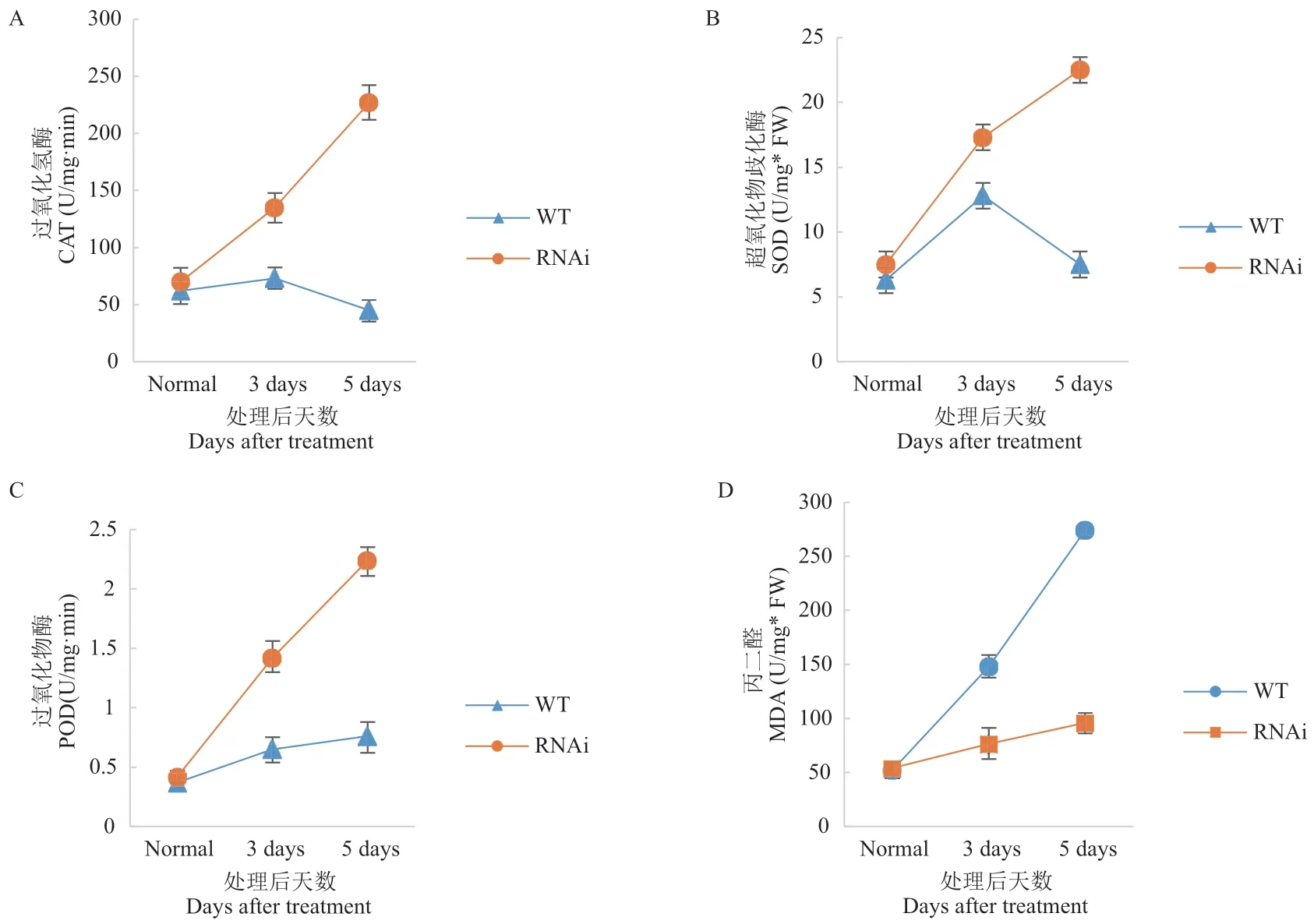
图4 OsDIS1-RNAi 转基因植株中抗氧化酶活性和MDA 含量检测Fig. 4 Detection of antioxidant enzyme activity and MDA content in OsDIS1-RNAi transgenic plants
此外,OsDSM1、OsSIK1和OsSKIPa参与抗氧化信号通路,对此在野生型和OsDIS1-RNAi 转基因植株中测定了基因表达量。发现OsDSM1和OsSKIPa在未经处理的OsDIS1-RNAi 植株中被激活;并且干旱处理后OsDIS1-RNAi 转基因植物中OsDSM1、OsSIK1和OsSKIPa的转录被诱导(图5)。以上结果表明,OsDIS1通过激活抗氧化系统清除细胞内活性氧来负调节抗旱性。
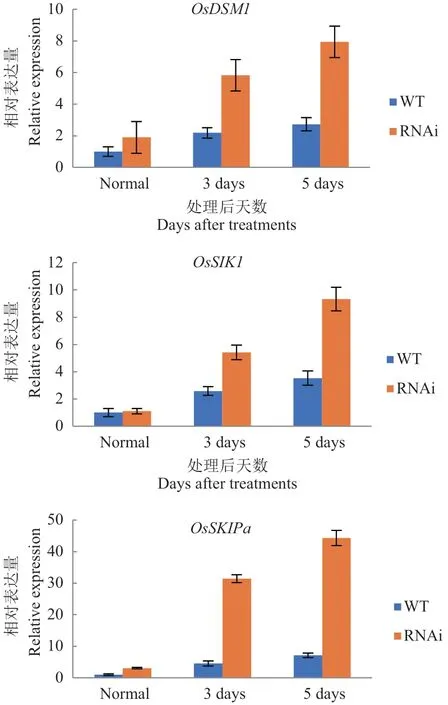
图5 RT-qPCR 检测OsDIS1-RNAi 植物中相关活性氧(ROS)清除基因的表达量Fig. 5 Expressions of related reactive oxygen species(ROS)scavenging genes in OsDIS1-RNAi plants by RT-qPCR
2.3 OsDIS1不影响水稻的生长和产量
E3 泛素连接酶在应对干旱胁迫中发挥着重要的作用,它们还能影响植物生长。为分析OsDIS1的应用价值,对OsDIS1-RNAi 植株的农艺性状进行了研究。正常条件下,OsDIS1-RNAi 与野生型之间没有显著的形态差异(图6)。同时对OsDIS1-RNAi的株高、穗长、每穗实粒数、每穗粒数和单株产量进行了评估,发现两者之间没有显著差异(表2)。因此,OsDIS1-RNAi 不影响水稻植株生长和产量,表明OsDIS1可以应用于培育耐旱水稻的基因工程。
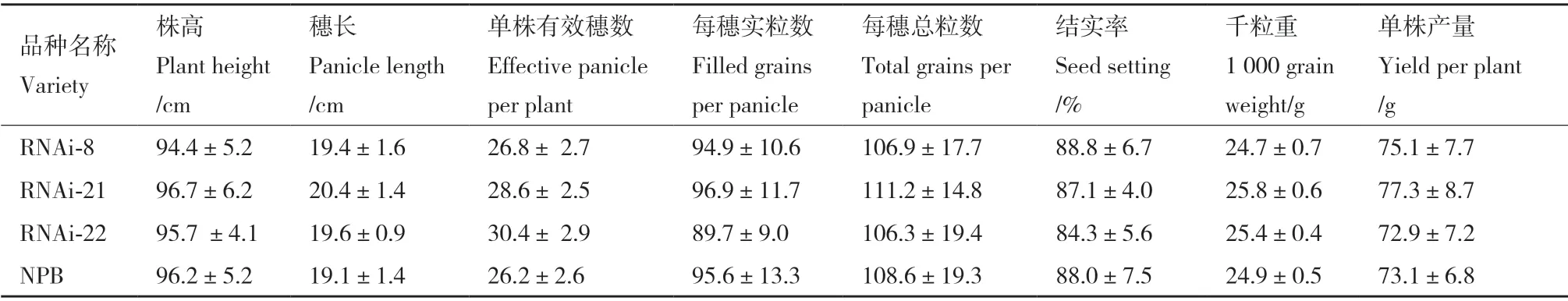
表2 转基因水稻OsDIS1-RNAi 的农艺性状Table 2 Agronomic characteristics of transgenic rice OsDIS1-RNAi

图6 OsDIS1-RNAi 转基因水稻的生长表型Fig. 6 Growth phenotypes of OsDIS1-RNAi transgenic rice
3 讨论
泛素化途径涉及3 种酶:泛素激活酶(E1)、泛素偶联酶(E2)和泛素连接酶(E3)[21]。在这一途径中E3 连接酶通过泛素化靶蛋白,然后通过26S蛋白酶体识别偶联蛋白使靶蛋白降解,其在植物抵抗生物和非生物胁迫响应中发挥重要的作用。例如OsPUB67作为U-box 型E3 泛素连接酶基因显著提高水稻抗旱性[22];OsDIS1是一种重要的E3 泛素连接酶,调节植物细胞过程的许多方面。有报道发现其在抗旱中发挥重要作用。但其调控通路尚未明确。探明干旱胁迫的分子机制是培育耐旱品种的前提条件[23]。
前人研究中,脱落酸已被证明是植物抵御干旱胁迫的关键因子[24]。植物干旱胁迫适应途径分为脱落酸依赖途径和脱落酸非依赖途径[25]。研究报道MlNAC10通过脱落酸信号通路作为干旱胁迫耐受性的关键调节因子[26]。本试验分析了OsDIS1-RNAi 转基因植株对ABA 的敏感性,以了解OsDIS1调控干旱胁迫的机制。结果发现,在不同浓度的脱落酸处理后,OsDIS1-RNAi 转基因植株种子的发芽率、根长和株高没有表现出显著差异。在水稻中,OsDSM2和OsbZIP23通过ABA 依赖性途径调节耐旱性[27]。本研究发现OsDSM2和OsBZIP23基因表达上调,但是在野生型和OsDIS1-RNAi 植株之间没有明显差异。这些结果显示OsDIS1不依赖于ABA 的调节途径调节抗旱性。
有报道发现,抗氧化途径也是调控植株抗旱性的重要方式[28]。本研究发现干旱处理后OsDIS1-RNAi 转基因水稻中CAT、POD、SOD 的活性增强。干旱胁迫会导致水稻体内产生大量活性氧,从而损伤植物体[29]。针对此现象,植物也进化出了复杂的调控机制,例如增强CAT、POD、SOD 等活性氧清除酶活性[30]。活性氧的过度积累会产生大量MDA等次级产物,这些次级产物会导致细胞膜严重的过氧化损伤[31]。与干旱处理后的野生型植株相比,OsDIS1-RNAi 转基因植株的MDA 积累显著减少,这与OsDIS1-RNAi 转基因植株的SOD、CAT、POD 活性显著增强相一致。干旱胁迫诱导活性氧(ROS)清除基因的表达,有研究表明,水稻OsDSM1基因通过调节水稻中活性氧(ROS)的含量,在早期干旱胁迫响应中起作用[32]。在本研究中,干旱处理后的OsDIS1-RNAi 转基因植株中,OsDSM1、OsSIK1和OsSKIPa基因表达量显著上调。这些结果表明,OsDIS1-RNAi 转基因植物通过增强活性氧清除酶活性,提高清除活性氧及次级产物的能力,来提高其本身对干旱的耐受性。
培育耐旱水稻对于满足人类日益增长的需求至关重要。E3 泛素连接酶也参与到调节植物的生长发育过程。在拟南芥中敲除泛素连接酶SINAT5 抑制侧根形成[33]。如果沉默OsDIS1会减弱其他农艺性状,就降低了其在育种中的应用价值。为此,分析OsDIS1-RNAi 植株的农艺性状,发现与野生型植物相比,没有明显的表型差异。因此,OsDIS1可以认为是耐旱基因育种的较为理想候选基因。
4 结论
OsDIS1通过提高抗氧化系统活性来清除干旱胁迫诱导的细胞内活性氧,从而负调控水稻抗旱性。沉默OsDIS1基因不影响植株的正常生长和产量。

