小龙虾冻藏期间的品质变化
桑燕菲,杨立,钱鑫萍,姜绍通,3,陆剑锋,3,4,林琳,3,4*
(1.合肥工业大学食品与生物工程学院,安徽合肥 230601)(2.安徽富煌三珍食品集团有限公司,安徽巢湖 238000)(3.安徽省农产品精深加工重点实验室,安徽合肥 230601) (4.农产品生物化工教育部工程研究中心,安徽合肥 230601)
小龙虾,学名克氏原螯虾(Procambarusclarkii),最近十几年已成为我国淡水虾类中的一种重要资源。2020年和2019年我国小龙虾产量分别239.37万t和208.96万t,与2018年相比,分别增加了46.07%和27.52%[1]。小龙虾养殖量的快速增长,为小龙虾加工提供了充足的原料,2020年我国小龙虾总加工量为5.66万t,较2019年增加了11.01%[1]。新鲜小龙虾营养丰富且水分含量高,容易腐败变质且季节性很强,市场价格随季节呈巨大波动。目前小龙虾多以鲜销或冷冻粗加工为主,产品主要有虾仁、整虾、虾尾等,附加值低,导致加工企业效益较低,与小龙虾养殖量的快速增长不匹配。
冷冻加工和贮藏在食品工业中普遍应用,成本较低、效果好。在冷冻过程中,冷冻速度和温度直接影响冰晶大小和数量以及冰晶在细胞和细胞间的分布。冻藏过程中的虾肉质量下降主要是冰晶的升华和重结晶的形成,引起蛋白质的氧化、变性,表现为虾肉脱水、质量损失、变硬、微生物污染、风味变坏和自溶等[2]。水产品在冷冻贮藏过程中受到温度变化的影响,会发生生化反应,如氨基酸侧链残基的修饰、巯基的氧化、细胞质的浓度增加等[3],这些将导致产品的脂质和蛋白质的氧化或变性[4],而这些变化一般会随着冷冻贮藏时间的延长而加剧。最近关于新鲜小龙虾冷冻的研究表明,冷冻和储存的温差以及冷冻速度都对小龙虾产品的最终质量有影响。实验室先前的工作也发现了小龙虾短期冻藏过程中蛋白质的氧化,腐败以及质构的变差[4]。在实际生产过程中,原料供给、加工能力、市场销售以及疫情等突发事件会不同程度延长小龙虾的冷冻贮藏时间,而长期冻藏过程中水产蛋白的变化目前研究较少。本论文研究了鲜活与蒸煮预加工后的小龙虾,在48周(1年左右)冷冻贮藏过程中虾肉蛋白质相关指标的变化情况,并初步探讨冻藏期间的虾肉肉质改变及蛋白冷冻变性机理,为小龙虾的加工和贮藏提供理论依据。
1 材料与方法
1.1 材料与试剂
市售鲜活小龙虾,产区为江苏省泗洪县,保活运至实验室。
盐酸、三氯乙酸、2-硫代巴比妥酸、EDTA、1,1,3,3-四乙氧基丙烷、硼酸、氧化镁、溴酚蓝、考马斯亮蓝、冰醋酸、甲醇、戊二醛、磷酸二氢钠、磷酸氢二钠、无水乙醇等,均为分析纯;总巯基含量检测试剂盒,羰基含量试剂盒,购自Solarbio公司;HEPES体系预制胶C621104,5x上样缓冲液(含少量DTT),购自生工生物工程有限公司。
1.2 仪器与设备
FJ-200高速分散均质机,上海标本模型厂;K9840自动凯氏定氮仪,山东海能科学仪器有限公司;CT15RT台式高速冷冻离心机,上海天美生化仪器设备工程有限公司;JEM1400透射电镜,日本电子;TA-XT plus物性仪,英国Stable Micro System公司;Epoch全波长酶标仪,BioTek Instruments;Nicolet 6700傅里叶红外光谱仪,美国Thermoelectric Group。
1.3 样品处理
选取新鲜小龙虾,体质量(30.00±5.00)g/只,随机分为两组(每组350只):鲜活虾直接冷冻组(FX)和蒸煮预处理后冷冻组(FS),冷冻温度-18 ℃。FX组直接将鲜活虾清洗后沥干表面水分,装入包装袋置于-18 ℃冰箱冷冻贮藏;FS组将活虾清洗后,置于沸水中煮制4 min,流水冷却至室温,沥干表面水分,放入冰箱冻藏。定时取样品检测,通过实验室之前的工作[4],发现短期冻藏虾肉变化较快。故而本次试验前期检测更为频繁,而后检测间隔逐步拉长。检测时,将虾肉流水解冻后去头、去虾线,取虾肉测定各指标。
1.4 指标测定
1.4.1 挥发性盐基氮(TVB-N)
TVB-N测定参照GB 5009.228-2016《食品安全国家标准食品中挥发性盐基氮》[5]的测定进行。
1.4.2 肌肉微观结构观察
使用苏木精-伊红染色(H&E)和透射电镜(TEM)来比较和评估冻藏过程中小龙虾肌肉组织的微观结构变化。H&E染色是根据Davidovich等[6]的方法进行的,TEM参考Alvarez-Cirerol等[7]的方法进行。
1.4.3 质构
参照江杨阳[8]的方法。取小龙虾虾尾的2~3节,将其切割成8 mm×8 mm×6 mm的方块,用物性仪对样品的TPA指标进行测定。参数设定为:触发类型Auto(自动)、测试速率为1 mm/s、返回速率为1 mm/s、测试形变量50%、触发力5 g,两次压缩之间的停留时间为5 s。使用不锈钢P/36R圆柱形压缩探头。每个样品做6次重复,记录硬度、弹性、咀嚼性、内聚力。
1.4.4 SDS-PAGE电泳
参考江杨阳[8]的方法。
1.4.5 硫代巴比妥酸值(TBARS)
参照GB 5009.181-2016《食品安全国家标准食品中丙二醛的测定》[9]执行,TBARS值以每千克脂质氧化样品溶液中丙二醛(MDA)的质量表示(mg/kg)。
1.4.6 羰基含量测定
称取约0.4 g虾肉,加入4 mL试剂盒内蛋白提取液,充分匀浆后于4 ℃,5 000 r/min离心10 min,取上清,采用试剂盒给定方法测定。
1.4.7 表面疏水度测定
参考Park等[10]的方法。向小龙虾虾肉糜中加入4倍体积蛋白提取液(0.1 mol/L NaCl、0.002 mol/L MgCl2、0.001 mol/L EDTA-2Na、0.1 mol/L磷酸盐缓冲液,pH值7.0),11 000 r/min匀浆25 s,4 ℃、 5 000 r/min离心15 min,弃上清液,留沉淀,再加入蛋白提取液重复上述操作2次得粗蛋白。将所得粗蛋白与4倍体积0.1 mol/L NaCl溶液混合,匀浆25 s,4 ℃、5 000 r/min离心15 min,弃上清液,留沉淀,再加入NaCl溶液重复上述操作2次,沉淀即为小龙虾虾肌原纤维蛋白分散液。用适量0.6 mol/L NaCl溶解蛋白,过滤,取滤液。采用双缩脲法测定蛋白质浓度,以牛血清蛋白为标准品。
参考Chelh等[11]的方法。向1 mL肌原纤维蛋白分散液(5 mg/mL)中加入200 μL 1 mg/mL溴酚蓝(Bromophenol Blue,BPB)(去离子水溶解)。空白组用20 mmol/L磷酸盐缓冲液(pH值6.0)替代。室温下充分振荡10 min,5 000 r/min离心15 min。取上清液稀释10倍后在595 nm波长处测吸光度A。疏水性用BPB结合量表示,计算如下式所示。
式中:
B——BPB结合量,μg;
A0——空白组在595 nm波长处测得的吸光度;
A1——样品组在595 nm波长处测得的吸光度。
1.4.8 傅立叶红外光谱
参考Kaewprachu等[12]的方法。先将虾肉样品冷冻干燥,研磨成粉末,然后使用压片机将其压在透明载玻片上,并放置在ATR晶体的表面。消除背景干扰后,收集了400~4 000 cm-1之间的光谱,4 cm-1分辨率下扫描32次。测试后,对光谱数据进行傅立叶去卷积,并使用多重高斯曲线拟合及二阶导数计算。根据其相应峰的面积的相对百分比,计算不同二级结构的组成。使用软件OMNIC 8.2.0.387分析图谱。
1.4.9 总巯基含量
称取约0.5 g虾肉,制备成10%的匀浆,8 000g常温离心10 min,取上清液,按试剂盒微量法进行测定。
1.5 数据分析
每组试验至少重复3次,数据以“平均值±标准差”表示,质构数据以“平均值±标准误”表示,用Microsoft Excel 2019和Graphpad Prism 8进行数据分析、绘图和Pearson相关性分析。
2 结果与讨论
2.1 冻藏期间小龙虾虾肉挥发性盐基氮(TVB-N)的变化
TVB-N是蛋白质在酶和微生物的作用下被分解产生氨类碱性含氮挥发性物质,可用于评价水产品新鲜度[8]。如图1,FX组和FS组的虾肉TVB-N值在冷冻贮藏期间均呈逐渐增长的趋势。FX和FS组虾肉冻藏48周时的TVB-N值分别为22.93和11.90 mg/100 g,均未超过我国的水产品卫生标准30 mg/100 g的限 量[13],仍可安全食用。整个贮藏期内,FX组与FS组小龙虾的TVB-N值,分别上升332%和62.57%。FS组增幅更小,是因为小龙虾经热烫预处理后能够有效地杀死一定量微生物,进而减缓蛋白质被破坏速率[14]。
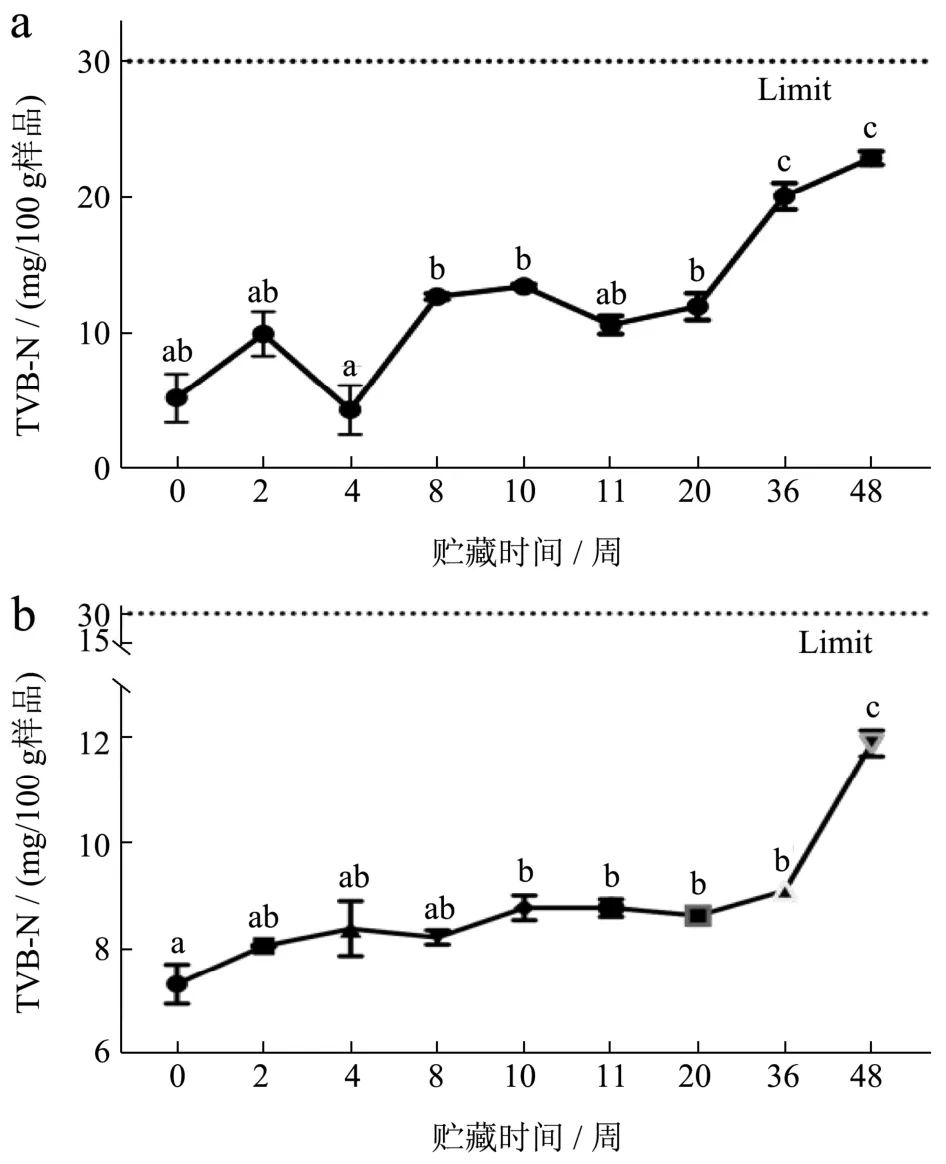
图1 小龙虾冻藏过程中挥发性盐基氮(TVB-N)含量的变化Fig.1 The change of total volatile basic nitrogen (TVB-N) content during the frozen storage of crayfish
2.2 冻藏期间小龙虾虾肉微观结构变化
从虾肉组织切片的HE染色图和TEM图(图2)可以看出,新鲜虾肉(X0)的肌丝紧密,肌丝间隔小,肌节结构清晰,Z线、M线完整。经煮制后的虾肉(S0)肌节排列紊乱,融合,Z线、M线消失,结构破坏比较严重,肌丝略微水肿,这是由于蒸煮后,肌丝膨润,蛋白发生不均匀聚集,三维网状结构无序,致密。相比于新鲜虾肉(X0),经煮制后的虾肉(S0)的肌丝间隔更小,表明蒸煮处理会使肌丝膨润。
冻结过程中,主要形成胞外冰晶,一方面通过肌膜两侧渗透压的改变来促进细胞脱水[15](图2a白色区域),另一方面,冰晶的体积膨胀[16],挤压破坏肌球蛋白头部[17],虾肉肌节Z线、M线降解,肌节缩短(图2b),也表现为虾肉弹性在前四周显著降低 (P<0.05)(图3)。蒸煮后冻藏48周的虾肉(FS48),虾肉肌节破坏严重,肌丝间隔更大,是由于蒸煮使蛋白分子间的静电斥力减小,不利于维持原有蛋白三维网状结构,导致肌丝密度下降,结构松散。另外,冷冻贮藏期间肌节的缩短(图2b),会对高温蒸煮后蛋白的变性造成影响[18],导致冻藏过的虾烹饪后口感变差。
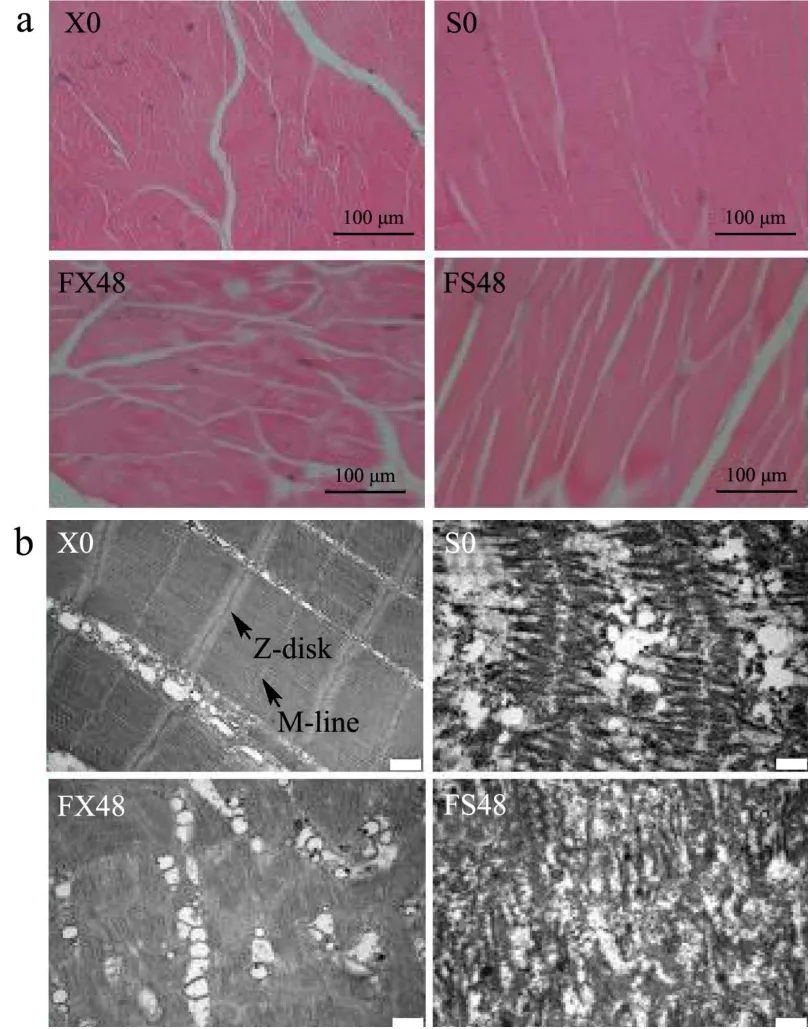
图2 小龙虾冻藏0周和48周的微观结构的变化Fig.2 Changes in microstructure of crayfish frozen for 0 and 48 weeks
2.3 冻藏期间小龙虾虾肉质构的变化
如图3为冻藏过程中小龙虾的质构变化情况,从图中可以看出,随着冻藏时间的延长,FX组的弹性、咀嚼性、凝聚性均有显著性降低,在0~4周下降速度较快,硬度有所降低,但变化不显著性。FS组虾肉质构变化波动较大,弹性在0~4周显著性降低,硬度在36周开始显著性降低,同时伴随着弹性降低,凝聚力升高,咀嚼性无显著性变化。

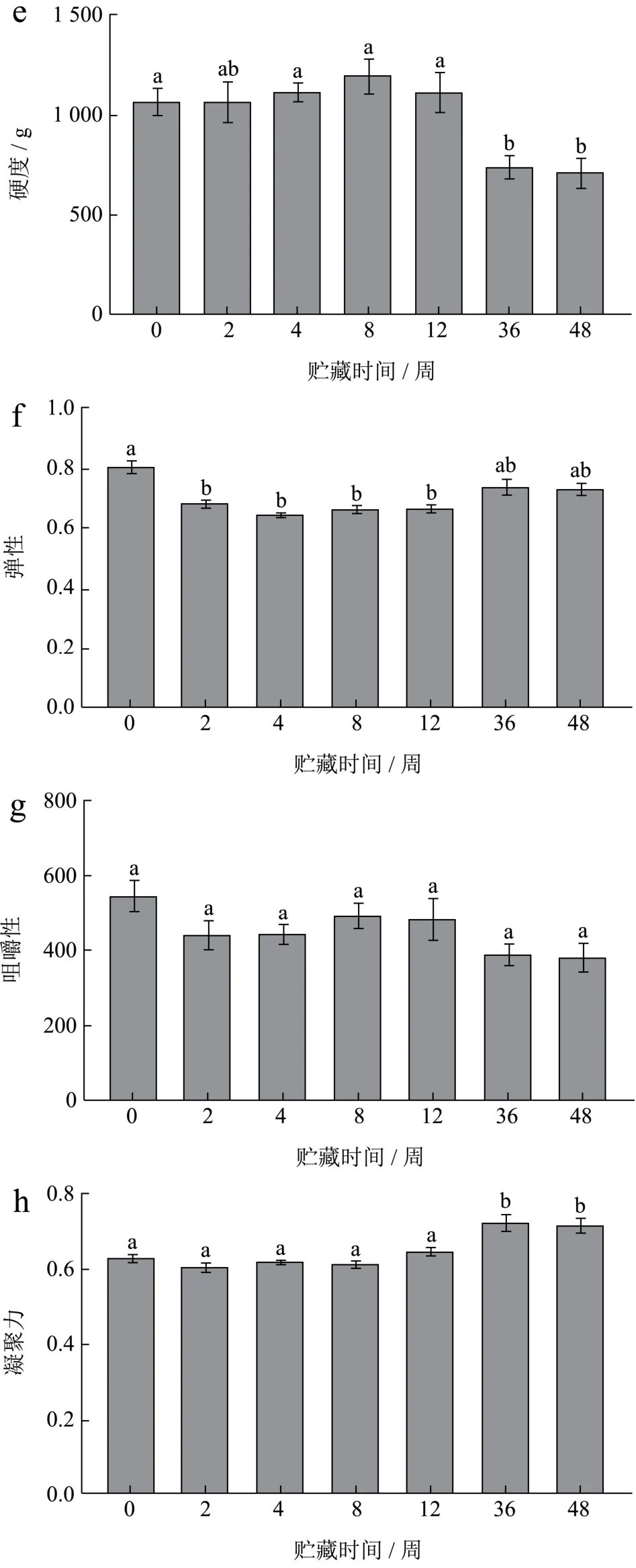
图3 小龙虾冻藏过程中质构的变化Fig.3 Changes in texture of crayfish during frozen storage
冻藏对新鲜虾肉的形变影响不明显,但对煮熟虾肉有明显影响,可能因为熟制虾肉蛋白间静电作用斥力减小,冻结后,肌肉结构稳定性变差[3]。Shi等[19]研究冻藏小龙虾,24周时发现肌肉组织在解冻后变成令人不快的糊状。本实验观察到FX组虾肉经长期冻藏后外表发白,出现水分的不均匀干耗(图4),可能对虾肉凝聚力下降有影响,但对硬度影响不明显。凝聚力被定义为内部键的强度,凝聚力和弹性有相同趋势,值越高,口感更好[20]。有研究指出,在短期冷冻储存期间,肌原纤维蛋白会从规则的丝状网络转变为高度聚集的结构,变性的肌原纤维蛋白会产生具有更多球状微观结构的凝胶[21],这种蛋白间静电作用斥力降低的表现,可能是冻藏过程中FX组凝聚力显著降低的原因。当蛋白变性程度高时,解冻后的冰晶不会被重新吸收,肌肉细胞也不会恢复[22,23]。FX组的咀嚼性在0~2周下降最快,其后较为稳定,表明冻藏初期蛋白三级结构的破坏较大;而煮熟后冻藏的FS组,由于热变性使蛋白亚基重新结合,三级结构更致密,并且酶被高温灭活,所以冻藏对其结构影响较小[16]。
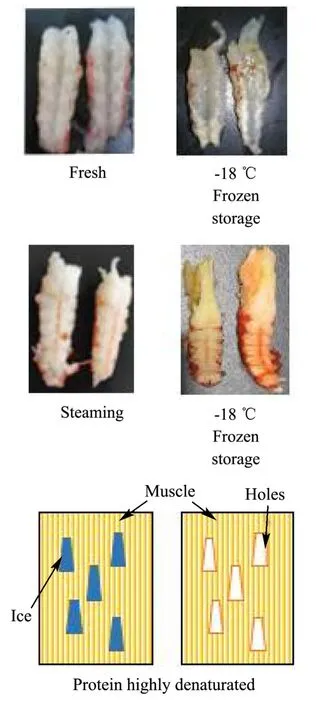
图4 小龙虾冻藏过程中肌肉损伤模式图Fig.4 Damage pattern during freezing and storage of crayfish
2.4 冻藏期间小龙虾虾肉蛋白质成分变化
小龙虾虾肉蛋白的SDS-PAGE电泳图谱中主要包括7个条带(图5):肌球蛋白重链(MHC,200 ku)、副肌球蛋白(Paramyosin,105 ku)、未知蛋白(75 ku)、肌动蛋白(Actin,48 ku)、肌钙蛋白亚基(原肌球蛋白结合亚基)(Troponin T,TnT,37 ku)、原肌球蛋白(Tropomysin,Tm,35 ku)、肌球蛋白轻链(MLC,17~20 ku)。从图4中可以看出,冻藏期间肌球蛋白头部(MHC和MLC)条带变窄,表明其发生降解或者交联[8],同时发现上样孔处蛋白聚集。FX鲜虾组170 ku左右的条带,在冻藏后消失,表明该处蛋白可能对冷敏感;副肌球蛋白可能降解成87 ku左右的新条带;75 ku蛋白也发生降解。FS熟虾组MHC有轻微降解;170 ku条带也消失,说明该处蛋白可能同时具有热敏感性,在加热蒸煮过程中消失。
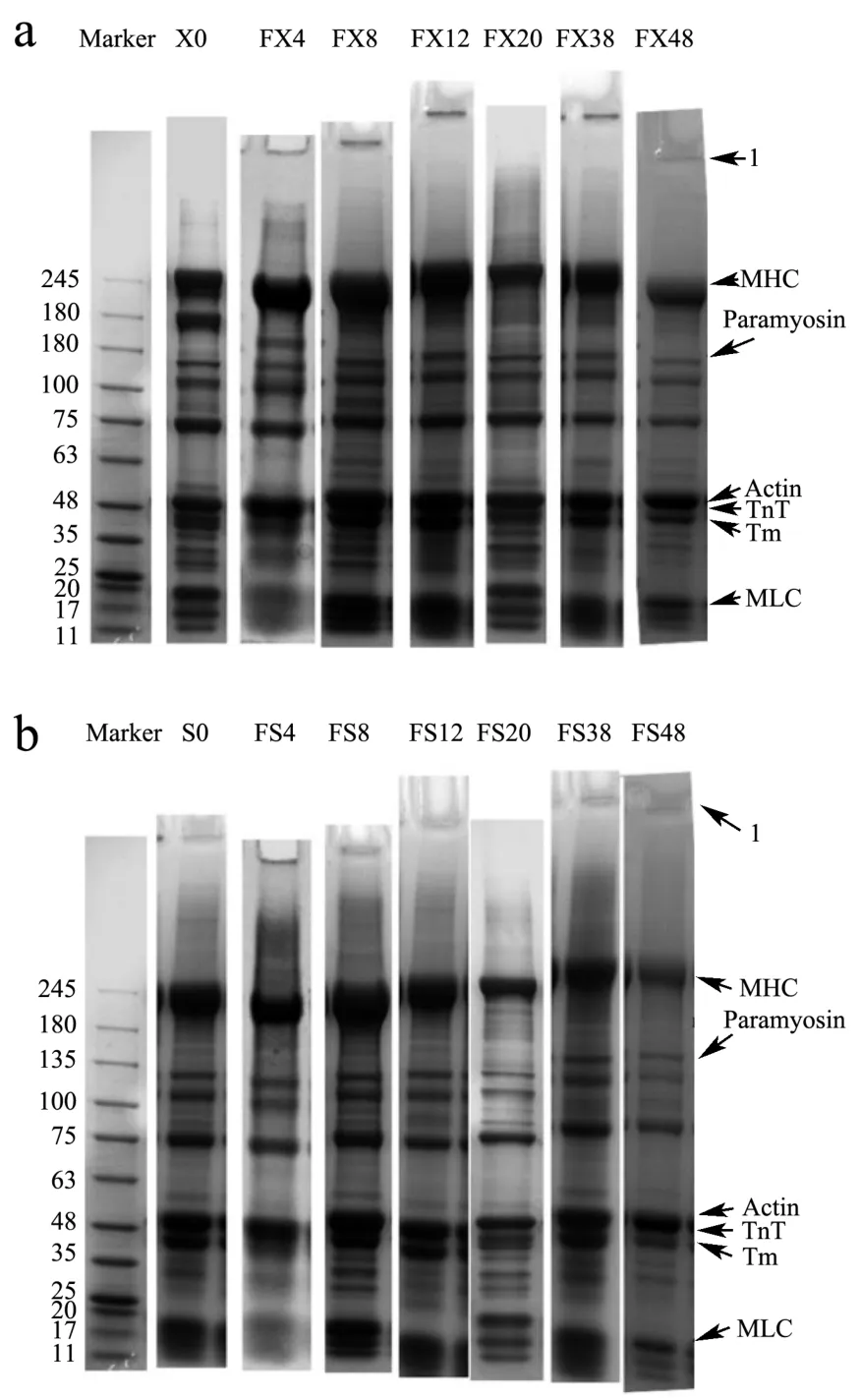
图5 小龙虾冻藏不同天数的全蛋白条带变化Fig.5 Changes in protein fraction of crayfish frozen for different days
综合来看,冷冻使虾肉肌纤维的细丝和粗丝蛋白变性,导致高分子量蛋白聚集,或水解成小分子蛋白。MHC通过共价键和非共价键发生交联,并且蛋白质的交联会增加水分损失和使肉质口感变差[24]。Kaewprachu等[12]研究发现冻藏期间肌原纤维蛋白可能通过二硫键交联,MLC的SHa亚基团也会参与MHC的氧化和其二聚体的形成[25]。肌动蛋白与肌球蛋白颈部(Tm,TnT)在冻藏期间较为稳定。蒸煮后冷冻的熟虾肉蛋白质电泳条带变化不明显,可能是由于上样缓冲液中DTT对二硫键的还原作用导致无法观察到交联作用。
2.5 冻藏期间小龙虾虾肉脂质氧化变化
肌肉冻藏过程中,发生的脂肪氧化会对蛋白质结构和功能性产生不利的影响。冷冻会损害细胞结构,尤其是膜脂,从而造成肉类氧化,并且脂质氧化是一种自催化反应,其中一些中间和最终氧化产物自由基具有促氧化作用,能促进蛋白氧化。如图6所示,FX组虾肉的TBARS值在0~5周呈上升趋势(0.07~ 0.24 mg/kg样品),特别是在冻藏前2周,上升速度较快,在2~5周期间变化不显著,第5周达到最大值后开始下降(0.24~0.11 mg/kg样品)。FS组虾肉的TBARS值在前5周保持缓慢增加,同样在第5周达到最高值(0.33 mg/kg样品)。丙二醛(MDA)是脂质氧化过程中的中间副产品,随脂肪氧化,MDA逐渐增多,然后被进一步氧化成其他有机酸和醇,导致TBARS值下降[26]。
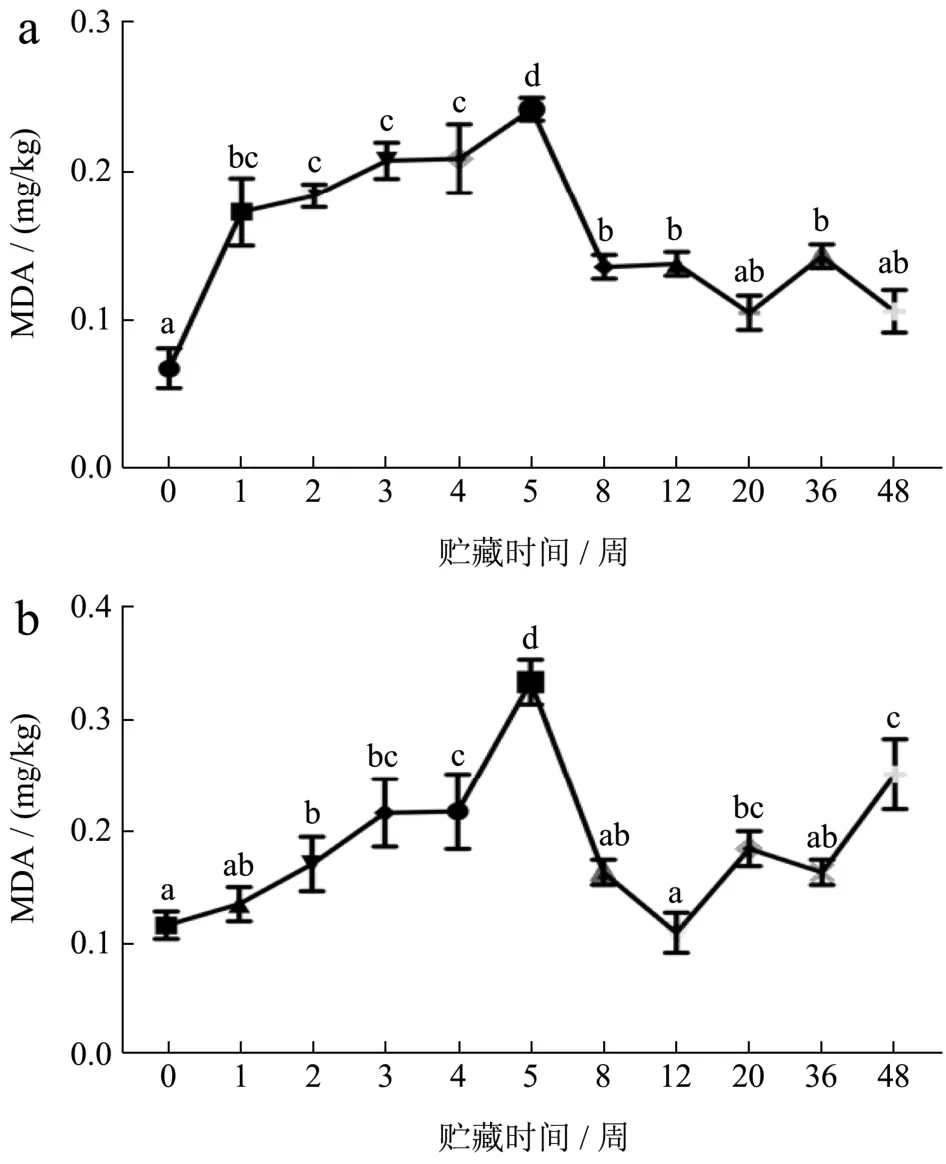
图6 小龙虾冻藏过程中硫代巴比妥酸值(TBARS)的变化Fig.6 Changes in thiobarbituric acid values (TBARS) during frozen storage of crayfish
2.6 冻藏期间小龙虾虾肉蛋白羰基含量的变化
如图7所示,冻藏过程中,FX组和FS组虾肉的蛋白氧化持续发生,FX组虾肉羰基含量从0.028增加至0.094 μmol/g,FS组虾肉羰基含量从0.009增加至0.042 μmol/g。FX组羰基含量增长速率高于FS组,且在0~4周上升速率较快,后期较为平稳。FS组增长速度较为稳定。说明鲜虾组初期蛋白氧化变性较快,后期氧化变性更为缓慢,熟虾组的氧化变性恒速进行[3]。熟制后冻藏的虾肉羰基增量小于鲜虾冻藏组,可能是由于熟虾蛋白聚集严重,大部分羰基被包裹与蛋白疏水性内侧。
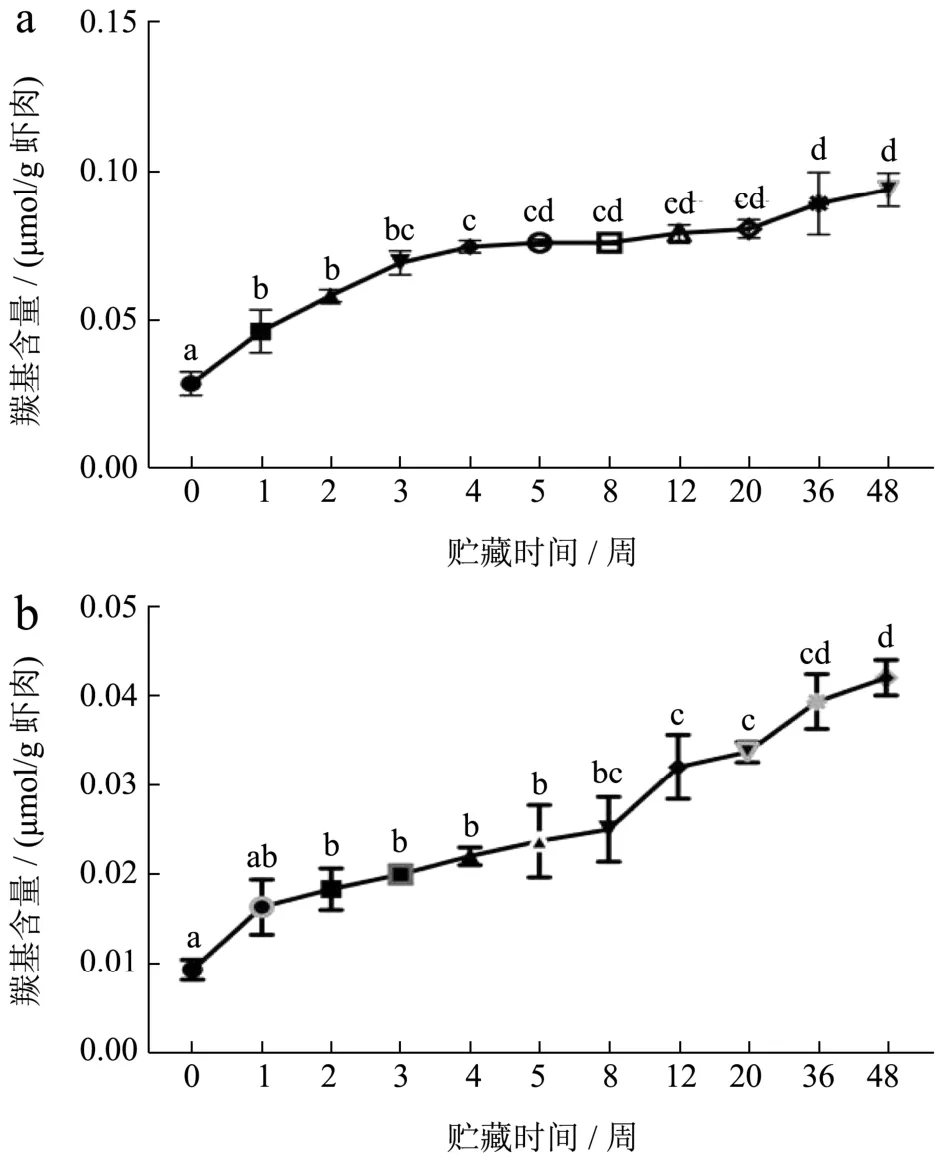
图7 小龙虾冻藏过程中羰基含量的变化Fig.7 Changes in carbonyl content of crayfish during frozen storage
2.7 冻藏期间小龙虾虾肉蛋白质表面疏水性变化
疏水相互作用在维持蛋白质构象中起着主要的作用,由于蒸煮后的虾肉蛋白发生严重不可逆变性,而无法提取肌原纤维蛋白[14],没有测得其表面疏水性变化。如图8,在冻藏前3周,FX组虾肉蛋白质的表面疏水度缓慢上升,然后缓慢下降,整个冻藏期,表面疏水度下降了44.25%(97.09~54.13 BPB结合量/μg)(P<0.05)。冻结使疏水相互作用变弱而氢键变强[5],蛋白质内核中埋藏非极性残基的稳定降低是蛋白冷变性的原因[27]。冻藏期间,虾肉蛋白首先解折叠,然后聚集。冻藏前3周,蛋白质的展开占主导地位,蛋白与水的氢键作用增强,蛋白质分子空间结构打开并逐渐伸展,使埋藏在分子内部的疏水性氨基酸残基暴 露[28],例如疏水性脂肪族和芳香族氨基酸的暴露[14]。随后,蛋白质的聚集占主导地位。一方面,活性基团的暴露引起蛋白分子间作用增强,蛋白质分子的再聚集导致更多疏水性残基被包裹于更加疏水的分子内部,从而引起肌原纤维蛋白的表面疏水度下降[29]。另一方面,冻藏过程发生的蛋白质侧链氧化,这引起蛋白中极性和非极性基团数量改变,减少了静电作用力[30],蛋白与蛋白的氢键作用增强,疏水作用力增强,使得蛋白表面疏水度和溶解度下降[31]。
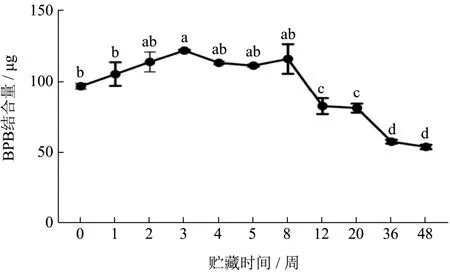
图8 小龙虾冻藏过程中表面疏水度的变化Fig.8 Changes in surface hydrophobicity of crayfish during frozen storage
2.8 冻藏期间小龙虾虾肉蛋白质二级结构变化
酰胺Ⅰ带被认为是研究蛋白质二级结构中最有价值的区域,其中1 600~1 639 cm-1被认为归属于β-折叠结构,1 640~1 650 cm-1归属于无规卷曲结构,1 651~1 660 cm-1归属于α-螺旋结构,1 661~1 700 cm-1归属于β-转角结构[32]。从图9可以看出,冻藏期间,FX组和FS组虾肉蛋白质的α-螺旋和无规卷曲有向β-折叠与β-转角转变的趋势。肌球蛋白主要由α-螺旋构成,α-螺旋的降低和疏水基团的暴露,常伴随着β-折叠的增加[33]。α-螺旋结构的稳定主要由单肽链上羰基(C=O)与氨基(N-H)间形成的链内氢键维持,β-折叠结构则依赖蛋白质分子肽链间的氢键形成[34]。冻藏过程中,α-螺旋的减少和β-折叠的增多,对应说明蛋白分子间静电斥力减小,疏水相互作用增强,蛋白与水间的氢键作用力变小,蛋白与蛋白分子间氢键增多,蛋白可能发生聚集[35]。相对来看,FS组的β-结构波动较小,仅在4和8周明显体现,程丽娜 等[34]研究认为冷冻对分子间作用力,如疏水作用力影响较大,可能是由于高温蒸煮使蛋白不可逆变性,蛋白与蛋白间的氢键作用很强,所以冻藏对熟制虾肉的分子间疏水作用力改变较小。
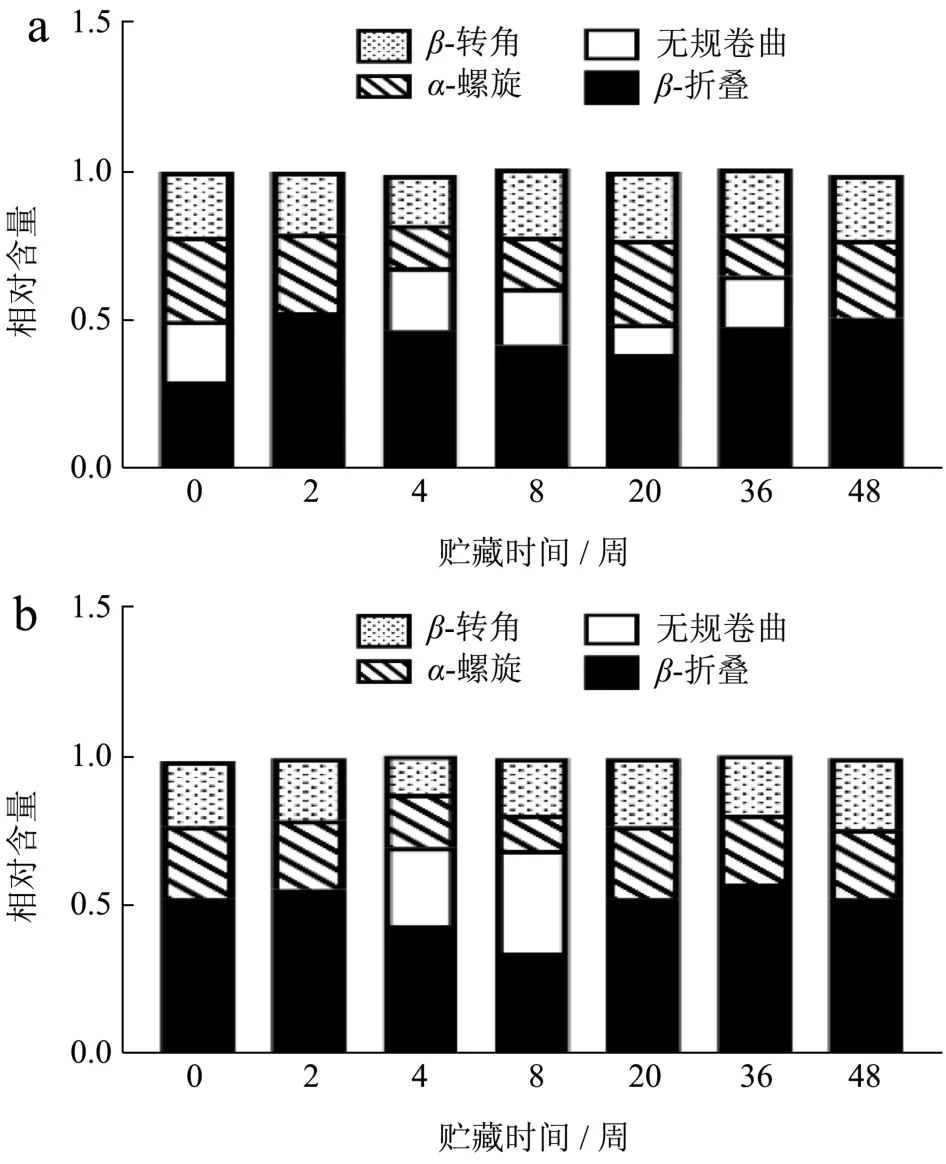
图9 小龙虾冻藏过程中蛋白质二级结构的变化Fig.9 Changes in protein secondary structure during frozen storage of crayfish
2.9 冻藏期间小龙虾虾肉蛋白质总巯基含量变化
巯基氧化是以自由基为媒介的蛋白质氧化反应。如图10所示,FX组虾肉蛋白质在冻藏48周后,总巯基的含量降低41%。巯基含量降低表明蛋白发生了变性,或者通过形成分子间的二硫键而聚集,或者发生了氧化。二硫键主要参与蛋白质网状结构的形成,它可以在冻结、冷冻储存或解冻过程中形成,然后蛋白质的疏水键和亲水键再在分子内和分子间发生重排形成稳定的网状结构[15]。冻藏期间,FS组的总巯基含量在0.26~0.81 μmol/g样品范围波动变化,可能是因为熟肉中总巯基含量较低,初始值仅为0.61 μmol/g样品,多数已经通过高温氧化交联,并由于蛋白变性而被埋藏在蛋白疏水内部,DTNB不能进入内部与游离巯基反应,因此在整个冻藏期间,总巯基含量在较低的范围内波动,这与Dai等[16]研究短期冻藏预蒸煮猪肉,巯基稳定下降结果不同。
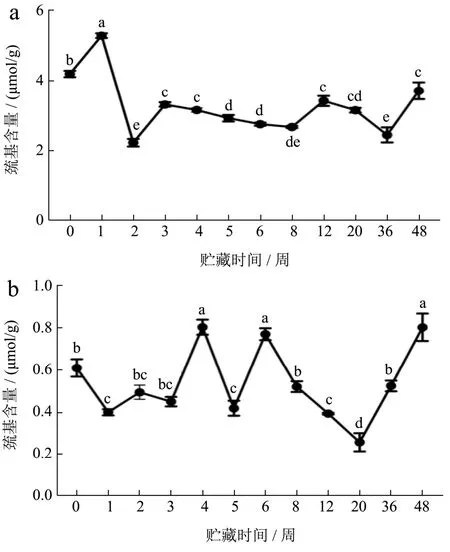
图10 小龙虾冻藏过程中总巯基含量的变化Fig.10 Changes in total sulfhydryl content during frozen storage of crayfish
2.10 冻藏期间小龙虾虾肉蛋白质不同指标间的相关性分析
由图11可见,FX鲜虾组,羰基含量与内聚力呈极显著负相关(P<0.01),与咀嚼性、硬度呈显著负相关(P<0.05),表明蛋白氧化显著影响虾肉口感;TVB-N和表面疏水性呈著负相关(P<0.05);质构参数之间有相互影响,表现为内聚力与硬度呈极显著正相关(P<0.01),与硬度呈显著正相关(P<0.05),咀嚼性与硬度呈极显著正相关(P<0.01),与硬度呈显著正相关(P<0.05)。
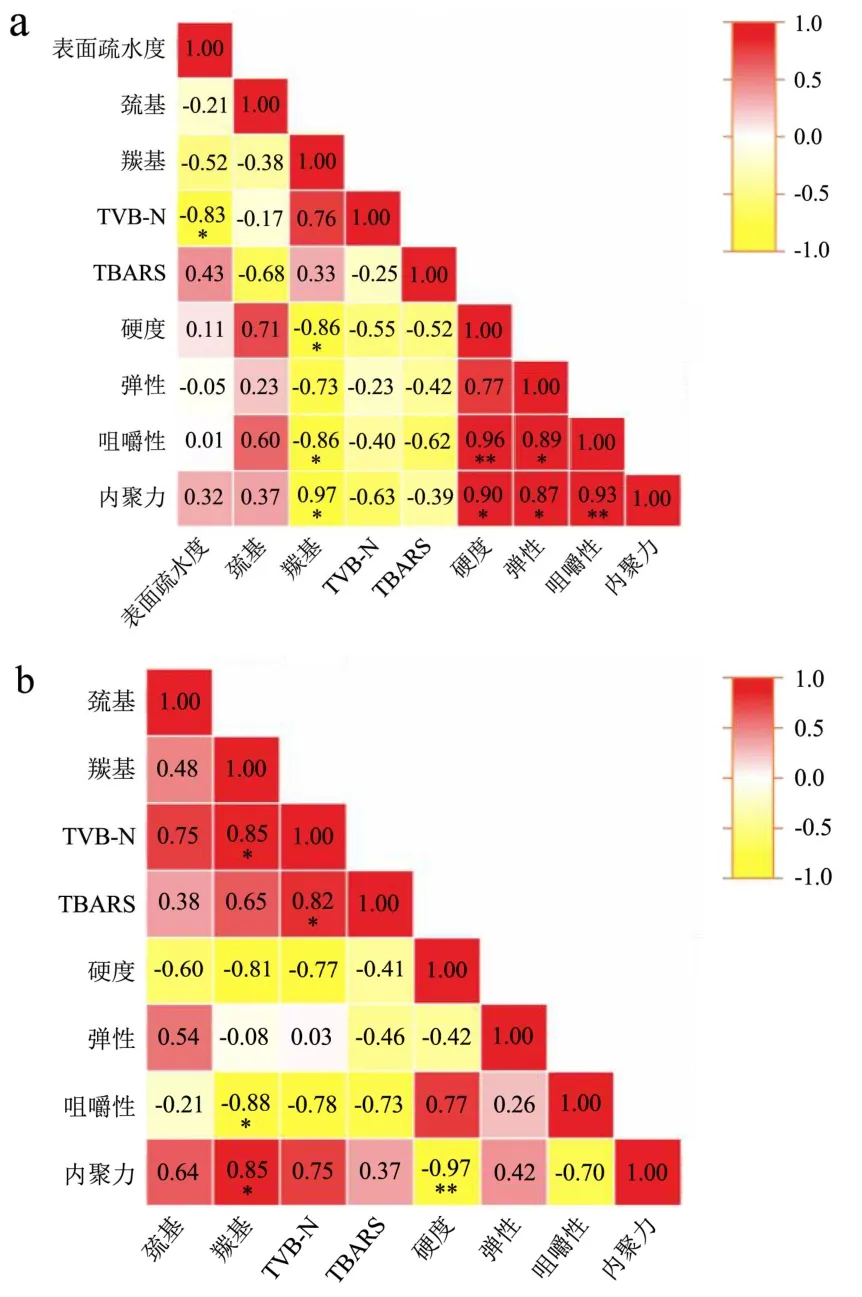
图11 小龙虾冻藏过程中不同测定指标之间Pearson相关系数热图Fig.11 Heat map of Pearson correlation coefficients between different measured indicators during frozen storage of crayfish
FS熟虾组,硬度与内聚力呈极显著负相关 (P<0.01),表明细胞间作用力显著影响虾肉硬度;羰基含量与内聚力、TVB-N呈显著正相关(P<0.05),与咀嚼性呈显著负相关(P<0.05),表明蛋白氧化显著影响蛋白降解和蛋白间作用力;TVB-N与TBARS呈显著正相关(P<0.05),表明脂质氧化显著影响蛋白降解。
3 结论
鲜活冻结和蒸煮后冻结的小龙虾在冷冻贮藏48周后,TVB-N值分别为22.93和11.90 mg/100 g,均未超过安全限值,但虾肉质构相关指标的显著变化。随着冻藏时间的延长,肌原纤维蛋白发生降解和聚集,蛋白质二级结构发生显著变化,α-螺旋和无规卷曲向β-折叠与β-转角发生转变。蛋白疏水相互作用变弱而氢键变强,蛋白质侧链和脂肪的氧化也改变了体系的静电作用力,表面疏水度从97.09升至122.16 BPB结合量/μg,再下降至82.79 BPB结合量/μg,蛋白质和脂肪的氧化作用持续发生。
鲜活冻结和蒸煮后冻结的小龙虾相比,各项指标的变化趋势相似,虾肉在冻藏期间的质构劣化和TVB-N值上升与肌肉蛋白质的羰基含量、表面疏水性、TBARS值具有显著相关性。熟虾在长期冷冻贮藏期间蛋白质理化指标与活虾冷冻组相比波动较小,主要是因为蒸煮使虾肉蛋白完全变性,虾肉脱水、灭酶,减少了冻藏期间冰晶对肌肉纤维的机械损伤和氧化作用。所以建议小龙虾进行蒸煮处理后再进行冷冻贮藏。

