基于低拷贝质粒的高产紫色杆菌素谷氨酸棒杆菌的构建和发酵
卢丹妮,洪沛雄,张国超,叶燕锐
(华南理工大学生物科学与工程学院,广东广州 510006)
紫色杆菌素(Violacein)是一种含有双吲哚的紫色天然色素[1],具有抗肿瘤、抗致病菌、抗病毒、抗氧化等活性[2,3],在食品、印染、化妆品和医药行业都有重要的潜在应用价值[4]。紫色杆菌素来源于紫色色杆菌(Chromobacterium violaceum)、蓝黑紫色杆菌(Janthinobacterium lividum)等革兰氏阴性细菌,其生物合成从L-色氨酸开始,先后通过vioABCDE操纵子编码的5个酶(VioA、VioB、VioE、VioD和VioC)催化合成。紫色色杆菌、蓝黑紫色杆菌[5]等天然菌种为条件致病菌,使紫色杆菌素的发酵生产与在食品领域的应用受到限制。Pemberton等[6]首次将紫色杆菌素操纵子克隆至大肠杆菌(Escherichia coli)中,但仅获得浅紫色的菌落,未测定紫色杆菌素的产量。Rodrigues等[7]通过敲除trpR、tnaA、sdaA基因,过表达莽草酸途径中aroFBL和tktA等多步遗传操作,提高大肠杆菌内的L-色氨酸含量,使脱氧紫色杆菌素的产量提高到了277 mg/L。蒋培霞等[8]选用来源Duganellasp.B2菌株的紫色杆菌素基因,并在大肠杆菌、产气肠杆菌(Enterobacter aerogenes)和弗氏柠檬酸杆菌(Citrobacter freundii)等革兰氏阴性细菌中进行紫色杆菌素的异源合成,结果显示在弗氏柠檬酸杆菌工程菌的产量最高,经优化后可达到1.68 g/L,但该宿主是一种条件致病菌,不适合用于食品行业产品的工业发酵。谷氨酸棒状杆菌(Corynebacterium glutamicum)是氨基酸的主要生产菌,作为公认的食品安全菌株(Generally Recognized as Safe,GRAS),在食品领域得到广泛应用和研究。孙宏年等[9,10]将来源于蓝黑紫色杆菌的紫色杆菌素操纵子重叠基因进行解耦,并在每个开放阅读框(Open Reading Frame,ORF)上游添加核糖体结合位点(Ribosome Binding Site,RBS),然后克隆到中高拷贝的pEC-XK99E质粒,并转化谷氨酸棒状杆菌ATCC 13032和ATCC 21850等菌株中,在LBHIS培养基中进行摇瓶发酵,ATCC 13032的紫色杆菌素产量达到约200 mg/L,而在发酵培养基中,ATCC 21850的紫色杆菌素产量约180 mg/L。本研究首先从谷氨酸棒状杆菌天然大质粒的复制与分配元件,构建了新的大肠杆菌-谷氨酸棒状杆菌低拷贝穿梭质粒,并基于该低拷贝质粒,初步以谷氨酸棒状杆菌ATCC 13032为宿主合成紫色杆菌素,发现了基于低拷贝质粒的紫色杆菌素比基于中高拷贝质粒的紫色杆菌素产量更高。此外,考虑到谷氨酸棒状杆菌基因组中存在许多可表达转座酶的插入序列(Insertion Sequence,IS)元件,会通过转座作用破坏外源引入的DNA,不仅限制菌种的遗传操作,在工业生产中还会导致菌株生产力下降和退化的情况[11,12],本研究也比较了基于低拷贝质粒的紫色杆菌素操纵子在IS序列删除的谷氨酸棒状杆菌株中的产量,发现IS序列的删除可提高紫色杆菌素的产量。本研究进一步对其中产量最高的重组菌株进行紫色杆菌素的发酵条件优化。本研究的结果为低拷贝质粒用于紫色杆菌素的高效合成提供了新的角度。
1 材料与方法
1.1 材料与试剂
SpeI、EcoRI、EcoRV、DpnI等DNA限制性内切酶,赛默飞科技有限公司;DNA marker和Primer STAR Max DNA聚合酶,日本TaKaRa公司;KOD FX聚合酶,东洋纺(上海)生物科技有限公司;硫酸卡那霉素、氯霉素、IPTG(异丙基-β-D-硫代吡喃半乳糖苷),北京索莱宝科技有限公司;质粒小量快速提取试剂盒、细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司;DNA纯化回收试剂盒,南京诺唯赞公司。
实验所用的菌株和质粒见表1和表2。
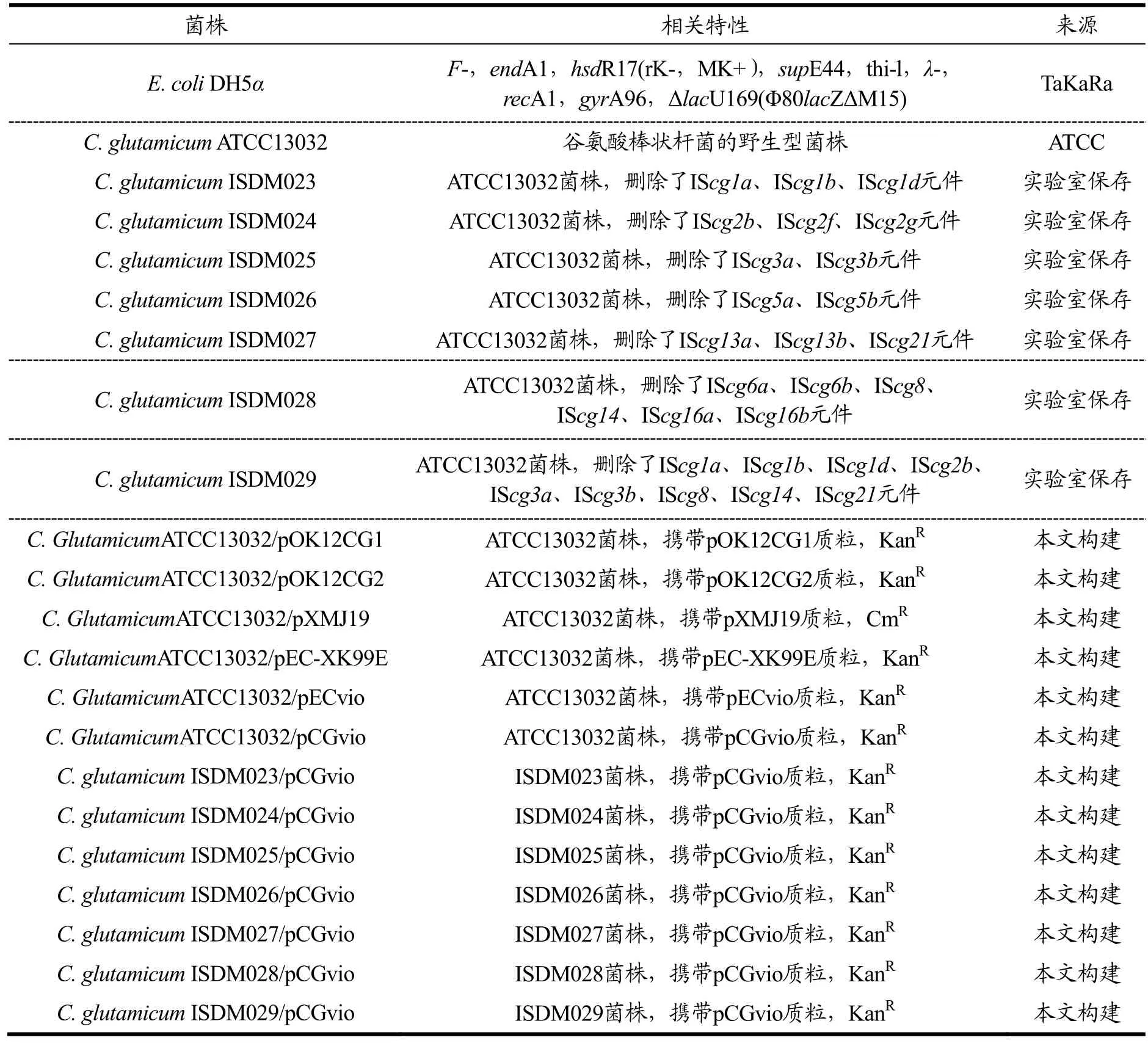
表1 本研究所用的菌株Table 1 Strains used in this study

表2 本研究所用的质粒Table 2 Plasmids used in this study
1.2 培养基的配制
LBHIS培养基(1 L)[13]:由LB和BHIS分别配制,使用前等比例混合而成。
LB培养基(1 L):蛋白胨10 g,酵母膏5 g,氯化钠5 g。
BHIS培养基(1 L):脑心浸液肉汤粉末37 g,山梨醇91 g。
1.3 仪器与设备
声波细胞粉碎机购自宁波新芝生物科技责任有限公司。
T100PCR扩增仪和Gene Pulser Xcell电穿孔仪均购自美国Bio-Rad公司;Tanon-5200 Multi凝胶成像系统购自上海天能科技有限公司;微量紫外分光光度计NP80购自德国Implen公司;TECAN infinite M200 Pro多功能光栅酶标仪购自德国TECAN公司;JY92-Ⅱ超
1.4 方法
1.4.1 谷氨酸棒状杆菌低拷贝质粒复制子的获取
本实验构建的低拷贝质粒所需的复制子序列来源于谷氨酸棒状杆菌的pTET3[14],包括repA、parA和parB基因,以及两个22 bp-box序列,由上海捷瑞生物工程有限公司合成,并克隆至pOK12载体中,命名为pOK12CG1。参考文献[13]的方法将pOK12CG1质粒电转至ATCC13032,得到ATCC13032/pOK12CG1菌株。电转化率的计算:将0.5 μg质粒转化至ATCC13032后,取适量转化液涂布在对应抗性的BHIS平板上,30 ℃孵育2 d,每个实验重复3次,按公式(1)计算菌落个数并得出转化效率。
式中:
a——电转化效率;
b——菌落总数;
c——DNA总量;
n——稀释倍数。
1.4.2 质粒相容性分析
将pXMJ19、pEC-XK99E质粒同时电转至ATCC 13032/pCGBACT1谷氨酸棒状杆菌感受态,涂布至含有卡那霉素(Kanamycin,Km)和氯霉素(Chloramphenicol,Cm)的BHIS(Km质量浓度 25 μg/mL,Cm质量浓度17 μg/mL)平板培养,通过菌落PCR进行转化子验证。
1.4.3 质粒稳定性分析
传代实验步骤[15]:取ATCC 13032/pOK12CG1、ATCC 13032/pXMJ19、ATCC 13032/pEC-XK99菌株进行平板划线活化,然后分别挑取3种单菌落至含对应抗生素(Km质量浓度25 μg/mL或Cm质量浓度 17 μg/mL)的BHIS培养基中于30 ℃过夜生长;将其接种至10 mL无抗生素的液体BHIS培养基(保证初始OD600≈0.05);将细胞在30 ℃,250 r/min培养24 h,每隔24 h将细胞重复转移到新鲜的无抗培养基中,同时,在稀释106倍后均匀涂布在添加或不添加抗生素的BHIS平板上,30 ℃培养2~3 d,每组设3个平行;通过公式(2)计算两种平板的菌落数来计算丢失率。
式中:
d——质粒丢失率,%;
e——无抗性平板上的菌落总数;
f——抗性平板上的菌落总数。
1.4.4 质粒拷贝数测定
按参考文献[16]的方法,采用定量PCR测定质粒的拷贝数。计算拷贝数的公式如下:
式中:
g——质粒与基因组的相对拷贝数;
h——基因组大小,bp;
i——质粒DNA的量,pg;
j——质粒DNA的大小,bp;
k——基因组DNA的量,pg。
近年来,中央及各地政府机构加大财政投入,加强资源整合,在农村地区开展卫生治理、村庄环境建设、道路修建等一系列基础建设工作,使得乡村呈现出天蓝、水绿、村民安居乐业的美好景象。
1.4.5 紫色杆菌素重组表达质粒的构建与鉴定
采用Takara的Primer STAR Max DNA聚合酶,以pOK12CG1质粒和pECvio质粒为模板,分别扩增线性pOK12CG1载体片段、ID1以及ID2片段,DpnI消化过夜后,进行DNA凝胶回收,通过Gibson assembly进行组装并电转E.coliDH5α;提取阳性克隆的质粒,使用限制性内切酶EcoRV进行单酶双酶切验证正确后进行测序。
1.4.6 紫色杆菌素重组菌的构建
先将测序正确的重组质粒pCGvio电转化至C.glutamicumATCC 13032和7株敲除不同IS序列的ATCC 13032菌株(见表1)中,涂布在无抗生素或者含有卡那霉素抗性BHIS平板上,同时将C.glutamicumATCC13032/pECvio菌株划线活化,9组平板均置于30 ℃培养24 h;从BHIS平板中挑选出线紫色单克隆于对应抗性的BHIS液体培养基中30 ℃培养并保存。
1.4.7 紫色杆菌素重组菌的发酵
在超净工作台中,将1.4.6中得到的8个重组菌株的阳性转化子以及对照组C.glutamicumATCC13032、C.glutamicumATCC13032/pECvio菌株单菌落接种至装有5 mL含相应抗生素的液体BHIS培养基中,30 ℃、220 r/min培养12 h,再以1%(m/V)接种量转接至含50 mL LBHIS培养基的100 mL三角摇瓶中,30 ℃、220 r/min培养12 h后加入1 mmol/L IPTG试剂,以20 ℃、220 r/min条件培养72 h,获得发酵液。
1.4.8 紫色杆菌素的检测

图1 紫色杆菌素的标准曲线Fig.1 Standard Curve of violacein
(2)发酵体系中紫色杆菌素的测定:按文献方 法[9,16]获取紫色杆菌素的粗提乙醇溶液,使用微量紫外线分光光度计测定OD570值,按标准曲线算出紫色杆菌素的浓度值,求出紫色杆菌素的产量。
1.4.9 正交法优化发酵培养条件
本研究采用LBHIS丰富培养基作为发酵培养基,以诱导剂添加时间、诱导剂(IPTG)浓度及培养基(LB:BHIS)比例为考察因素,按照正交设计表L9(34)设计3个因素3个水平的正交试验,比较不同发酵条件组合对紫色杆菌素产量的影响。试验设计的因素和水平见表3。
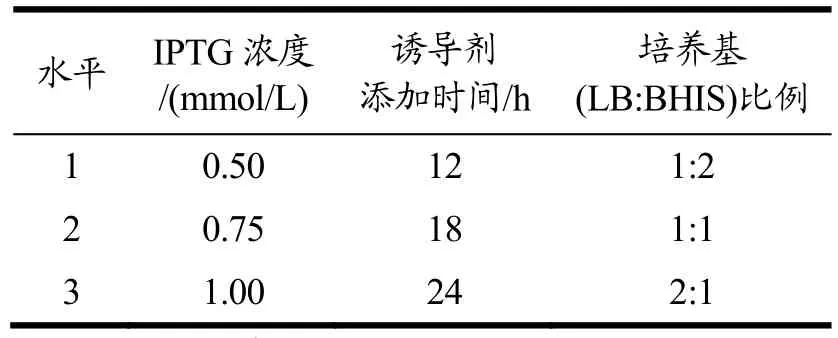
表3 发酵条件优化因素表Table 3 Optimization factors of fermentation conditions
1.4.10 数据分析方法
采用SPSS 19.0在线软件进行正交实验的单因素和多因素方差分析[17],采用Graphpad prism 8.0软件进行图表的绘制。
2 结果与讨论
2.1 低拷贝载体pOK12CG1的构建
典型的低拷贝质粒含有编码分配相关蛋白的parA和parB基因、类着丝粒元件parS和编码复制蛋白的repA基因[18,19]。谷氨酸棒状杆菌的天然大质粒为低拷贝质粒(一般5~10拷贝/基因组)[15],因此可以将其复制和分配的关键元件用于构建低拷贝的大肠杆菌-谷氨酸棒状杆菌穿梭载体。由于谷氨酸棒状杆菌大多数天然大质粒的基因缺乏注释,选择注释相对清楚的pTET3(27.8 kb)[14]作为出发质粒。pTET3来源于谷氨酸棒状杆菌LP-6,属于pCG1家族,其中编码分配相关蛋白的parA和parB基因、编码复制蛋白的repA基因、以及pCG1家族特有的与低拷贝质粒的复制和维持有关的22 bp-box等[20]关键基因/元件有明确的注释,且分布比较集中(图2),但其类着丝粒元件parS的序列未知。本研究选择从repA上游300 bp到parA下游300 bp的3.7 kb序列,进行基因合成,并克隆至pOK12中,构建得到pOK12CG1(图3)。为了测试pOK12CG1是否可在大肠杆菌和谷氨酸棒状杆菌中穿梭,将其电转化至谷氨酸棒状杆菌ATCC 13032中,并以pOK12和两个常见的大肠杆菌-谷氨酸棒状杆菌穿梭质粒pXMJ19和pEC-XK99E作为对照,结果发现pOK12CG1的转化效率约为104CFU/μg,与pXMJ19和pEC-XK99E的转化效率接近,而pOK12无法转化谷氨酸棒状杆菌(图4),说明3.7 kb序列与pOK12组成的pOK12CG1为大肠杆菌-谷氨酸棒状杆菌穿梭质粒。谷氨酸棒状杆菌pCG1家族质粒的 22 bp-box序列对于质粒的复制和维持有重要的作 用[20,21],而3.7 kb中含有2个22 bp-box,为证明其作用,决定从pOK12CG1载体中删除了含有该2个 22 bp-box区域的104 bp序列,得到pOK12CG2。电转化的结果表明,pOK12CG2比pOK12CG1载体低90倍(图4),说明了这两个22 bp-box序列对pOK12CG1在谷氨酸棒状杆菌中的自主复制具有重要的作用。
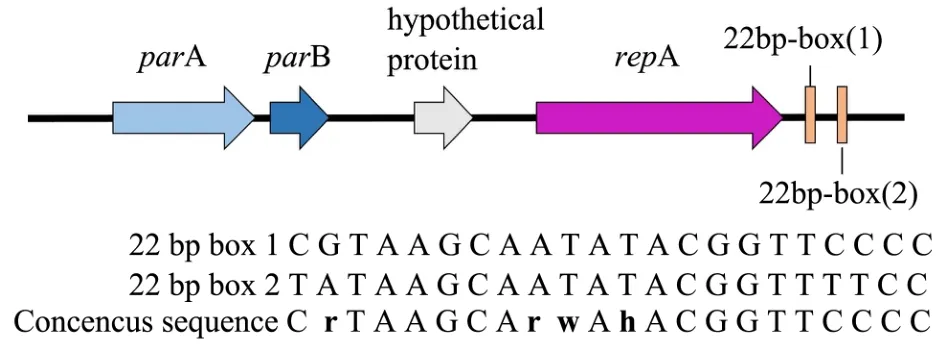
图2 pTET3复制和分配序列示意图Fig.2 Schematic diagram of the replication and distribution sequence of pTET3
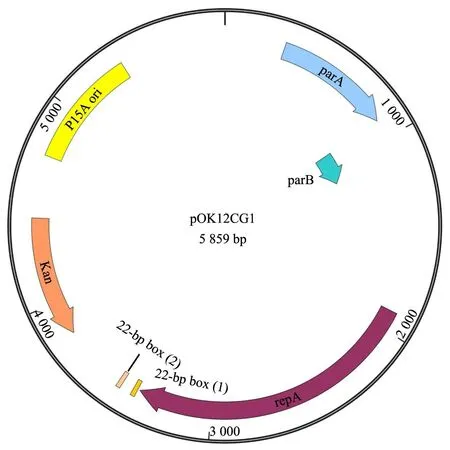
图3 pOK12CG1质粒图谱Fig.3 Schematic diagram of pCG12CG1 plasmid
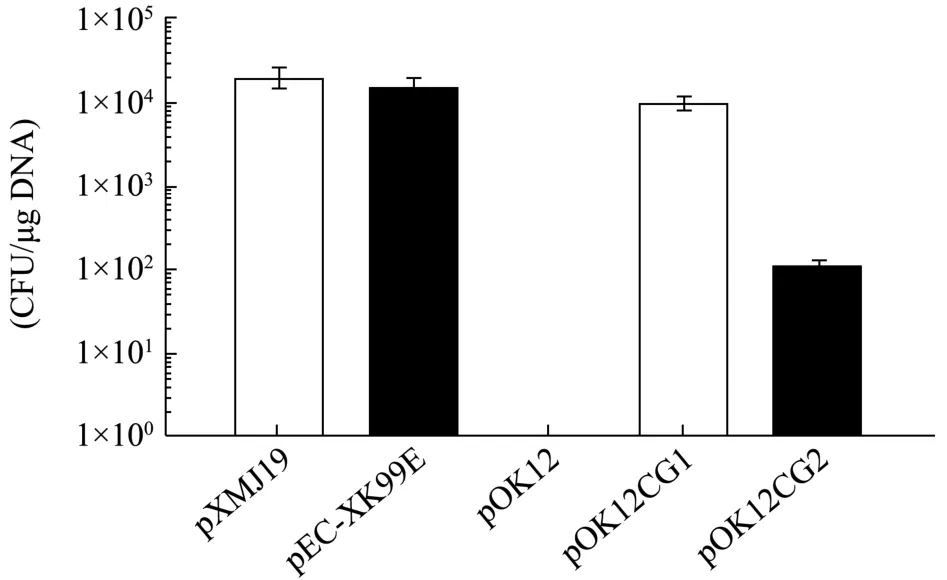
图4 pOK12CG1质粒的电转化效率Fig.4 Electroporation efficiency of pOK12CG1 plasmid
2.2 pOK12CG1质粒复制稳定性、拷贝数与相容性分析
为评估连续传代培养过程中质粒在谷氨酸棒状杆菌宿主中的稳定性,我们将ATCC 13032/pOK12CG1菌株接种于无抗生素的BHIS液体培养基中并连续传代12 d,结果显示,在连续传代12 d后,pOK12CG1的平均丢失率约为56%,与谷氨酸棒状杆菌常用的pXMJ19(~74%)和pEC-XK99E(~56%)相近(图5),表明pOK12CG1在无抗性的培养基中完全仍然可以相对稳定地复制。
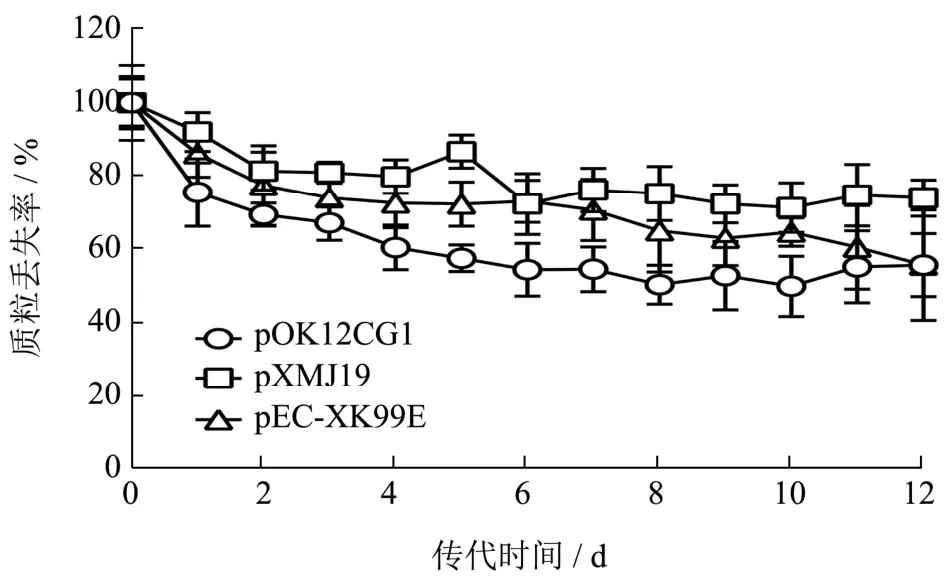
图5 pOK12CG1载体复制能力验证Fig.5 Verification of replication ability of pOK12CG1 vector

表4 pOK12CG1载体的质粒拷贝数Table 4 Plasmid copy number of pOK12CG1 vector
采用qPCR法测定了pOK12CG1、pXMJ19与pEC-XK99E质粒的拷贝数,结果表明,中等拷贝的pXMJ19和高拷贝的pEC-XK99E的拷贝数分别为约40~90拷贝/基因组和约290~430拷贝/基因组,与文献报道接近[22,23],而pOK12CG1的拷贝数为3~9拷贝/基因组,与文献报道的pTET3质粒的拷贝数(5~10拷贝/基因组)[14]相当,属于低拷贝质粒[13,24]。为研究谷氨酸棒状杆菌低拷贝载体pOK12CG1的相容性,选择分别基于pBL1/colE和rep/colE复制子的pXMJ19和pEC-XK99E穿梭载体作为相容性测试的质粒,把pXMJ19(pBL1/colE复制子)、pEC-XK99E(rep/colE复制子)、pOK12CG1(pTET3/p15A复制子)依次电转化至谷氨酸棒状杆菌ATCC 13032中,并对含有3种质粒的转化子进行连续7 d的传代培养,菌落PCR的结果表明,说明pOK12CG1载体能与含pBL1/colE复制子和含rep/colE复制子系列质粒相容(图6)。
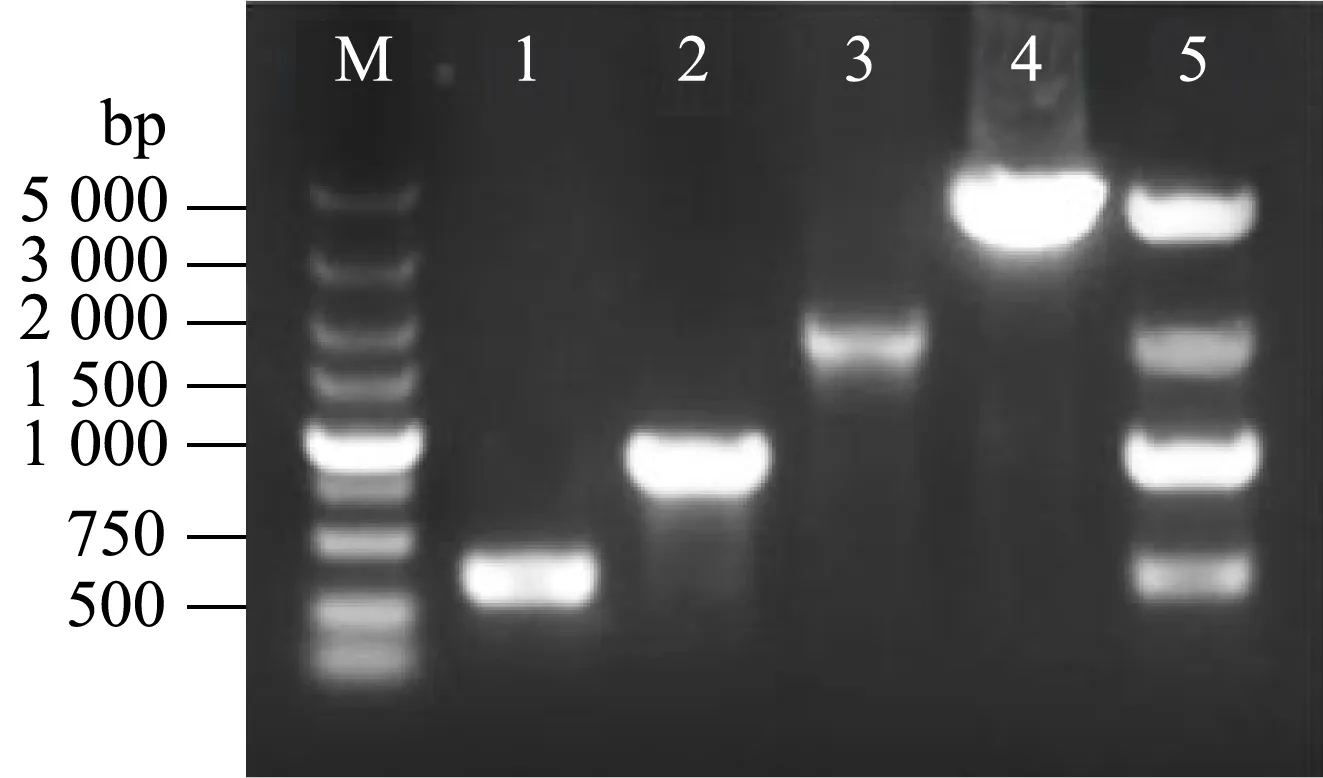
图6 ATCC 13032菌株的转化子菌落PCR验证Fig.6 PCR verification of transformant colonies of ATCC 13032
2.3 紫色杆菌素低拷贝质粒与重组菌株的构建
通过将文献报道的紫色杆菌素操纵子[10]克隆至低拷贝pOK12CG1中获得pCGvio质粒。其中紫色杆菌素操纵子由诱导型启动子Ptrc控制,紫色杆菌操纵子中的每个基因上游加入了RBS序列[10]。构建的结果如图7a所示,构建pCGvio质粒所需的线性载体pOK12CG1为5 869 bp,ID1片段4 235 bp,ID2片段为4 690 bp(图7a)。将3个片段进行Gibson assembly并电转化至E.coliDH5α,在37 ℃过夜培养后,LB抗性平板长出紫色菌落,将平板放置20 ℃以下过夜后紫色变深(图7c),说明质粒已成功转入大肠杆菌并生成紫色杆菌素。酶切(图7b)、菌落PCR(图7d)和测序的结果证明pCGvio质粒构建成功,质粒图谱如图8所示。
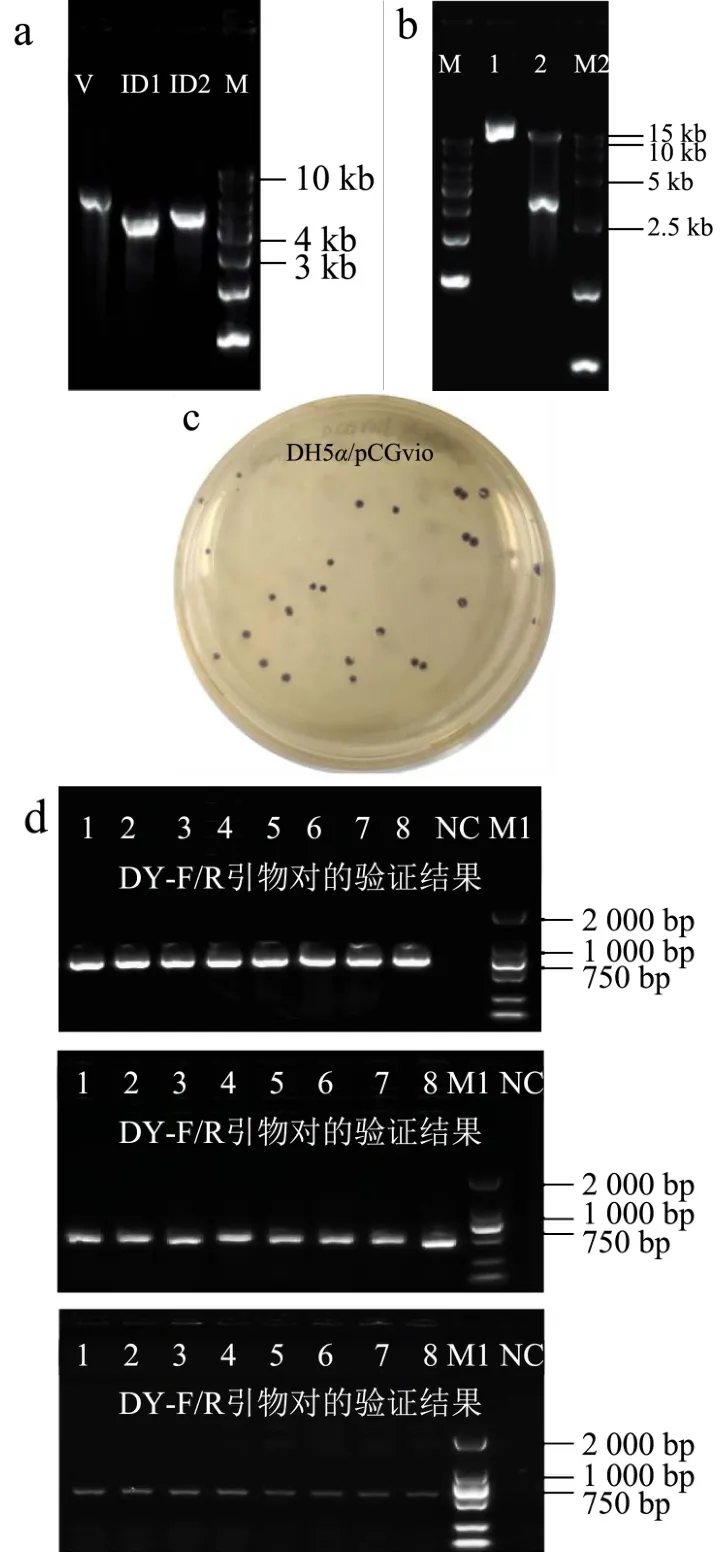
图7 pCGvio质粒构建Fig.7 Construction of pCGvio plasmid
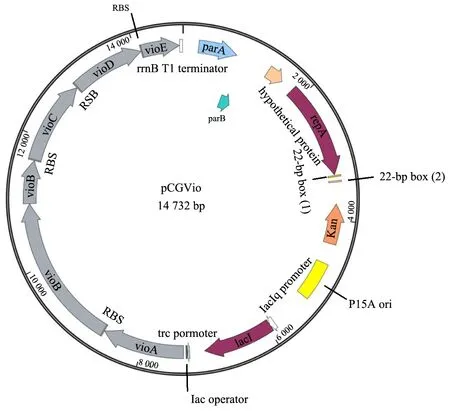
图8 pCGvio质粒图谱Fig.8 Schematic diagram of pCGvio plasmid
将低拷贝的pCGvio质粒转化至8株谷氨酸棒状杆菌菌株(ATCC 13032、ISDM023、ISDM024、ISDM02、ISDM026、ISDM027、ISDM028和ISDM029)中(菌株信息见表1),得到基于低拷贝质粒的紫色杆菌素重组菌株ATCC 13032/pCGvio、ISDM023/pCGvio、ISDM024/pCGvio、ISDM025/pCGvio、ISDM026/pCGvio、ISDM027/pCGvio、ISDM028/pCGvio和ISDM029/pCGvio,同时将高拷贝的pECvio质粒(与孙宏年等[9,10]报道的pEC-C-vio1质粒相同)转化ATCC 13032,得到基于高拷贝质粒的紫色杆菌素重组菌株ATCC 13032/pECvio。我们将紫色杆菌素重组菌株在摇瓶中,30 ℃培养12 h后添加1 mmol/L IPTG,20 ℃培养72 h后提取紫色杆菌素,使用图1的标准曲线估算各重组菌株的紫色杆菌素产量(图9)。空白对照菌株C.glutamicumATCC 13032在发酵过程中未检测到紫色杆菌素;紫色杆菌素重组菌株在发酵过程中可观察到发酵液颜色变为紫色,其中基于高拷贝质粒的重组菌株ATCC 13032/pECvio紫色杆菌素产量约为376 mg/L,比张宏年等[10]使用相同菌株和质粒的紫色杆菌素产量(约200 mg/L)高88%,这一差异可能是由于我们的发酵时间(90 h)比张宏年等[10]更长(70 h)所致。有趣的是,基于低拷贝质粒的重组菌株ATCC 13032/pCGvio紫色杆菌素产量 (500 mg/L)比高拷贝质粒的重组菌株ATCC 13032/pECvio(376 mg/L)高33%。而在IS删除的大部分重组菌株紫色杆菌素产量>500 mg/L,其中ISDM023/pCGvio菌株产量达到了610 mg/L,比ATCC 13032/pCGvio高22%。
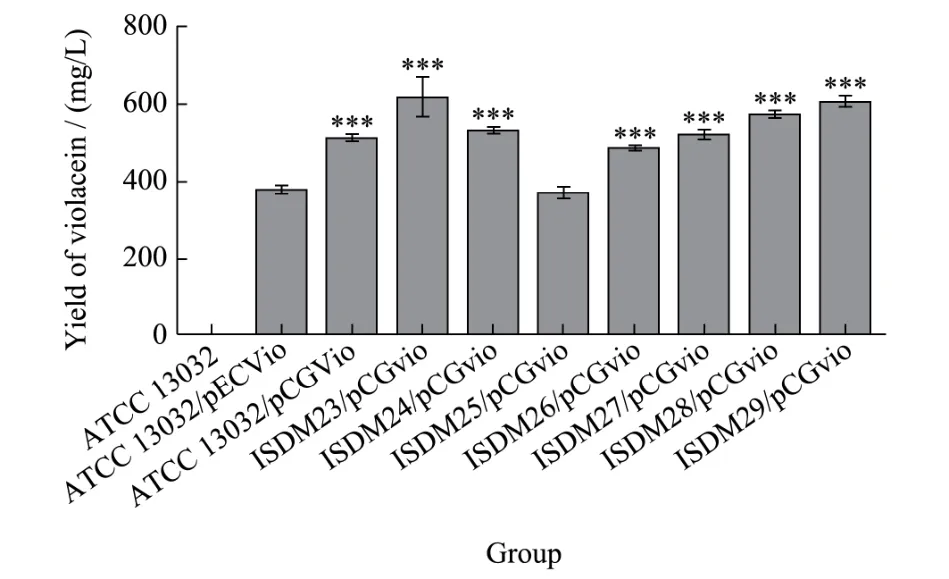
图9 不同宿主中紫色杆菌素的产量Fig.9 The yield of violacein in different hosts
上述结果表明,基于低拷贝质粒的谷氨酸棒状杆菌重组菌株紫色杆菌素产量高于高拷贝质粒,类似的现象在其它物种与其它产物也有报道,在E.coli中使用低拷贝质粒合成番茄红素的产量是高拷贝质粒的2~3倍[25],说明了在某些代谢工程中,低拷贝质粒可能减轻了代谢符合,更利于提高细胞的生产能力。需提出的是谷氨酸棒状杆菌ATCC 13032不是色氨酸高产菌株,仅在丰富培养基(如LBHIS)中可以高效合成紫色杆菌素,而在发酵培养基中的产量很 低[9,10],可改用色氨酸高产菌株(如CICC 20192、ATCC 21850等)作为宿主,构建高产紫色杆菌素的重组菌株。
2.4 紫色杆菌素的发酵条件优化
诱导剂浓度、诱导剂添加时间和培养温度对紫色杆菌素的在谷氨酸棒杆菌ATCC 21850中的产量有直接影响[9,10],本实验使用的宿主为ATCC 13032,需用丰富培养基LBHIS进行发酵,因此选取三个主要因素:诱导剂添加时间、诱导剂浓度及培养基比例(VLB:VBHIS),通过设计3个因素3个水平的正交试验来筛选合适的发酵条件[26],结果如表5、图10所示。

图10 正交试验中紫色杆菌素产量Fig.10 The yield of violacein in orthogonal test
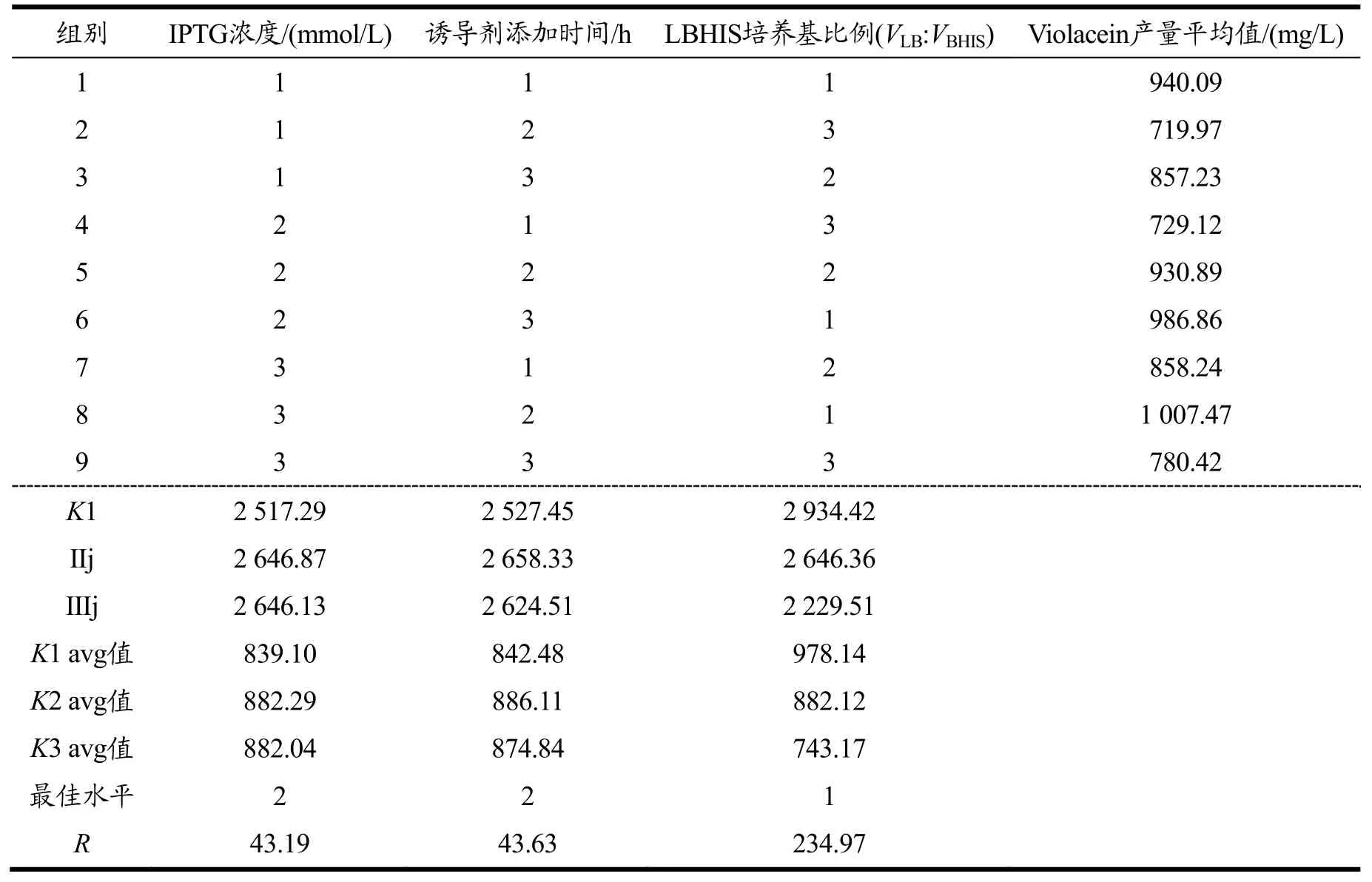
表5 正交设计实验结果Table 5 Experimental results of orthogonal design
通过表5直观地分析得知,携带pCGvio质粒的ISDM023菌株经采用不同发酵条件进行紫色杆菌素的表达,其含量最高可达到1 007.47 mg/L;此外,由各因素的极差值大小可判断对紫色杆菌素表达量的影响大小分别为:培养基比例(VLB:VBHIS)>诱导剂添加时间>IPTG浓度。
从表6的多因素方差分析结果可知IPTG浓度、诱导剂添加时间、培养基比例(VLB:VBHIS)这3个因素对于Viol产量的差异关系:IPTG浓度、诱导剂添加时间并不会对产量产生差异关系,只有培养基比例(VLB:VBHIS)会对产量产生显著性差异关系(P<0.05),进一步使用单因素方差研究该因素发现(表7)培养基比例(VLB:VBHIS)中的两两水平间也存在显著性差异,说明LB与BHIS培养基的比例确实对紫色杆菌素的产量有较大影响。在最优发酵条件下,重组菌株ISDM023/pCGvio的紫色杆菌素产量为1 007.47 mg/L。本研究主要采用摇瓶发酵的方法,对于补糖、溶氧、pH值等因素均无法有效控制,未充分挖掘重组菌株发酵合成紫色杆菌素的潜力,后续和进一步通过微型或小型发酵罐,对上述因素开展更为全面的发酵优化。
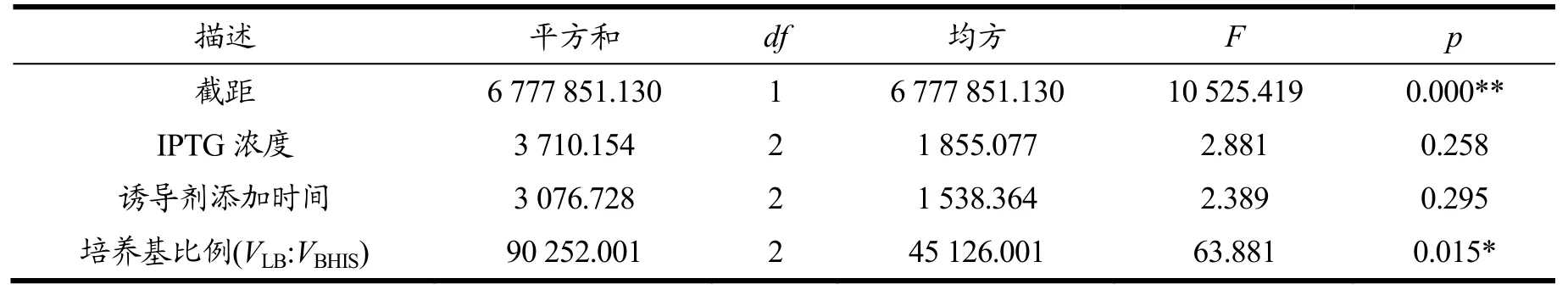
表6 正交试验的多因素方差分析结果Table 6 Results of multivariate analysis of variance of orthogonal test

表7 培养基比例(VLB:VBHIS)因素的方差分析结果Table 7 Results of ANOVA for the scale factor of medium (VLB:VBHIS)
3 结论
在本研究中,我们构建的低拷贝质粒pOK12CG1能与常用的pXMJ19和pEC-XK99E具有相容性,为谷氨酸棒状杆菌的代谢工程改造提供更多选择。发酵实验结果显示:基于低拷贝质粒pOK12CG1的谷氨酸棒状杆菌重组菌株紫色杆菌素产量显著高于基于高拷贝质粒pEC-XK99E的重组菌株;以IS元件删除菌株为宿主,可以提高紫色杆菌素的产量,为谷氨酸棒状杆菌菌种的进一步改良提供了参考。此外,本文通过以删除3个IS基因的谷氨酸棒状杆菌ISDM023菌株为宿主,低拷贝载体pCGvio为基因表达工具,构建了一株高效合成紫色杆菌素的重组菌株ISDM023/pCGvio。使用正交实验法对该菌株的培养条件进行了优化,最终确定最佳诱导剂浓度是0.75 mmol/L,最佳诱导剂添加时间是30 ℃培养18 h后,最佳LBHIS培养基比例为LB和BHIS体积比1:2。综上,本研究基于低拷贝质粒,构建了紫色杆菌素的谷氨酸棒状杆菌重组菌株ISDM023/pCGvio,其紫色杆菌素产量高于基于高拷贝质粒的重组菌株,经过摇瓶发酵优化,产量可达到1 007 mg/mL,为谷氨酸棒状杆菌高效合成紫色杆菌素奠定了实验基础,也为其它产物的高效合成提供参考。

