祛风止咳方对咳嗽敏感性增高豚鼠模型TRPV1通路的影响
薛珊珊,柏璐,孙昕宸,吴拥军
(1.南京中医药大学附属医院,江苏 南京 210029;2.南京中医药大学第一临床医学院,江苏 南京 210023)
喉源性咳嗽[1]以阵发性咽痒,咳嗽难止为主要临床表现,遇冷风、油烟刺激加重,临床上常难以明确具体病因。现代医学提出咳嗽高敏综合征(Chronic cough hypersensitivity syndrome,CHS) 的概念[2],将本病归属于难治性咳嗽范畴,目前广泛认为神经源性炎症、神经重塑是咳嗽敏感性增高的重要机制[3]。近年研究发现,气道上皮感觉神经末梢的瞬时受体电位香草酸亚型1(Transient receptor potential vanilloid 1,TRPV1) 在咳嗽反射高敏感过程中发挥了重要作用[4],TRPV1通路被激活后,白细胞介素(IL)-10等抗炎因子表达减少[5],IL-1β等促炎因子表达增加,促进释放P物质(Substance P,SP) 、神经激肽A(Neurokinin A, NKA) 、降钙素基因相关肽(Calcitonin gene-related peptide, CGRP) 等神经肽[6],形成气道神经源性炎症,进一步将兴奋传入中枢[7],促进中枢胶质细胞活化,并分泌细胞因子(IL-1β) 、神经生长因子(Nerve growth factor, NGF) 等相关因子,致咳嗽中枢敏化[8-9]。
吴拥军教授师承国医大师干祖望教授,在继承其学术思想及喉源性咳嗽辨治经验基础上,创立祛风止咳方[10-11]应用于临床,前期临床研究显示,祛风止咳方能显著减少患者刺激性咳嗽,有效改善咽痒、咽干等伴随症状,提高患者生活质量[12],且复发少,有较好的临床疗效。为进一步探讨本方治疗喉咳的作用机制,本研究通过建立咳嗽敏感性增高豚鼠模型,观察给药前后豚鼠咳嗽次数,及对TRPV1通路激活后相关细胞因子、神经肽及中枢胶质细胞活化的影响。
1 材料
1.1 动物
Hartley雄性豚鼠30只,体质量(250±20)g,3~4周龄,购自邳州市东方养殖有限公司,动物生产许可证号:SCXK(苏) 2022-0004。适应性饲养1周,12 h/12 h光照循环,自由进食用水,实验环境温度:(23±3) ℃,湿度:40%~70%,本研究经南京中医药大学动物实验伦理审查批准(伦理号:202206A009)。
1.2 药物
祛风止咳方:蜜麻黄120 g,荆芥120 g,杏仁200 g,蝉蜕60 g,蛇蜕60 g,桔梗120 g,苏子200 g,百部200 g,半夏120 g,枇杷叶200 g,款冬花200 g,金沸草200 g,乌梅200 g,甘草60 g,共计2 060 g,购自南京中医药大学附属医院,符合《中华人民共和国药典》(2020年版)要求,室温下浸泡30 min,加10倍量水煎煮1 h,纱布过滤后再次加10倍量水,煎煮40 min,合并滤液(100目滤网),浓缩至相对密度为1.20-1.25(80 ℃) 的清膏。清膏移入真空干燥箱内干燥(真空度-0.09~-0.08 Mpa,温度≤60 ℃),取干浸膏粉碎,过80目筛,得浸膏粉,每1 g提取物相当于4.68 g处方量。美敏伪麻溶液(2 mg∶0.4 mg∶6 mg),惠氏制药有限公司,100 mL/瓶。
1.3 主要试剂与仪器
卵清蛋白(OVA,Sigma,货号:A5503-1G);氢氧化铝(索莱宝,货号:A7130);环磷酰胺(麦克林,货号:C804838-25g);辣椒素(瑞芬思,货号:L-011);柠檬酸(麦克林,货号:C805019-500g);豚鼠IL-1β、IL-10、IgE ELISA试剂盒(武汉华美,货号:DY6226、DY5258、CSB-E12102Gp);TRPV1、SP、NKA、CGRP ELISA试剂盒(南京森贝伽,货号:SBJ-G099、SBJ-H1898、SBJ-G005、SBJ-G018);TRPV1小鼠单克隆抗体、NGF兔单克隆抗体、IL-1β兔单克隆抗体(Abcam,货号:ab203103、ab52987、ab234437);GFAP兔单克隆抗体(Novus,货号:NB300-141);高速低温离心机(Thermo Fisher Scientific,型号:MicroCL 17R),凝胶成像系统(上海天能,型号:5300),酶标仪(BioTek,型号:ELX800)。
2 方法
2.1 咳嗽敏感性增高豚鼠模型的建立
参考李得民等[13]的方法,采用卵蛋白致敏结合烟熏方法制备咳嗽敏感性增高豚鼠模型:实验d1豚鼠腹腔注射环磷酰胺(30 mg·kg-1),d1~d35,每天于100 cm×60 cm×60 cm的半敞开式亚克力透明箱体中点燃5支香烟,熏烟30 min,d15、d22腹腔注射增敏剂(2 mg OVA和100 mg氢氧化铝混悬液) 1 mL,空白组于相同时间点腹腔注射等体积生理盐水;d29~d35采用1% OVA雾化攻击,每日1次。造模结束24 h后,随机取3只豚鼠,颈椎脱臼法处死,取咽喉黏膜、气管黏膜、肺组织,进行HE染色病理观察及相关指标检测作为给药前对照。
2.2 分组及给药
适应性饲养结束后,30只豚鼠根据随机数字表分为空白组、模型组、激动剂组(祛风止咳方+辣椒素) 、中药组(祛风止咳方) 、对照组(美敏伪麻溶液),每组6只。各组均于实验第36 d开始给药,每日1次,连续2周;祛风止咳方组和美敏伪麻溶液组按照成人等效剂量,分别以1.99 g·kg-1(每1 g干浸膏配水5 mL)、2.7 mg·kg-1灌胃,灌胃体积10 mL·kg-1;激动剂组予TRPV1激动剂辣椒素溶液(10-4mol·L-1) 1 mL雾化吸入5 min,再行祛风止咳方灌胃(剂量同上);空白组、模型组予等体积生理盐水灌胃。
2.3 豚鼠咳嗽敏感性测定(CRS)
将各组豚鼠放入雾化箱内,用0.4 mmol·L-1柠檬酸工作液连续雾化2 min,观察5 min(豚鼠咳嗽时特征性动作:颈前伸、张口、伸出前脚等),记录干预前后豚鼠咳嗽次数。
2.4 咽喉、气管黏膜、肺组织病理情况
HE染色后,显微镜下观察各组豚鼠干预前后咽喉黏膜、气管黏膜、肺组织形态、结构变化及炎性细胞浸润情况。
2.5 血细胞分析
豚鼠股动脉取血,采用自动血细胞检测仪检测用药前后血白细胞总数(WBC) 、中性粒细胞计数(NEU) 、淋巴细胞计数(LYM) 、嗜酸性粒细胞计数(EOS) 、嗜酸性粒细胞比率(EOS%)。
2.6 ELISA实验
给药d14,以40 mg·kg-1戊巴比妥钠行豚鼠腹腔注射麻醉,股动脉采血,取5 mL血液加入EDTA-K2抗凝管充分混匀,离心10 min(3 000 r·min-1),取血浆及上清;豚鼠处死后,剪开胸腹正中皮肤、肋骨,暴露胸腔,自近端剪断气管,取咽喉黏膜、气管黏膜,用预冷的PBS(0.01 mol·L-1, pH=7.4) 冲洗组织,将剪碎的组织称质量,按1∶9比例混合对应体积的PBS加入匀浆器,充分研磨10 min(5 000 r·min-1),取上清液,严格按照ELISA试剂盒说明书进行操作,检测血清中IL-1β、IL-10、IgE的含量;咽喉黏膜、气管黏膜的TRPV1和NKA、CGRP、SP表达水平。
2.7 Western blot实验
豚鼠麻醉处死后,自枕骨大孔处分离颅骨暴露脑组织,脑干最下端即为延髓,切取延髓部分称重,加入含PMSF及磷酸酶抑制剂的裂解液(按样本质量100 mg加裂解液体积1 mL比例),研磨匀浆30 min后,离心5 min(12 000 r·min-1),转移上清液至新的EP管中。SDS-page电泳分离后,转移于0.22 μm的PVDF膜上,经5%脱脂奶粉封闭,分别用一抗孵育。4 ℃过夜后,TBS-T洗涤3次,加入辣根过氧化酶标记山羊抗兔Ig G抗体二抗,室温2 h,TBS-T洗涤3次,每次5~10 min,最后用化学发光法进行显色,PVDF膜置于天能5200凝胶成像系统内,应用Quantity One、Gel pro analyzer、Image J等软件对各蛋白条带进行定量分析。检测延髓咳嗽中枢IL-1β、TRPV1、NGF、胶质纤维酸性蛋白(GFAP;星形胶质细胞活化的标志物) 蛋白表达。
2.8 统计学方法
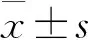
3 结果
3.1 豚鼠咳嗽敏感性检测
给药d1、d7、d14,与空白组比较,模型组豚鼠咳嗽次数显著增加(P<0.01);药物干预后,与模型组比较,祛风止咳方+辣椒素组、祛风止咳方组和美敏伪麻溶液组咳嗽次数明显减少(P<0.01),祛风止咳方组和美敏伪麻溶液组与祛风止咳方+辣椒素组相比咳嗽次数减少更明显(P<0.01),两组间咳嗽敏感性差异不明显(P>0.05)。结果见图1。
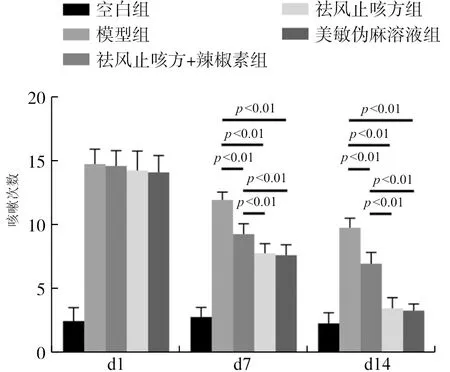
图1 各组豚鼠咳嗽敏感性比较Fig.1 Comparison of cough sensitivity ofguinea pigs in each group
3.2 豚鼠血细胞分析
与空白组比较,模型组白细胞计数、淋巴细胞计数、嗜酸性粒细胞计数稍高,余无明显差异(P>0.05);药物干预后,与模型组相比,各组豚鼠嗜酸性粒细胞百分率明显下降(P<0.05,P<0.01),祛风止咳方组与美敏伪麻溶液组相比,下降稍多,两组间差异无统计学意义(P>0.05)。结果见表1。
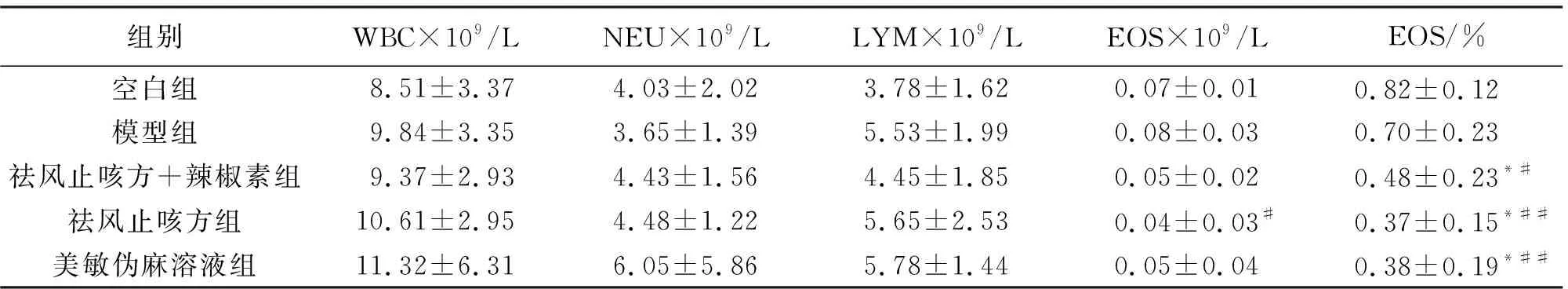
表1 各组豚鼠血细胞分析比较Table 1 Comparison of blood cell analysis of guinea pigs in each group
3.3 咽喉黏膜、气管黏膜、肺组织病理形态变化
如图2所见,与空白组相比,模型组豚鼠咽喉黏膜见角质层增厚、炎性细胞浸润、黏膜下结缔组织水肿,气管黏膜上皮纤毛排列紊乱、黏膜下炎细胞浸润,肺组织可见嗜酸性粒细胞等炎性细胞浸润。药物干预后,与模型组相比,祛风止咳方组、美敏伪麻溶液组黏膜角质层增厚明显、纤毛紊乱程度减轻,黏膜下炎细胞数量明显减少,二者炎症反应水平类似,祛风止咳方+辣椒素组炎性细胞浸润总体程度较模型组减轻,较祛风止咳方组稍重。

咽喉黏膜
3.4 豚鼠血清IL-1β、IL-10、IgE含量,咽喉、气管黏膜TRPV1、NKA、CGRP、SP水平表达
与空白组比较,模型组豚鼠血清IL-1β、IgE水平明显升高,IL-10水平明显降低 (P<0.01),咽喉、气管黏膜中TRPV1、NKA、CGRP、SP水平升高(P<0.01);药物干预后,与模型组比较,祛风止咳方+辣椒素组、祛风止咳方组、美敏伪麻溶液组血清IL-1β、IgE水平和咽喉、气管黏膜中TRPV1、NKA、CGRP、SP水平均明显降低 (P<0.05,P<0.01),祛风止咳方组和美敏伪麻溶液组IL-10水平明显升高(P<0.01),祛风止咳方+辣椒素组与祛风止咳方组、美敏伪麻溶液组相比,差异明显 (P<0.05,P<0.01)。结果见表2~4。
表2 各组豚鼠血清IL-1β、IL-10、IgE的含量Table 2 Serum IL-1β, IL-10 and IgE contents of guinea pigs in each
表3 各组豚鼠咽喉黏膜TRPV1、NKA、CGRP、SP的水平Table 3 Expression of TRPV1, NKA, CGRP and SP in throat mucosa of guinea pigs in each
表4 各组豚鼠气管黏膜TRPV1、NKA、CGRP、SP的水平Table 4 Expression of TRPV1, NKA, CGRP and SP in trachea mucosa of guinea pigs in each
3.5 豚鼠延髓咳嗽中枢IL-1β、TRPV1、GFAP、NGF蛋白表达
Western blot结果显示,豚鼠模型中,其延髓咳嗽中枢部位的IL-1β、TRPV1、GFAP、NGF蛋白表达量显著升高(P<0.01),药物干预后,与模型组相比,祛风止咳方+辣椒素组、祛风止咳方组和美敏伪麻溶液组IL-1β、TRPV1、GFAP、NGF蛋白表达量均显著降低(P<0.01),美敏伪麻溶液组TRPV1、GFAP、NGF蛋白表达量下降最明显(P<0.01),祛风止咳方+辣椒素组与祛风止咳方组相比,差异明显 (P<0.01)。结果见图3。
图3 各组豚鼠延髓咳嗽中枢相关蛋白的表达水平Fig.3 Expression of cough center related proteins in medulla bulbar of guinea pigs in each group
4 讨论
喉咳是临床常见疾病,以反复发作的刺激性痒咳为特征,吴拥军教授提出“风邪外犯,引动伏邪”为其核心病机,各种因素致表邪未清,伏于肺经不去,再因风邪引动,致肺失宣降,久咳不愈。祛风止咳方以麻黄辛散为君,外祛风邪,杏仁为臣,配伍以蝉蜕、蛇蜕等虫类药,搜剔伏于肺经顽邪,佐半夏、蜜百部、款冬花等降气止咳化痰。现代药理学研究表明,祛风止咳方中活性成分可抑制TRPV1通路的活性,调控氧化应激,减少促炎因子生成,减轻气道及肺部的炎症,达到缓解炎症反应、止咳的作用[14-16],但中药成分复杂,整体效应机制还有待深入研究。
目前研究证实,外界刺激物(如变应原、酸等) 可直接或间接作用于鼻、咽、喉、肺感觉神经C纤维末梢[17],激活TRPV1通路,致IL-1β等促炎因子释放增加[18],IL-10等抗炎因子表达减少,黏膜血管通透性及炎性成分渗出,诱导IgE合成增多,产生嗜酸性炎症,加重气道敏感性,炎症浸润进一步释放SP、NKA、CGRP等神经肽,形成气道神经源性炎症,导致咳嗽。我们以卵蛋白致敏结合烟熏刺激豚鼠造模,结果显示模型组豚鼠血清中嗜酸粒细胞计数增加,且咳嗽敏感性增高,其咳嗽次数随着造模时间延长趋于稳定,与文献描述较为一致。祛风止咳方干预后显著减少模型豚鼠咳嗽次数,降低嗜酸粒细胞计数,减轻咽喉、气道黏膜水肿及肺组织中嗜酸性粒细胞等炎细胞浸润。ELISA结果示祛风止咳方干预后,血清IL-1β、IgE,和黏膜上皮TRPV1、NKA、CGRP、SP表达被抑制,IL-10分泌被上调,与美敏伪麻溶液组比较无明显差异,与祛风止咳方+辣椒素组比较有统计学差异。辣椒素作为TRPV1激动剂,直接作用于TRPV1,增加了TRPV1蛋白通路的开放,因此降低了祛风止咳方的干预效果,提示祛风止咳方可能通过抑制TRPV1通路开放,抑制促炎因子、神经肽表达,促进抑炎因子分泌,减轻黏膜炎症浸润,降低气道上皮黏膜敏感性,抑制外周气道的神经源性炎症。
同时研究显示,TRPV1通路的表达与中枢胶质细胞的活化呈正相关[19],气道神经源性炎症将兴奋传入中枢,促进胶质细胞活化、释放IL-1β、NGF等细胞因子,使谷氨酸等兴奋性递质的表达增加,γ-氨基丁酸等抑制性递质的表达减少,进一步提高延髓咳嗽中枢对外周气道感觉神经传入的敏感性[3]。GFAP作为星形胶质细胞(AS) 胞质内的特异性酸性蛋白,被广泛用于胶质细胞活化的检测[20]。我们通过Western blot观察到,药物干预后,祛风止咳方组和美敏伪麻溶液组IL-1β、TRPV1、GFAP、NGF蛋白表达量均降低,美敏伪麻溶液组蛋白表达量下降最多,可能与其含有中枢性镇咳药氢溴酸右美沙芬有关,直接作用于延髓咳嗽中枢抑制咳嗽反射。祛风止咳方+辣椒素组蛋白表达量下降最少,疗效减弱可能与激动剂致TRPV1过度表达促进中枢胶质细胞活化分泌炎症因子有关。上述结果提示祛风止咳方可能通过抑制延髓咳嗽中枢TRPV 1通路的表达,抑制中枢胶质细胞活化,减少炎症因子IL-1β、神经营养因子NGF分泌,从而抑制突触释放兴奋性递质,降低中枢咳嗽高敏感性。
综上所述,祛风止咳方能抑制外周气道、延髓咳嗽中枢TRPV1通路的表达,降低气道神经源性炎症,抑制咳嗽中枢敏化,为明确其作用机制提供初步的实验依据。但仍存在一些不足:①本研究参照喉咳的生理病理特点进行动物造模,符合喉咳的发病机制,但未能进行多种模型之间的结果比较,模型评价标准仍须统一;②本次研究初步探讨了药物干预前后GFAP表达的变化,活化的胶质细胞释放肿瘤坏死因子-α(TNF-α) 、转化生长因子-β(TGF-β) 、脑源性神经营养因子(BDNF) 等多种细胞因子,在以后的研究中有待进一步深入探讨;③中药复方成分复杂,应进一步拆方,筛选有效成分进行研究。

