医用穿戴式脑电设备技术审评规范分析
李国勇,夏文龙,肖杰,陈欧,耿友军
1.山东省食品药品审评查验中心,山东 济南 250014;2.山东大学 护理与康复学院,山东 济南 250012
引言
脑电图通过脑电极记录脑神经细胞在大脑皮层或头皮表面的自发性、节律性电生理活动[1]。医用穿戴式脑电设备用于对患者头皮脑电信号的提取、放大、滤波、记录、分析、回放等,与传统脑电设备相比具有硬件集成度高、智能化程度高、便携性好、可长期实时检测等特点[2],可应用于精神性疾病、神经障碍、脑卒中康复等疾病的长期监测、辅助诊断,已成为国内外关注的热点。Martins等[3]、Cao等[4]、Taufique等[5]利用可穿戴脑电设备对偏头痛发作前后的生理变化进行研究,实现了对患者病情的预测和早期干预。Ryu等[6]、Sopic等[7]利用脑电进行癫痫疾病的监测研究;Rohani等[8]利用头戴式脑电进行抑郁症的研究;Bhagat等[9]、Kong等[10]利用穿戴脑电设备进行偏瘫和脑卒中患者的康复训练。
经查询国内外药品监管机构官方网站,发现近几年来,美国已陆续批准了多款医用穿戴式脑电产品上市,用于睡眠监测、脑卒中患者康复训练、癫痫监测等领域,国内获批的同类产品还非常少。总体来看,目前该类产品仍主要集中于科学研究领域,获得医疗器械注册证并进行临床应用的产品较少。主要原因为该类产品目前尚没有相应的国家标准、医药行业标准,国内外也没有相应的审评规范,致使该产品注册上市、质量控制均存在一定难度。尤其是该产品技术创新性强、迭代升级快,在应用转化过程中,研究者对监管法规了解不深,缺乏必要指导,造成对产品的验证、确认不充分,致使注册周期长、难度大。本文从技术审评角度出发,围绕审评工作的主要评价指标,如产品结构组成、主要风险、性能要求、临床评价等,开展详细阐述及分析,以期为该类产品的设计开发、生产、注册、使用、上市后监管提供依据。
1 产品情况概述
1.1 工作原理
医用穿戴式脑电设备主要利用穿戴式电极采集患者皮肤表面的脑电信号,经过滤、放大、数模转化后,通过无线等方式传送至移动终端,然后再经移动终端传送到云端或服务器端,利用软件算法实现对信号的分析处理,并将分析结果反馈给患者或医疗机构。该产品可实现对脑电信号的实时提取、长期监测和在线分析。产品也可以由上述功能模块的部分单元组成,原理图如图1所示。
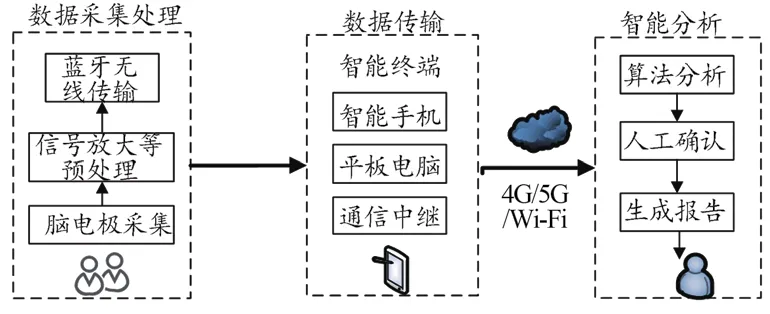
图1 产品原理图
该类产品根据《医疗器械分类目录》[11],其分类编码为07-03-06,适用范围为对患者精神性疾病和脑部实质性病变的分析诊断、脑功能状态评估等。该产品虽然与传统的脑电图机在同一个目录下,但产品的工作原理、结构组成、性能指标、临床评价等方面都存在较大差异,详细阐述如下。
1.2 结构组成
该产品通常由脑电电极、脑电导线、脑电放大模块、无线通信模块、软件等组成,或将其中的几个模块集成为1个模块,申报中应依据产品的实际情况予以说明,具体如下:
(1)脑电电极:实现皮肤表面脑电信号的实时采集。应明确电极的类型、材质、通道数量、穿戴方式,如干电极还是湿电极,单通道还是多通道,佩戴于头部、耳朵还是其他位置。脑电电极也可单独注册,其分类编码为07-10-03,管理类别为Ⅱ类。
(2)电极线:主要用于电极与放大模块的连接。明确电极线的材质、形式,如夹式、盘式、帽式等。电极线也可单独注册,分类编码为07-10,管理类别为I类。
(3)脑电放大模块:实现脑电信号的滤波、放大、数模转化等功能。应明确是否与电极、电极线为一体式设计。
(4)无线通信模块:实现脑电监测数据的传输,应明确无线通信方式,如蓝牙、Wi-Fi、4G/5G、ZigBee等。说明通信的具体路由,通过移动终端转发,还是直接与远端通信。
(5)软件:实现信号的预处理、特征提取、分类识别等功能。应明确产品包含的软件类型及发布版本号,如嵌入式软件、移动端软件、服务器端或云端软件等。独立软件常单独注册,按照其预期用途、算法成熟度等因素[12],其分类编码可为21-03-02,管理类别为Ⅱ类或分类编码为21-04-02,管理类别为Ⅲ类或Ⅱ类。
2 技术审查要点
2.1 主要风险
产品风险管理可参照YY/T 0316-2016《医疗器械风险管理对医疗器械的应用》[13]的要求,并结合申报产品的具体特征,对风险进行详细识别、分析、控制及监测。一般常见的风险审评要点如表1所示。

表1 常见的风险审评要点
2.2 主要性能研究
2.2.1 主要性能确定依据
(1)产品适用标准研究。目前该类产品尚没有相关的国家标准、医药行业标准,只有医用电气设备的基本安全标准,产品应当符合适用的电气安全强制性标准。JJF 1388-2013《数字脑电图机及脑电地形图仪型式评价大纲》[14]、JJG 954-2019《数字脑电图仪检定规程》[15]与该产品具有相关性,但为计量行业标准,主要用于产品上市后使用中的检定、校准,但JJG 954-2019不适用于动态脑电记录仪。确定产品性能指标时可参考上述标准的适用条款。
(2)脑电信号的采集处理研究。脑电信号具有信号形态多、幅度小、噪声强、随机性强、非线性等特点[13],因此信号的采集、去噪、特征提取、特征分类与产品性能密切相关,应有相应的验证、确认。
脑电信号频率为 0.5~100 Hz,幅度大多为 5~200 μV[1],很容易受到其他信号的干扰,如人体运动、环境噪声、工频干扰、面部肌肉动作、心电、肌电等。产品必须具有抗干扰设计,信号处理分析前,必须进行预处理,降低噪声、去除伪差。应明确产品抗干扰设计的具体参数,如输入阻抗、共模抑制比、带通滤波器的截止频率、幅频特性、耐极化电压等,是否有陷波滤波消除工频的干扰[16]等。脑电信号的频率低至0.5 Hz以下,应说明时间常数的确定原则,既要有足够的低频特性,又要兼顾电容等元器件的选取。明确测量准确性的参数,如准确度、信号灵敏度。产品采样频率越高,频谱越丰富,可提取的特征量就越多,但数据处理、数据传输的负荷则越重,处理时间也越长,应根据产品的设计,合理确定产品适用的采用频率及设定依据。
(3)脑电电极研究。电极相当于产品的信号源,电极的特性与测量的准确性密切相关。脑电电极与心电电极具有一定相似性,性能指标可参照YY/T 0196-2005《一次性使用心电电极》[17]制定,如电极的阻抗、极化特性、稳定性、微生物要求等指标。因为该产品需要长期佩戴,稳定性指标除要明确1 min后的直流失调、5 min后的复合失调不稳定性外,还需要制定至少8 h内的偏置电流耐受度指标。还应明确电极的材质,如Ag/AgCl、镀金、镀银、合金等,说明电极的类型,如圆盘电极、帽式电极、干电极、织物电极。说明电极的通道数、导联方式。说明采用电极的优缺点、使用原因,如Ag/AgCl干电极具有成本低、佩戴舒适、检测方便、耐极性化高等优势,但是易受毛发的干扰[18],故常与高输入阻抗放大器配合使用。若湿电极与导电膏等配合使用,应在说明书中详细说明操作过程,明确导电膏类型,注意皮肤过敏等。明确电极的放置方式,10-20标准方式还是自定义方式,明确各电极之间的放置位置、参考电极等,若采用自定义方式应提供相应的理论依据。应说明导线的材质、阻抗,如铜线、银铂丝等,导线是否与电极预连接等。
(4)无线通信研究。应明确无线通信的具体类型、无线通信的路由,分析无线通信对功耗的影响、对脑电信号的影响。
(5)生物相容性研究。因产品的电极等部件与人体接触,应明确产品与人接触部分的部件名称、部件材料名称、接触部位和接触时间,按照GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》[19]进行评价。该产品一般为与完好皮肤短期接触,因此至少需要提供与人体接触部件的细胞毒性、致敏反应的验证资料。
(6)消毒灭菌工艺研究。确定产品适用的消毒灭菌方法、参数及验证资料,如环氧乙烷灭菌、湿热灭菌等。明确电极的提供方式,一次性使用还是重复使用,无菌使用还是微生物控制后使用。若电极可重复使用,应研究消毒灭菌对电极的影响,与电极材质的适用性,确定可允许的使用次数。
2.2.2 产品技术要求
产品的主要性能应包含信号采集处理性能、电极性能、安全要求、软件功能等,产品技术要求中制定的性能指标应与2.2.1研究资料相一致。其中软件功能在2.3中描述。
(1)信号的采集处理性能:主要考虑抗干扰与去噪性能、测量结果的准确性。抗干扰性能与去噪包括输入阻抗、共模干扰的抑制、耐极化电压、噪声电平、幅频特性、高低频的滤波性能、时间常数等;测量结果的准确性包括标准信号的准确度、信号灵敏度等。
(2)电极性能:若产品采用自制电极或购买无医疗器械注册证的产品,还应对电极制定相应评价指标,如交流阻抗、直流失调电压、复合失调不稳定性和内部噪声、偏置电流耐受度、微生物限度/无菌、环氧乙烷残留等指标。建议技术要求附录中明确电极和导线的材质、脑电极的放置方式等。
(3)安全要求:产品应符合强制性国家标准和行业标准的要求。如电气安全应符合GB 9706.1-2020《医用电气设备第1部分:基本安全和基本性能的通用要求》[20],电磁兼容应符合YY 9706.102-2021(YY0505-2012)《医用电气设备第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容 要求和试验》[21]。穿戴式产品一般为内置电源,电磁兼容一般只检验辐射发射、静电放电、射频辐射抗扰、工频磁场项目。若产品仅为脑电电极不带电极线,电磁兼容可以豁免。若具有报警功能,还应符合YY 9706.108-2021《医用电气设备第1-8部分:基本安全和基本性能的通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南》[22]的要求。若产品可用于家用,还应符合YY 9706.111-2021《医用电气设备 第1-11部分:基本安全和基本性能的通用要求 并列标准:在家庭护理环境中使用的医用电气设备和医用电气系统的要求》[23]的要求。另外,因该产品与传统的脑电图机有明显差异,所以GB 9706.226-2021《医用电气设备 第2-26部分:脑电图机的基本安全和基本性能专用要求》[24]适用范围中明确“动态脑电图记录器”等产品不适用,故该产品不采纳此标准。
2.3 软件研究
2.3.1 产品软件和网络安全研究
该产品可包含多个软件,如嵌入式软件、移动终端软件、服务器端软件等。嵌入式软件运行在脑电设备中,为设备的必要组成部分,实现脑电数据的采集、初处理等功能;移动终端软件和服务器端软件实现脑电信息的处理、分析、显示、传输,应明确产品包含的软件类型。
(1)软件的管理类别:可参照《人工智能医用软件产品分类界定指导原则》[12]并结合软件的预期用途、算法成熟度等因素进行综合判定。若软件功能可实现对病变的自动识别等辅助决策且算法在医疗应用中成熟度低,一般按照第三类医疗器械管理;若软件功能仅为数据的分析处理、传输等非辅助决策,一般按照第Ⅱ类医疗器械管理;若软件模块为Ⅲ类,则整个产品也按Ⅲ类申报。
(2)软件的风险程度:医疗器械软件的风险程度采用软件的安全性级别进行描述,可根据产品的预期用途、核心功能等进行综合判断。该软件实现信号的预处理、特征提取、分类识别等功能,其核心功能、核心算法具有一定复杂性,不是简单的操作类、流程类功能,处理结果可能会对患者间接产生轻微伤害,一般建议不低于中等级别。
(3)软件的通用功能研究:产品的所有软件都应参照《医疗器械软件注册技术审查指导原则》[25]、《医疗器械网络安全注册技术审查指导原则》[26]、《人工智能医疗器械注册审查指导原则》[27]的要求提交软件研究报告、网络安全研究报告等资料,研究资料中需包含需求分析、测试计划、测试报告、追溯性分析报告、核心功能等。若使用了人工智能,应提供算法研究报告等;若具有网络控制功能,应提供数据完整性和可得性的测试报告;若使用云计算服务,应根据云计算类型提交相应研究资料,并在运行环境中明确云计算的名称、服务模式、部署模式、配置以及云服务商的名称、住所、服务资质。还应参照GB/T 25000.51-2016《系统与软件工程系统与软件质量要求和评价(SQuaRE)第51部分:就绪可用软件产品(RUSP)的质量要求和测试细则》[28]提供软件质量的测试报告。
(4)软件分析性能研究:脑电信号与心电、肌电、眨眼等人体生理信号的频谱非常接近,且具有很强的随机性、非线性特性,使信号的特征提取、分类识别具有很大挑战性,也是目前该领域的重要研究热点。特征提取可能会包含时域特征、频域特征、幅值特征等,应明确各过程采用的算法,如自回归、独立变量分析、快速傅里叶变换、小波变换、功率频谱分析等。明确能识别的特征类别,详细说明识别的依据和采用的算法[29-30],如K最近邻算法、基于决策树、支持向量机、卷积神经网络等,提供识别的敏感度、特异性、准确性等性能的验证资料。若具有自动分析功能,应详细说明软件的具体功能和验证方法,明确软件分析结果是否需要人工复核,并在说明书中进行说明。
2.3.2 产品技术要求的软件性能
软件主要性能指标:软件的全部核心功能、性能效率、接口、访问控制、运行环境等。软件核心功能包括波形或数值的显示、存储、回放、功率谱幅度、功率谱密度及分析功能等,应与产品的适用范围相匹配。性能效率包括响应时间、并发量、资源利用率等。临床评价中应对产品的主要性能和适用范围进行确认。
技术要求附录中建议提供软件的体系结构图、用户界面关系图与主界面图示、物理拓扑图。体系结构图描述软件的主要软件模块功能、必备软件、云计算等。
2.4 产品稳定性研究
产品使用期限研究可参照《有源医疗器械使用期限注册技术审查指导原则》[31]进行,研究方法可采用加速老化试验、实时老化试验、同类产品的经验数据、可靠性评估分析、理论仿真等方式。实时老化为产品使用期限研究提供了最佳数据,但评价周期太长。为确保加速老化研究能代表产品真实老化情况,建议实时老化研究与加速老化研究同步进行。若产品采用锂电池等内部电源供电,应对电池进行评价,评价报告中建议关注电池的工作条件、标称电压、电压波动范围、充放电次数、电池维护等。软件的使用期限即为软件的全生命周期,可通过商业因素进行确定。
应提供产品环境试验验证资料,参照GB/T 14710-2009《医用电器环境要求及试验方法》[32]气候环境试验Ⅱ组、机械环境试验Ⅱ组的要求,验证产品在高温、低温、湿热、振动、碰撞等条件下的性能。应提供产品运输稳定性和包装研究资料,以证明在规定的运输包装条件下,保证产品的包装和稳定性能满足要求。
2.5 临床评价研究
脑电图机、脑电地形图仪、数据处理软件产品已经列入《免于临床评价医疗器械目录》[33]中,若产品不含自动分析功能,且与目录中描述相一致,可以按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》[34]要求,提供对比资料,证明与目录中产品具有等同性,可豁免临床评价。
若产品为无线穿戴式且电极采集信号的位置未采用国际10-20系统电极位置或具有自动分析功能,产品明显与豁免目录产品不同,则需通过同品种医疗器械比对路径或临床试验路径进行评价。
若通过同品种比对的方式进行临床评价,应按照《医疗器械临床评价技术指导原则等5项技术指导原则》[34]中《医疗器械临床评价技术指导原则》《医疗器械临床评价等同性论证技术指导原则》论证申报产品与对比产品在适用范围(适应证、适用人群、适用疾病阶段等)、技术特征(工作原理、产品性能、软件特性、核心算法等)、生物学特性方面具有广泛相似性,并收集同品种产品的临床文献数据、临床经验数据、临床试验数据等临床数据,经分析评价,形成临床评价报告。
若采取临床试验路径进行临床评价,应根据产品风险、适用范围、自动分析功能等合理确定试验类型、入组标准、主要评价指标、样本量等,并提交伦理批件、临床试验方案、临床试验报告等,临床试验应符合《医疗器械临床试验质量管理规范》[35]的要求。若产品可用于家用,还应充分考虑用户的认知、操作能力。
3 审评关注点
该产品与传统的脑电图机具有很大不同,建议在审评中重点关注以下方面:① 产品结构组成是否明确,应明确产品所有主要组件,明确所含软件的类型,是否含分析软件、云计算等;② 产品的适用范围是否与软件的主要功能相一致,是否在临床评价资料中进行了确认;③ 产品技术要求是否执行了强制标准,软件临床功能、网络安全要求是否制定了相应要求;④ 产品软件是否具有自动分析功能,是否用于辅助决策,核心算法在医疗应用中是否为成熟算法,并根据以上信息确认产品管理类别和临床评价路径是否合理;⑤ 产品临床试验样本选取、主要评价指标是否合理,试验结论是否明确,是否能够确认产品的适用范围;⑥ 产品的主要风险是否已经充分识别并经过了验证;⑦ 产品若用于家用,应充分考虑非医疗环境、非专业人士使用的风险,应对非专业人士认知能力、操作能力进行确认。
4 结论
本文构建了一套适用于医用穿戴式脑电设备技术审评的评价规范,基于安全、有效的基本要求,对产品的结构组成、主要风险、性能指标、临床评价等方面的注册要求进行了详细阐述,以期提高产品质量、满足临床需求,实现产品尽快上市。但目前脑科学、人工智能技术发展迅速,软件的自动分析能力也在不断提高。下一步将对软件自动分析功能的临床评价,提供更详细的建议;对数据标注、数据质控、系统的准确度和灵敏度等要求进行更深入的研究,使规范更具有指导性;同时人工智能算法的训练往往需要大样本的数据库,下一步将对数据库样本数量、分布及用户隐私保护等进行更详细的分析研究。

