重症肺炎患者治疗期间血清sICAM-1、IL-8动态监测对病情进展的影响*
王建伟, 张庆龙, 王楠楠, 王新存, 常银江
濮阳市人民医院重症医学科(河南濮阳 457000)
肺炎是一个全球性持续普遍存在的公共健康问题,对人类健康造成极大威胁。据统计,肺炎患者中有7%~13%为重症肺炎,疾病起病急,病情重,除了会对患者呼吸系统产生损伤外,还会累及肝、肾、消化道等全身多个器官,引发呼吸衰竭、心力衰竭等多种严重并发症,增加患者病死风险[1]。虽然现代医疗技术已得到明显进步,且不断有新型的抗菌药物被应用于临床治疗,但重症肺炎患者的病死率仍居高不下。因此,积极寻找灵敏、快捷、实用的监测指标,动态监测患者治疗期间病情变化情况,对于临床及时调整并完善治疗措施控制病情进展,挽救患者生命具有重要意义。血清可溶性细胞间黏附分子-1(soluble intercellular adhesion molecule-1,sICAM-1)是细胞间黏附分子-1的一种循环形式,由sICAM-1膜外段脱落而成,在胚胎发育与分化、正常组织结构的维持、炎症与免疫应答等多种生理病理过程中均有重要作用[2]。白细胞介素-8(interleukin-8,IL-8)又称中性粒细胞因子,是炎症性疾病的重要介质,可参与机体抗感染、免疫反应调节等过程[3]。近年来,较多研究指出,肺炎患者在发病及治疗期间,其血清sICAM-1、IL-8水平会发生不同程度的变化,可能与病情进展、预后等密切相关[4-5]。但既往的研究仅针对重症肺炎患者某个时点血清sICAM-1、IL-8水平进行分析,而有关患者治疗期间血清sICAM-1、IL-8水平动态变化对病情进展影响的相关研究较少。基于此,本研究主要分析重症肺炎患者治疗期间血清sICAM-1、IL-8动态监测对病情进展的影响,以期为今后指导重症肺炎患者治疗方案的制定与调整提供参考。
1 资料与方法
1.1 一般资料 采用前瞻性队列研究方法,选取2020年1月至2022年4月濮阳市人民医院收治的重症肺炎患者116例作为研究对象。
纳入标准:(1)符合重症肺炎的相关诊断标准[6];(2)均入住重症监护室(intensive care unit,ICU),并接受规范化治疗;(3)患者家属均知晓本研究具体内容,并自愿签订知情同意书。
排除标准:(1)治疗期间病死者;(2)患病前存在严重心、肝、肾等重要脏器功能障碍者;(3)存在其他严重炎症性、感染性疾病者;(4)合并恶性肿瘤者。
研究获得医院医学伦理委员会审核批准(IEC-2021-EA-010)。
1.2 治疗方法 参照《成人社区获得性肺炎基层诊疗指南(2018年)》[6]中相关内容进行规范化治疗,及时清除患者鼻腔分泌物,保持呼吸道通畅,经鼻导管或吸氧面罩给氧,维持血氧饱和度94%~98%;根据患者血常规及痰液培养结果选择不同的β-内酰胺类联合大环内酯类强力广谱抗菌药物或抗病毒药物治疗;存在呼吸衰竭者进行机械通气;存在发热或疼痛症状者进行物理降温,静脉补充因发热而丢失的水和电解质,必要时应用布洛芬或对乙酰氨基酚解热镇痛,痰量过多者,加强痰液引流,同时加用祛痰药物;无法进食者,可给予鼻饲胃肠营养乳剂进行营养支持。
1.3 病情进展评估方法 观察患者入住ICU接受治疗5 d内病情进展情况,本研究中将患者于ICU接受治疗期间出现急性呼吸衰竭(出现全身或口唇绀紫)、肺脓肿、心力衰竭、肝肾功能损伤(出现少尿、无尿、浮肿等症状)、凝血功能障碍(出现血小板减少、白细胞减少、皮下淤血、瘀斑或消化道出血等症状)中的1个或多个多脏器功能障碍定义为病情进展,将此类患者纳入加重组,反之则纳入稳定组。
1.4 血清sICAM-1、IL-8及其他实验室指标检测方法 患者入住ICU接受治疗第1、3、5天时,采集外周肘静脉血各6 mL分装2管,其中1管以3 000 r/min速率离心10 min,离心半径10 cm,取血清备用,采用山东麦田生物技术有限公司生产的试剂盒检测sICAM-1水平,检测方法为胶体金法,采用山东中鸿特检生物科技有限公司生产的试剂盒检测IL-8水平,检测方法为磁微粒化学发光法,采用上海川至生物技术有限公司生产的试剂盒检测C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)水平,检测方法为胶体金法。取另1管静脉血,采用血细胞分析仪(北京倍肯恒业科技发展股份有限公司,BK-300A型)检测白细胞计数、中性粒细胞计数值。
1.5 资料采集 统计患者年龄、性别、吸烟史、饮酒史、高血压史、冠心病史、糖尿病史等资料。

2 结果
2.1 重症肺炎患者治疗期间病情进展情况 治疗5 d内,116例患者中36例出现疾病进展,占31.03%(36/116)。
2.2 两组患者一般资料比较 加重组治疗第1天白细胞计数、中性粒细胞计数、CRP、PCT水平均高于稳定组,差异有统计学意义(P<0.05);两组其他资料对比,差异无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较
2.3 两组不同时点血清sICAM-1、IL-8水平比较 与治疗第1天比较,加重组治疗第3、5天血清sICAM-1、IL-8水平均升高,稳定组治疗第3、5天血清sICAM-1、IL-8水平均降低,差异有统计学意义(P<0.05);与治疗第3天比较,加重组治疗第5天血清sICAM-1、IL-8水平均升高,稳定组治疗第5天血清sICAM-1、IL-8水平均降低,差异有统计学意义(P<0.05);且加重组不同时点血清sICAM-1、IL-8水平均较稳定组高,差异有统计学意义(P<0.05)。见表2。
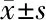
表2 两组不同时点血清sICAM-1、IL-8水平比较
2.4 两组血清sICAM-1水平的广义方程分析 偏回归系数参数解释:加重组,=7.540,P<0.001,表明两组治疗第1天血清sICAM-1水平对比,差异有统计学意义(P<0.05);治疗第5、3天时,=-72.270、-27.280,P均<0.001,表明治疗第5、3天时,稳定组血清sICAM-1水平较治疗第1天分别降低72.270 μg/L、27.280 μg/L;加重组治疗第5、3天时,=95.270、41.540,均P<0.001,表明加重组治疗第5、3天时与治疗第1天血清sICAM-1水平的差值较稳定组分别升高95.270 μg/L、41.540 μg/L,即治疗第5、3天时加重组血清sICAM-1水平较治疗第1天分别升高23.000 μg/L、14.260 μg/L。见表3。
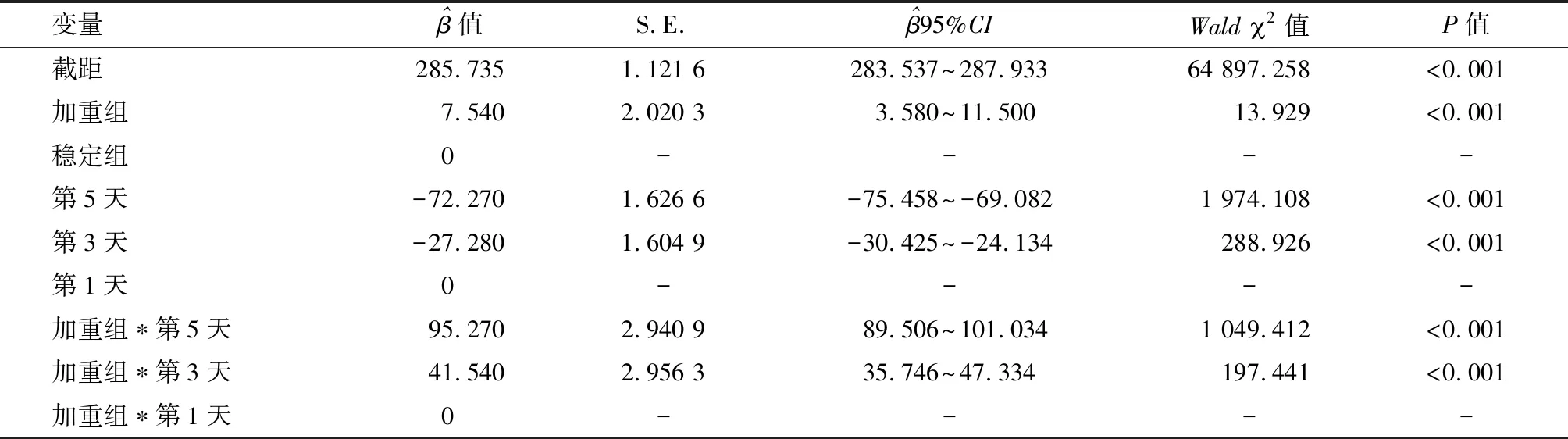
表3 两组血清sICAM-1的广义估计方程分析
2.5 两组血清IL-8水平的广义方程分析 偏回归系数参数解释:加重组,=0.077,P<0.001,表明两组治疗第1天血清IL-8水平对比,差异有统计学意义(P<0.05);治疗第5、3天时,=-0.156、-0.036,P均<0.05,表明治疗第5、3天时,稳定组血清IL-8水平较治疗第1天分别降低0.156 ng/mL、0.036 ng/mL;加重组*治疗第5、3天时,=0.326、0.139,均P<0.001,表明加重组治疗第5、3天时与治疗第1天血清sICAM-1水平的差值较稳定组分别升高0.326 ng/mL、0.139 ng/mL,即治疗第5、3天时加重组血清sICAM-1水平较治疗第1天分别升高0.170 ng/mL、0.103 ng/mL。见表4。
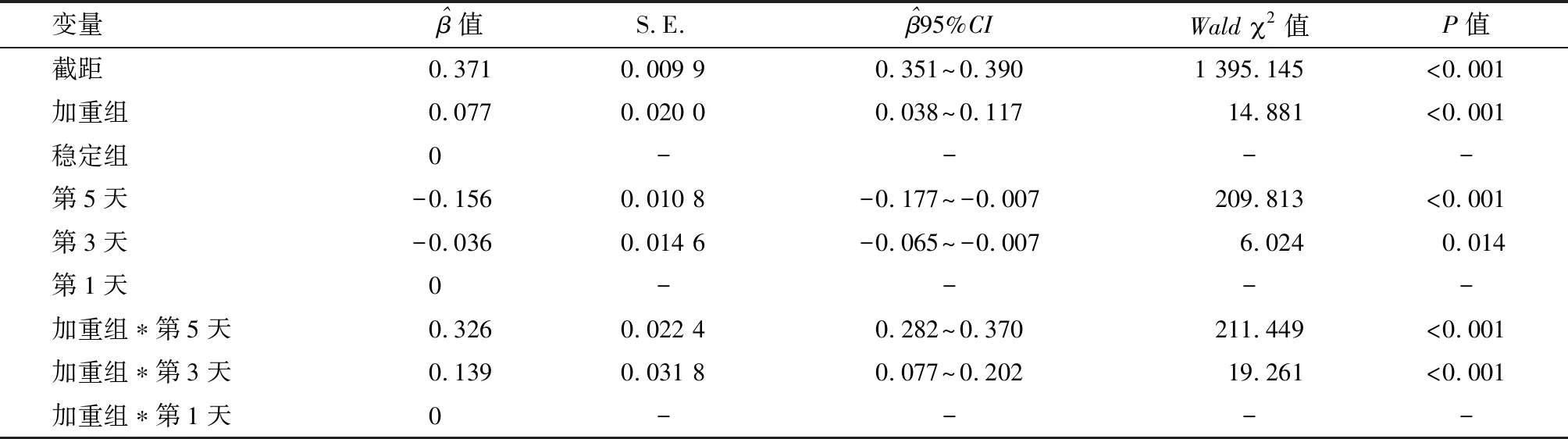
表4 两组血清IL-8的广义估计方程分析
2.6 血清sICAM-1、IL-8对重症肺炎患者治疗期间病情进展的预测价值 以重症肺炎患者治疗期间病情进展情况作为检验变量,进展赋值为“1”,未进展赋值为“0”,以患者入住ICU第1天的血清sICAM-1、IL-8水平为检验变量,绘制ROC曲线(图1)显示,血清sICAM-1、IL-8预测重症肺炎患者治疗期间病情进展的AUC分别为0.705、0.701、0.766,均有一定预测价值,联合检测价值更高,且当血清sICAM-1取288.235 μg/L、血清IL-8取0.385 ng/mL时,可获得最佳预测价值。见表5。
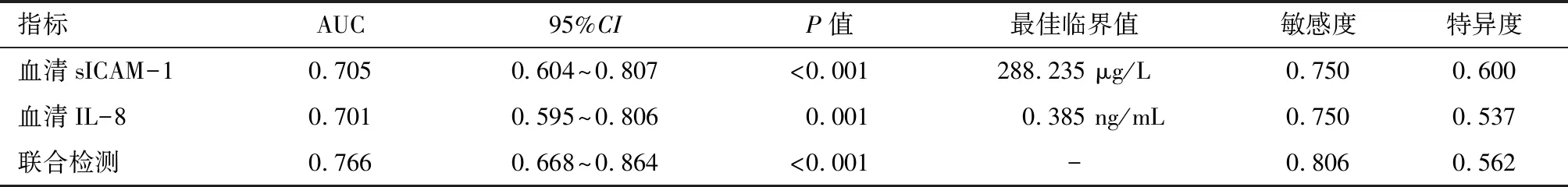
表5 血清sICAM-1、IL-8对重症肺炎患者治疗期间病情进展的预测价值
3 讨论
重症肺炎可由病原微生物、理化因素、免疫损伤、过敏及药物所致,临床往往根据患病原因采取针对性治疗,对于细菌感染引起的疾病主要采用抗菌药物治疗,对于病毒感染引起的疾病主要采用抗病毒药物治疗[7]。但由于近年来抗菌药物的滥用,很多病原微生物均产生了耐药现象,导致初始治疗措施无法达到预期效果,引起疾病进展,影响患者预后[8]。本研究116例患者治疗5 d内36例出现疾病进展,占31.03%。可见,及时了解并掌握重症肺炎患者治疗过程中病情进展情况,并及时调整治疗措施对于有效控制疾病进展,改善患者预后具有重要意义。

图1 血清sICAM-1、IL-8预测重症肺炎患者治疗期间病情进展价值的ROC曲线
相关研究指出,重症肺炎作为一种感染性疾病,病原菌进入机体后可激发强烈的免疫应答反应,产生大量炎症介质,加剧病情进展,通过监测机体特异性炎症指标的变化可能为患者病情评估提供一定参考[9]。白细胞计数、中性粒细胞计数、CRP及PCT均为重症肺炎患者常规检查指标,且临床多采用上述指标来反映患者病情严重程度。本研究结果显示,加重组治疗第1天白细胞计数、中性粒细胞计数、CRP、PCT水平均高于稳定组,表明上述指标可在一定程度上反映重症肺炎患者病情严重程度。但上述指标在细菌感染引起的重症肺炎患者体内存在明显升高,而在某些病毒感染引起的重症肺炎患者体内无明显变化,应用存在一定局限性。因此,还需寻找其他准确、灵敏的可反映全部重症肺炎患者病情进展情况的指标。
sICAM-1是炎性反应的始动因子,可通过诱导炎性因子生成的方式扩大机体炎症级联反应[10]。陈少全等[11]研究指出,重症肺炎患儿血清sICAM-1水平较普通肺炎患儿高,且高、中危重症肺炎患儿血清sICAM-1水平均显著高于低危重症肺炎患儿。由此可见,血清sICAM-1水平与重症肺炎患者病情严重程度有关,可作为监测患者病情的重要指标。但上述研究未对患儿治疗期间血清sICAM-1水平进行动态监测,无法体现血清sICAM-1水平随患儿病情动态变化情况。本研究通过广义方程分析重症肺炎患者治疗第1、3、5天血清sICAM-1水平变化情况,结果显示,治疗第1、3、5天,加重组血清sICAM-1水平呈上升趋势,稳定组血清sICAM-1水平呈下降趋势,且加重组不同时点血清sICAM-1水平较稳定组高,提示重症肺炎患者治疗期间血清sICAM-1水平随病情变化而变化。分析原因在于,sICAM-1是细胞表面跨膜糖蛋白抗原,主要存在于血管内皮细胞表面,在细菌性重症肺炎患者中,其可通过中性粒细胞的炎症应答过程从细胞表面脱落溶解在血液中,并游走到气管、支气管及其他部位,诱导下游炎症因子的表达,引起全身炎症反应,促进白三烯、组胺、IL-1、6等炎性介质及细胞因子对肺泡及其他器官上皮组织的浸润与损伤,导致多脏器损伤,从而引发一系列并发症,加剧病情进展[12]。在病毒性重症肺炎患者中,上皮细胞能通过自身高表达的sICAM-1促进其与嗜酸性粒细胞及中性粒细胞黏附于气道及其他部位,诱导炎症反应损伤气道及其他器官,加重疾病进展。此外,sICAM-1进入血液中还能影响细胞膜上离子通道开放,加剧组织细胞缺血与炎症性损伤程度,从而引发急性呼吸衰竭、肺脓肿、心力衰竭等多种并发症,促进疾病进展[13]。
IL-8作为对嗜中性粒细胞趋化活性最强的细胞因子,在炎症反应及变态反应中具有重要的调节作用[14]。相关文献指出,IL-8的动态变化于重症新冠肺炎患者的致命结局相关,可作为预测患者治疗选择的生物标志物[15]。本研究结果显示,治疗第1、3、5天,加重组血清IL-8水平呈上升趋势,稳定组血清IL-8水平呈下降趋势,且加重组不同时点血清IL-8水平较稳定组高,提示重症肺炎患者治疗期间血清IL-8水平随病情变化而变化。而患者病情又是影响其致病结局的重要因素。由此可见,重症肺炎患者血清IL-8水平对病情进展具有重要影响。分析原因在于,重症肺炎患者肺部感染后,由于细菌、病毒等的刺激,会导致肺泡上皮、肺巨噬细胞合成与分泌较多的IL-8,导致IL-8水平异常升高[16]。而IL-8水平异常升高可激活嗜中性粒细胞,并使其迅速聚集至肺间质或肺泡腔内的感染病灶,并在IL-8的诱导下快速脱颗粒,释放弹力蛋白酶、髓过氧化物酶等蛋白水解酶反应性的氧代谢产物、颗粒酶B、穿孔素等其他介质,损伤肺组织,加速疾病进展[17]。另外,在血清IL-8的作用下,重症肺炎患者肺部毛细血管会广泛的浸润与扩张,增加毛细血管通透性,导致局部炎症反应向机体其他部位扩散,引起全身炎症反应及多器官损伤,从而造成诸多严重并发症的发生[18]。而机体全身炎症反应又会进一步刺激IL-8的产生,从而形成恶性循环,导致病情进展,增加不良预后发风险。
另外,本研究采用治疗第1天的血清sICAM-1、IL-8水平对重症肺炎患者病情进展情况进行早期预测,结果显示,血清sICAM-1、IL-8预测重症肺炎患者治疗期间病情进展的AUC分别为0.705、0.701、0.766,均有一定预测价值,联合检测价值更高,且当血清sICAM-1取288.235 μg/L、血清IL-8取0.385 ng/mL时,可获得最佳预测价值。由此可见,临床可通过动态监测重症肺炎患者治疗期间血清sICAM-1、IL-8水平变化情况对其病情进展进行早期预测,并指导治疗方案的调整与完善,从而使患者得到最大获益,促进疾病转归。
综上所述,重症肺炎患者治疗期间血清sICAM-1、IL-8水平随病情变化而变化,可作为预测患者病情进展的指标,指导治疗方案的调整。但本研究也存在一定局限,如未对患者治疗方案调整后血清sICAM-1、IL-8水平变化情况进行进一步观察,且未分析血清sICAM-1、IL-8水平与患者预后的关系,今后还需进行进一步深入探讨。
利益相关声明:本文所有作者不存在利益冲突。
作者贡献说明:王建伟:构建思路,论文写作,审核论文;张庆龙、王楠楠:数据收集,整理资料;王新存:统计学分析,整理论文数据:常银江:审核论文,修改论文。

