营养风险筛查工具识别胃癌患者肌减少症的临床价值
孙 慧, 徐 慧, 陆滢滢, 王陈晨
(1. 南通大学附属海安医院 肿瘤科, 江苏 海安, 226600; 2. 南通大学附属医院 肿瘤科, 江苏 南通, 226000)
胃癌具有高发病率和高病死率等特点,多数患者确诊时已处于晚期,极大影响了胃癌的治疗效果[1-3]。因食欲减退、肿瘤进展、抗癌治疗以及宿主对肿瘤的反应等多因素的综合影响,营养不良在胃癌患者中尤为常见[4-5]。肌减少症是一种以骨骼肌肉成分改变、肌肉质量与肌肉功能逐渐丧失为特征的综合征,研究[6-8]发现肌减少症与胃癌患者术后并发症、低生活质量、不良预后等多种不良结局相关。此外,肌减少症还增加了辅助化疗的毒性,降低了患者对药物的敏感性[9-10]。近年来,营养风险筛查和评估工具在癌症患者中得到了更加广泛的应用。欧洲临床营养与代谢学会[11]建议对所有手术治疗的胃癌患者进行营养筛查。患者主观整体营养状况评价量表(PG-SGA)和营养风险筛查2002(NRS 2002)量表是目前最常用的营养状况评价工具,且已被研究[12-15]证实在肿瘤患者营养评估与预后预测中具有有效性。本研究应用PG-SGA和 NRS 2002量表调查接受手术治疗的胃癌群体中术前营养不良发生率,并分析量表与肌减少症的关系,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2021年12月入住肿瘤科并接受手术治疗的胃癌患者的临床资料。纳入标准: ① 所有患者计划接受胃癌根治性手术; ② 术前腹腔、盆腔CT影像学资料及实验室检查资料完整; ③ 术前、术中证实无远处脏器转移或腹膜播散; ④ 术前1周内完成营养风险筛查与评估。排除标准: ① 残胃癌或胃癌复发者; ② 术前接受新辅助化疗、放疗者; ③ 有其他系统恶性肿瘤史或慢性肾功能不全等消耗性疾病者。本研究共纳入136例胃癌患者。本研究经医院医学伦理委员会批准,所有程序符合《赫尔辛基宣言》的相关要求。所有参与者均已签署知情同意书,授权其临床信息与影像学资料匿名用于医学研究。
1.2 肌减少症的定义与营养评估
回顾所有患者的术前CT扫描图像,通过连续层面分析骨骼肌质量,以评估全身肌减少症。使用MATLAB软件,根据Hounsfield(HU)值范围(-29~150 HU)确定第3腰椎(L3)水平周围的肌肉轮廓,包括腰大肌、腰方肌、竖脊肌、腹横肌、腹内斜肌、腹外斜肌、腹直肌等,并测量骨骼肌的横截面积(cm2)。将这些肌肉的横截面积值与每例患者身高的平方(m2)进行标准化,获得L3水平的骨骼肌指数(L3-SMI)[16]。该方法是目前公认的诊断肌减少症的标准方法,根据既往文献对亚洲人群肌减少症的量化标准, L3-SMI诊断肌减少症的截止值为男性≤ 40.8 cm2/m2, 女性≤ 34.9 cm2/m2[17-18]。
所有患者的术前营养状态评估由2名营养科专业医生分别使用NRS 2002量表和PG-SGA独立完成。NRS 2002量表的评估内容包括疾病的严重程度、食欲和食物摄入的变化、体质量指数(BMI)、近期体质量减轻和年龄,以患者的疾病评分(0~3分)、营养评分(0~3分)和年龄(≥70岁计1分)计算营养风险总分(0~7分)[19-20]。本研究根据NRS 2002量表评分,将所有患者分为营养风险人群(≥ 3分)与非营养风险人群(<3分)。
PG-SGA主要评估内容包括: ① 体质量丢失评分; ② 疾病与年龄评分; ③ 代谢应激评分; ④ 体格检查评分。总分为上述每项获得的分数之和,可评估患者的营养状况与营养需求。根据PG-SGA评分,可将患者的营养不良风险分为A、B、C共3个等级,其中A级为0~1分,表明患者营养状况良好; B级为2~8分,表明患者存在疑似营养不良或中度营养不良; C级为≥9分,提示严重营养不良,需要及时进行营养干预[21-22]。
1.3 资料收集
收集所有患者的人口统计学资料(年龄、身高、体质量、BMI、吸烟史、基础疾病等)与临床病理资料(肿瘤位置、手术切除范围、手术方式、组织学分化、TNM分期),由经过统一培训的研究人员通过检索医院电子病例数据库系统完成。使用世界卫生组织/东部肿瘤合作组(ECOG)量表对患者的体力状态进行分级,胃癌TNM分期参照美国癌症联合委员会(AJCC)发布的第8版分类标准[23]。入院后48 h内,对每例患者的空腹血样进行实验室检测,主要实验室参数包括血红蛋白(g/dL)、外周血白细胞计数(×109/L)、淋巴细胞计数 (×109/L)、血小板计数(×109/L)、血清白蛋白(g/L)、C反应蛋白(mg/L)、血清总胆固醇(mmol/L)、甘油三酯(mmol/L)等。
1.4 统计学分析
使用SPSS 22.0软件进行数据处理与统计分析,对服从正态分布的连续变量采用均值±标准差进行描述,两独立样本t检验用于有和无肌减少症患者组间差异的比较; 对分类变量采用χ2检验或Fisher′s精确检验,比较组间基线特征的分布差异。通过受试者工作特征(ROC)曲线确定NRS 2002量表和PG-SGA识别肌减少症的临界值,最佳分割点根据约登指数(敏感性+特异性-1)获得,并计算曲线下面积(AUC)、敏感度及特异度。以存在肌减少症作为研究的主要自变量,采用多因素Logistic回归分析评估与之独立相关的协变量,结果以比值比(OR)及其95%置信区间(95%CI)展示。所有分析均为双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料分析
136例胃癌患者的平均发病年龄为(61.0±12.0)岁,男85例(62.5%),女51例(37.5%),平均BMI为(22.8±3.4) kg/m2; 根据AJCC第8版胃癌TNM分期,分别有Ⅰ期、Ⅱ期、Ⅲ期患者39例(28.7%)、52例(38.2%)、45例(33.1%)。使用NRS 2002量表进行评估,共有84例(61.8%)胃癌患者被认定为术前营养风险人群(NRS 2002评分≥3分); 根据PG-SGA评估标准, 33例(24.3%)患者营养状况良好, 90例(66.2%)存在疑似或中度营养不良, 13例(9.6%)为严重营养不良。
研究队列的平均L3-SMI为(45.0±7.4) cm2/m2, 其中男性L3-SMI为(47.3±7.2) cm2/m2, 女性为(39.7±4.5) cm2/m2。根据L3-SMI对肌减少症的定义,共43例(31.6%)胃癌患者被诊断为肌减少症,而其他93例(68.4%)患者被归类为非肌减少症。与非肌减少症患者相比,肌减少症患者的平均年龄更大[(64.1±12.2)岁与(59.5±11.7)岁,P=0.038], BMI[(21.1±3.1) kg/m2与(23.6±3.2) kg/m2,P<0.001]和L3-SMI[(39.7±5.6) cm2/m2与(47.5±6.7) cm2/m2,P<0.001]更低。肌减少症患者的血红蛋白值(P=0.013)、外周血淋巴细胞计数(P=0.031)、血清白蛋白(P=0.003)、总胆固醇(P=0.033)及甘油三酯水平(P=0.031)均显著低于非肌减少症患者。此外,肌减少症还与NRS 2002评分≥3分(P=0.005)和PG-SGA定义的严重营养不良(P<0.001)显著相关。见表1。

表1 肌减少症与非肌减少症患者的一般资料比较
2.2 NRS 2002量表、PG-SGA评分与肌减少症的关系
ROC曲线显示, PG-SGA识别胃癌患者肌减少症的最佳临界值为5分,AUC为0.714 (95%CI: 0.621~0.807), 敏感度和特异度分别为76.7%和59.5%; NRS 2002量表识别肌减少症的AUC为0.658(95%CI: 0.560~0.757), 敏感度和特异度分别为68.8%和63.4%。见图1。

图1 NRS 2002量表及PG-SGA评分识别肌减少症的ROC曲线
以存在肌减少症作为研究的主要自变量,将表1中的显著变量纳入多因素Logistic回归模型中,在调整混杂因素后,分析结果显示年龄(OR=1.046, 95%CI: 1.007~1.087,P=0.019)、BMI(OR=0.734, 95%CI: 0.627~0.859,P<0.001)、血红蛋白值(OR=0.805, 95%CI: 0.658~0.986,P=0.016)及PG-SGA评分(OR=4.484, 95%CI: 1.805~11.136,P=0.001)与胃癌患者肌减少症独立相关,其中年龄、PG-SGA评分与肌减少症风险呈正相关, BMI、血红蛋白值与肌减少症风险呈负相关。当PG-SGA评分≥5分时,胃癌患者肌减少症的发生风险增加了近4.484倍。见表2。
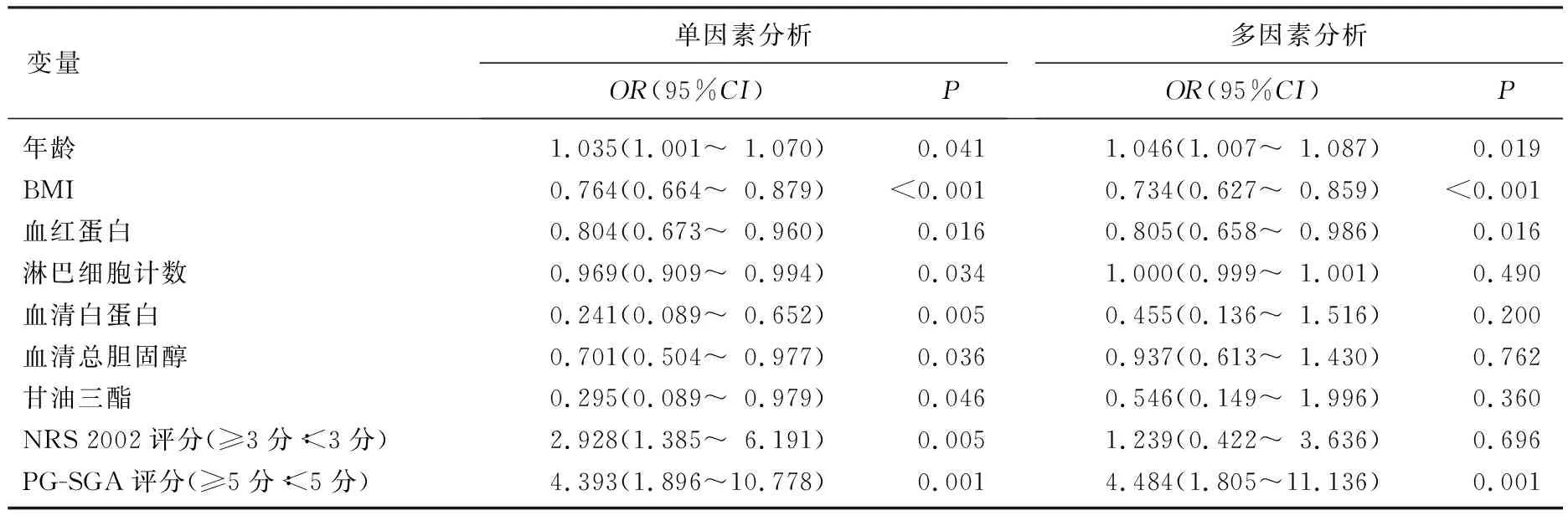
表2 胃癌患者肌减少症的相关因素分析
3 讨 论
肌减少症是因机体蛋白质能量消耗引起的全身肌肉质量与功能丧失,越来越多的证据[24-26]表明,肌减少症降低了患者对抗肿瘤治疗的耐受性,且与高转移率有关,是癌症患者高病死率的独立预测因素。计算CT扫描成像中腰椎L3水平的肌肉横截面是目前评估肌减少症的主要方法之一,此种方法能够在一定程度上避免身体成分测量的偏差,实现对肌肉质量的客观准确评估[27]。本研究通过回顾患者的术前CT扫描图像并计算L3-SMI, 发现有近1/3的胃癌患者在术前被诊断为肌减少症。研究[24, 28-29]称肌减少症在胃癌中的发生率为21.2%~54.4%, 这与本研究数据基本一致,提示肌减少症在胃癌患者中并不少见。与非肌减少症患者相比,肌减少症患者年龄更大, BMI、血红蛋白、外周血淋巴细胞计数、血清白蛋白、总胆固醇及甘油三酯水平更低。此外,肌减少症患者NRS 2002评分≥3分和PG-SGA定义的严重营养不良比率显著高于非肌减少症患者。研究[18, 30]表明肌减少症患者的NRS 2002评分、PG-SGA评分明显更高。这些发现进一步支持了肌减少症与营养不良之间的显著相关性。
通过CT扫描测量肌肉面积是目前评估肌减少症的金标准之一,但该方法存在高辐射暴露与高费用成本等缺点,限制了其在临床上的广泛应用。作为营养风险筛查与营养评估的有效工具,NRS 2002评分和PG-SGA评分已在预测癌症相关营养不良方面显示出了较高的敏感性和特异性[13, 31]。本研究中,高NRS 2002评分和PG-SGA评分均与肌减少症的发生具有显著相关性。ROC曲线分析显示, PG-SGA在识别胃癌患者肌减少症方面较NRS 2002评分具有更高的临床价值,当PG-SGA评分≥5分时,肌减少症的发生风险增加了近4.484倍。在一项涉及197例结直肠癌患者的横断面研究中, DE SOUZA B U等[32]发现肌减少症的发生风险在高龄、低BMI、低蛋白血症、高PG-SGA评分患者中显著增加。多变量分析显示PG-SGA评分是结直肠癌患者肌减少症的独立预测因子。癌症、营养不良和肌肉减少是多种因素共同作用的结果,任何单一的临床指标均不能完全确定患者的营养状况。与NRS 2002评分相比, PG-SGA从7个不同的角度全面评估了肿瘤患者的营养状况[33-34], 这或许为使用PG-SGA识别肌减少症提供了更大的可行性。
本研究的局限性有: ① 基于小样本、单中心的回顾性研究设计,使本研究的结果与结论受到潜在偏移的影响。② PG-SGA评分具有主观性,具体分数可能因评价者不同而异。总之,本研究结果表明, L3-SMI定义的肌减少症与NRS 2002评分、PG-SGA评分显著相关。PG-SGA评分≥5分提示胃癌患者存在较高的肌减少症风险, PG-SGA或可作为识别肌减少症的有效工具。

