黏蛋白MUC2的糖基单一化对Escherichia侵袭力及代谢功能影响及其参与溃疡性结肠炎发病机制研究
金 铭, 蒋灿灿
(安徽理工大学第一附属医院/安徽省淮南市第一人民医院 消化内科, 安徽 淮南, 232007)
溃疡性结肠炎(UC)是临床常见的炎症性肠道疾病,患者临床主要表现为腹痛、腹泻、黏液脓血便及腹部包块等[1]。肠道微生物可参与营养物质代谢,形成生物屏障,进而改善肠道微生态环境,但是UC中存在严重的肠道菌群失调[2]。肠道菌群大肠杆菌(Escherichia)在UC疾病中数量升高,导致共栖菌“变节”,参与代谢功能的糖苷酶等表达下降,而毒力和侵袭力增加,参与诱导UC的发病[3]。UC动物模型[4]证实,Escherichia丰度升高,可直接损伤黏液屏障,增加肠道渗透性,加快肠道组织损伤。
UC损伤机制是宿主黏膜对肠道细菌的过度反应[5]。肠道黏液屏障是机体针对环境、生理和免疫刺激的第一道动态的屏障,可防止微粒、毒素、病原体和共生菌与上皮细胞直接接触。黏蛋白是黏液主要成分,黏蛋白聚糖成分在维持黏液屏障功能中起重要作用。在慢性感染期间,成熟黏蛋白糖基化的数量减少,这可能是由于合成过程干扰和糖基转移酶表达的变化造成。目前,研究多关注于病原菌损伤黏液屏障通过抑制MUC2核心蛋白合成或促其降解完成,启动UC发病[6-7]。但结肠黏蛋白的聚糖特征性变化对UC是否有早期诊断价值及可能参与发病的机制尚不清楚。本研究尝试建立人结肠黏液蛋白的O-聚糖的检测方法,并探索其参与UC发生的机制,以期为UC的早期诊断提供可靠的生物标志物。
1 资料与方法
1.1 临床资料
选取2021年1月—2022年1月安徽省淮南市第一人民医院消化科、胃肠外科收治的75例UC患者作为研究组,选取同期体检者75例作为对照组。纳入标准: 经肠镜或手术治疗进行组织病理学确诊为UC者; 符合《2018年中国炎症性肠病诊断与治疗的共识意见》诊断标准者; 肠镜下取活组织标本者。排除标准: 未经组织病理学确诊或不符合诊断标准者; 其他原因导致的黏蛋白MUC2的糖基单一化者; 合并严重心肺、肾脏功能不全者; 合并严重感染、血液感染、免疫疾病及恶性肿瘤者; 妊娠期及哺乳期女性; 精神疾病或智力障碍者。通过Mayo评分系统对75例UC患者进行划分,轻度(3~5分)为27例,中度(6~10分)为26例,重度(11~12分)为22例。研究对象均了解本研究内容,并签署知情同意书。本研究符合本院伦理标准。
1.2 试剂与仪器
Escherichiacoli G1059购自上海保藏生物技术中心; 酶联免疫吸附试验(ELISA)板购自上海臻科生物科技; LB液体培养基购自上海博湖生物科技有限公司; MUC2的多聚糖、单糖购自上海恒远生物科技有限公司; 磷酸盐缓冲液购自广东环凯微生物科技有限公司; 庆大霉素购自西南药业股份有限公司; TritonX-100购自北京鼎国昌盛生物技术有限责任公司; 抗MUC2多克隆抗体,荧光定量PCR仪购自Bio-Rad公司。
1.3 免疫组化检测组织中MUC2阳性表达
将正常组织及UC病理组织剪切成小块,脱水、包埋后,采用甲醛固定,水化及 37.5 ℃静置0.5 h后,加入1%的EDTA, 山羊血清封闭。加入1抗(1∶500), 加入兔抗人RECK、DLL4抗体,加入二抗0.5 h后,复染,封皮。选择不交叉的10个视野,以淡黄色至棕褐色为阳性。染色成功后,所有切片均在同一条件下进行光学显微镜检查。采用Image-proplus 6.0图像分析软件,分析测定积分吸光度(A)值,以其平均值代表蛋白表达水平。
1.4 检测C反应蛋白(CRP)、粪便钙卫蛋白(FC)、降钙素原(PCT)
CRP: 采集研究对象静脉血3 mL, 3 000转/min离心15 min, 保留上清液,采用ELISA试剂盒检测血清中CRP表达。FCP: 留取研究对象5~10 g粪便, -20 ℃保存。解冻,接种环接种,挑取50 mg粪便样品,放入离心管中3 000×g离心5 min, 保留1 mL上清液,ELISA法检测,严格按照试剂盒说明书进行。PCT: 取2 mL静脉血,采用全自动生化分析仪检测其表达。
1.5 细胞培养
HT-29细胞以10%的胎牛血清接种于培养基中,当细胞处于对数生长期时分离细胞,调节细胞浓度,接种于培养瓶中,加入含有1%双抗的10%胎牛血清中培养。显微镜下观察细胞生长至80%~90%时,进行传代, 75%乙醇消毒,弃去旧的培养基,磷酸盐缓冲液洗涤3次,加入0.25%胰蛋白酶消化,生长至90%时,终止消化反应,脱壁后,以3 500转/min(离心半径12 cm)离心5 min, 弃去上清液放入培养基中, 2~3 d传代。
1.6 Escherichia处理
HT-29细胞使其适应无血清培养基,再在每个培养孔中分别加入Escherichia106cfu/0.1 mL PBS, 37 ℃ 共孵育2 h。将得到的细胞分为A组(细胞+MUC2的多聚糖)、B组(细胞+单糖)、C组(细胞+磷酸盐缓冲液)。在ELISA板中,每孔加入pH值为7的LB液体培养基170 μL, 10 μLEscherichia悬液(1×108cfu/mL), 分别加入0.01%的MUC2的多聚糖、0.01%的单糖及磷酸盐缓冲液进行培养,均设置3个复孔。
1.7 3组生物膜形态观察
将3组细胞培养10 h, 分别置于倒置荧光显微镜(Ti-E 2000, Nikon, Germany)和激光共聚焦显微镜(CLSM, TCS SP5 Ⅱ, Leica Co.,Germany)下,观察Escherichia生物膜的发育状况。
1.8 黏附力及侵袭能力
黏附实验: 处理后的细胞采用新鲜完全培养液培养,加入0.5%的Triton X-100 200 μL/孔孵育10 min, 倍比稀释后涂布含利福平的LB琼脂平板, 24 h后计数菌落数。侵袭实验: 细胞加入新鲜完全培养液(含100 μg/mL庆大霉素)孵育1 h。0.5% TritonX-100 200 μL/孔孵育10 min, 倍比稀释后涂布含利福平琼脂平板, 24 h后计数菌落数。
1.9 聚合酶链反应(PCR)检测各组Escherichia毒力基因LasR、pvdA、pcrV的水平及代谢功能GUS基因的水平
根据参考文献,合成LasR、pvdA及pcrV引物序列。LasR序列为F: 5′-CGCGGATCCATGGCCTTGGTTGACGGTTTTCTTG-3′, R: 5′-CCGGAATTCGAGAGTAATAAGACCCAAATTACGGC-3′;PCdA序列为F: 5′-GACTGAATAACGGGGTGAGCGCAGGCCGGA-3′, R: 5′-GTCGACGGCCGCTGATCAACAGATCTAC-3′;pcrV序列为F: 5′-GGCCTGGCGTGCGGCGGCCGGAGTGGCTG-3′, R: 5′-TG
CCGGCTTAATGAAGGACGTCCTGCAGCT-3′;GUS序列为F: 5′-GGTGGACCTTGAGGAAACT-3′, R: 5′-GTTGTGTGTTGAATTTGAAA-3′。PCR反应体系(20 μL): 混合酶10 μL, 上、下游引物(10 μmol/L)各1 μL, 菌液模板2 μL, ddH2O 6 μL。PCR反应条件: 94 ℃ 5 min; 94 ℃ 20 s, 58 ℃ 20 s, 72 ℃ 45 s, 共35次循环; 72 ℃ 5 min。取10 μL PCR扩增产物以1%琼脂糖凝胶进行电泳检测。
1.10 统计学分析

2 结 果
2.1 正常黏膜组织及UC组织中MUC2蛋白表达
正常黏膜组织及UC组织中MUC2蛋白表达水平分别为(0.71±0.05)、(0.56±0.08), 差异有统计学意义(t=13.770,P<0.001)。在结肠组织中MUC2主要表达在细胞质,在UC组织中MUC2阳性表达显著低于正常黏膜组织,见图1。

图1 免疫组化检测正常黏膜组织及UC组织中MUC2阳性表达(放大200倍)
2.2 不同疾病程度的UC组织中MUC2蛋白水平比较
轻度UC患者组织中MUC2蛋白水平为(0.63±0.10), 中度UC患者组织中为(0.55±0.09), 重度UC患者组织中为(0.50±0.05), 差异有统计学意义(F=14.880,P<0.001)。与轻度患者比较,中度患者组织中MUC2蛋白水平降低,差异有统计学意义(P<0.05); 与中度相比,重度患者MUC2蛋白水平降低,差异有统计学意义(P<0.05), 见图2。
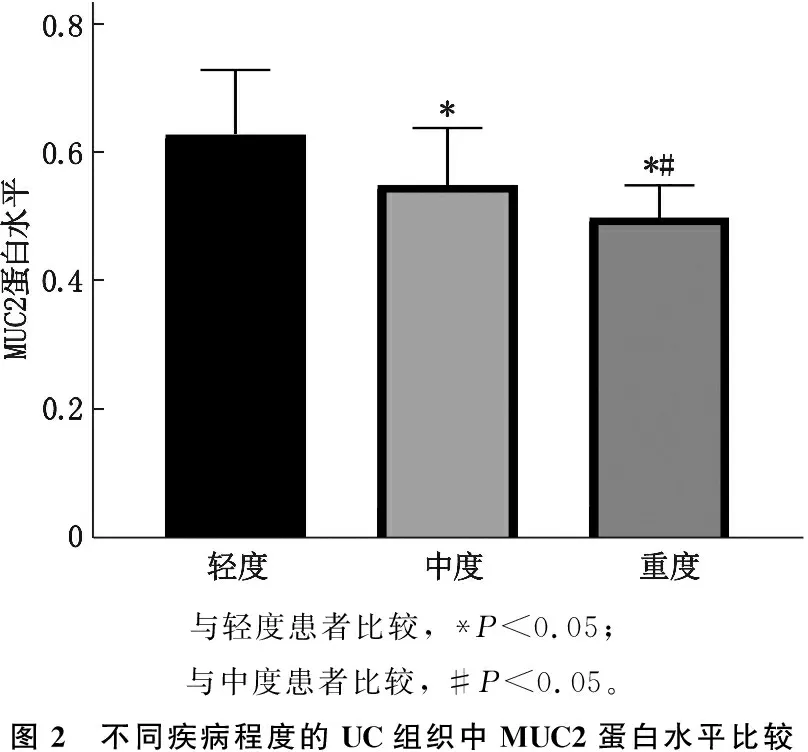
与轻度患者比较, *P<0.05; 与中度患者比较, #P<0.05。图2 不同疾病程度的UC组织中MUC2蛋白水平比较
2.3 对照组及研究组患者CRP、FC、PCT水平比较
与对照组相比,研究组患者CRP、FC、PCT水平升高,差异有统计学意义(P<0.05), 见表1。

表1 对照组及研究组患者CRP、FC、PCT水平比较
2.4 不同疾病程度UC患者的CRP、FC、PCT水平比较
与轻度患者相比,中度患者CRP、FC、PCT水平升高; 与中度患者相比,重度患者CRP、FC、PCT水平升高,差异有统计学意义(P<0.05), 见表2。

表2 不同疾病程度UC患者的CRP、FC、PCT水平比较
2.5 MUC2与CRP、FC、PCT水平的相关性
在UC疾病中, MUC2与CRP、FC、PCT水平均呈负相关, MUC2与CRP相关系数(r=-0.336,P=0.008)、MUC2与FC相关系数(r=-0.410,P=0.001)、MUC2与PCT相关系数(r=-0.377,P=0.003)见图3。

图3 MUC2与CRP、FC、PCT水平关系分析
2.6 Escherichia生物膜形态观察
观察3组Escherichia生物膜形态, A组Escherichia的荧光强度显著低于B组、C组,荧光聚集度也减弱,说明了在MUC2在作用下生物膜形成受到了抑制,见图4。

图4 各组肠道杆菌生物膜形态观察(放大200倍)
2.7 Escherichia的黏附力及侵袭能力比较
A组、B组、C组Escherichia黏附率分别为(15.30±2.55)%、(63.25±8.08)%及(48.61±6.67)%, 差异有统计学意义(F=93.480,P<0.001)。 A组、B组、C组Escherichia侵袭率分别为(24.80±5.11)%、(70.21±10.60)%及(53.34±8.06)%, 差异有统计学意义(F=46.620,P<0.001)。与A组相比, B组Escherichia黏附率及侵袭率均升高,与B组相比, C组Escherichia黏附率及侵袭率均降低,差异有统计学意义(P<0.05), 见图5、图6。

与A组比较, *P<0.05; 与B组比较, #P<0.05。图5 各组Escherichia黏附率比较

与A组比较, *P<0.05; 与B组比较, #P<0.05。图6 各组Escherichia侵袭率比较
2.8 各组LasR、pvdA、pcrV及GUS基因水平比较
与A组相比, B组LasR、pvdA、pcrV及GUS基因水平升高,与B组相比, C组LasR、pvdA、pcrV及GUS基因水平降低,差异有统计学意义(P<0.05), 见表3。

表3 各组Escherichia中LasR、pvdA、pcrV及GUS基因水平比较
3 讨 论
UC是发病原因不明的慢性结肠及直肠病变,病变位置为结肠黏膜层,可累及整个结肠[8]。UC发病机制复杂,涉及免疫、感染、饮食及遗传等因素。近些年对细胞因子及黏度因子的研究,正在逐步揭晓UC的发病机制,并认为能够为开发新的治疗途径提供依据。
黏液基因蛋白是黏液凝胶的主要组成成分,广泛存在于消化道上皮细胞中。目前,有研究[9]证实MUC表达水平与消化道疾病的发生发展存在相关性。MUC2是MUC蛋白家族成员之一,认为其具有结肠黏膜保护作用,在UC患者中表达显著低于健康人群,说明其表达缺失是UC发病的主要因素[10]。本研究结果显示,在UC组织中MUC2表达显著低于正常黏膜组织,在不同疾病程度UC组织中MUC2随着疾病程度的加重而降低。HANSKI C等[11]在UC组织中,采用SMUC41探针原为杂交方法检测MUC2表达,发现MUC2是杯状细胞特异性产物,和疾病状态无关联性。但也存在与之相反的结论,在静止期UC、活动期UC中检测MUC2表达,活动期患者组织中MUC2活性降低3倍左右,同时其蛋白含量显著降低,认为其在UC结肠黏膜组织中无法发挥结肠黏膜保护作用,进而加快疾病进程[12]。张永萍等[13]研究表明,在UC患者的肠道上皮组织中MUC2表达降低,认为其缺失可加快肠上皮细胞异常及溃疡,导致结肠炎症反应,并通过恢复期水平改善黏液层形态,进而改善肠道炎症症状。
本研究结果显示,在UC组织中CRP、FC、PCT表达水平显著高于正常黏膜组织,并随着UC疾病严重程度加重而升高,提示其表达升高而加快疾病进程。CRP是机体炎症损伤时分泌的急性蛋白,其反应迅速,在UC发病2 d时可显著升高,因此对于UC疾病的诊断具有较好灵敏度[14]。FC是中心粒细胞胞质蛋白库的重要组成部分,在多种感染性、炎性及恶性疾病中的血液、细胞或组织中呈高表达,与炎症反应呈正相关性[15]。FC在UC组织呈高表达,在UC活动期中FU表达水平显著高于缓解期,随着疾病程度的变化而改变。研究[16]证明, UC发生发展与肠腔内细胞感染相关, PCT是由菌毒素及炎性细胞因子共同刺激产生,可作为感染性疾病常见标志物。PCT在UC患者外周血中表达升高,并随着疾病的加重而升高,可作为UC疾病诊断的标志物之一。本研究结果显示,在UC疾病中, MUC2表达与CRP、FC、PCT均表现为负相关性, MUC2表达缺失加重结肠炎症反应,而CRP、FC、PCT均为炎症反应相关因子,三者表达随着MUC2表达降低而升高,而促进疾病进展。
Escherichia是引起新生儿脑膜炎、败血症的等疾病常见的细胞,黏附及侵袭作用时,其与宿主细胞HT29细胞发挥关键作用,其致病性只有穿过肠道屏障才可引起感染。既往研究[17]中,Escherichia可加快HT29细胞黏附及侵袭,并通过黏蛋白MUC2的糖基单一化加快黏度及侵袭能力。相关研究[18]表明,部分糖链可以成为微生物定植的位点,成为细胞与环境相互交通的平台,并认为O型-糖链缺失可导致肠道炎症发生。本研究结果显示,B组细胞黏附及侵袭能力最强,说明MUC2被抑制后可通过合成一些酶类,其中含有O-型糖链,可导致其酶类活性降低,而无法发挥肠黏膜保护作用。本研究结果显示, B组细胞中Escherichia所导致的毒性作用最强,主要表现为相关毒性基因LasR、pvdA及pcrV表达升高,同时GUS基因水平表达降低。LasR、pvdA及pcrV均为Escherichia生物膜相关毒力基因,其表达升高可加快Escherichia对宿主细胞的侵袭及黏附作用,进一步定植于器官表层,提高炎症反应促进UC疾病进程。GUS基因是从Escherichia中克隆出的,其可调节植物甚至动物基因的表达。本研究结果显示,在B组中GUS基因表达水平最高,说明MUC2的糖基单一化可增加Escherichia的GUS基因水平[19]。提示MUC2降低可增加细胞内Escherichia数量,增强其毒力作用,故本研究推测通过MUC2的糖基单一化可提高LasR、pvdA及pcrV、GUS基因水平,进而加快Escherichia的侵袭力,但是其具体机制还需要进一步证实。
综上所述, UC组织中MUC2表达降低,并随着疾病程度的加重而降低,与CRP、FC、PCT表达呈负相关。Escherichia与MUC2的糖基单一化培养后,可增加其侵袭及黏附能力,提高其毒性作用。

