短链脂肪酸对HepG2细胞脂质堆积模型脂质代谢的影响*
郭宇帆,高 冰,2,姜红梅,商佳琪,高 龙,2,赵宇航,田春风,李 凯,包 艳,2
(1.包头医学院公共卫生学院,内蒙古 包头 014040;2.包头医学院营养与食品健康研究所)
肥胖是许多国家都正在面临的一个日益严重性难题,身体质量指数(body mass index,BMI)增加导致多种疾病患病风险增加,如2型糖尿病和心脑血管疾病[1]。肠道微生物群可以通过调节免疫系统、维持上皮屏障预防多种疾病,并且在维持肠道内环境平衡和人类健康方面发挥着重要功能[2]。肠道菌群具有多种人体不具备的酶系,能够将食物中不能完全被消化、分解的寡聚糖、蛋白质和大型多糖等一系列物质酵解成短链脂肪酸(short-chain fatty acids,SCFAs)等小分子物质,主要包括乙酸、丙酸、正丁酸、异丁酸和戊酸等。SCFAs作为肠道微生物群和宿主之间的中介,在调节肠道屏障的通透性、炎症控制、胆汁酸代谢、免疫功能和疾病控制等方面有重要作用[3-4]。
课题组前期对不同BMI蒙古族儿童粪便中SCFA含量的变化进行分析发现,肥胖组儿童SCFAs含量升高,SCFAs含量的差异归因于他们的体重指数BMI的差异。一些动物学研究也发现,正常和肥胖SD大鼠盲肠内容物SCFAs含量及对应比值与其粪便结果均存在差异[4]。因此,在维持机体能量代谢平衡中SCFAs可能作为一个重要因素改变宿主的能量吸收和代谢过程[5-6]。脂肪酸的氧化被SCFAs激活后,能够抑制脂解,最终可使血浆中的游离脂肪酸浓度降低,从而使体重减轻[7-8]。AMPK可以通过磷酸化作用或其他方式调节一系列的脂代谢关键酶的活性以维持肝脏能量的稳定,AMPK可以抑制机体内TC的合成从而抑制糖异生,也可抑制脂肪组织内脂肪酸的合成。因此本实验探究SCFAs是否通过影响AMPK信号通路来调节脂质代谢。
HepG2细胞来源于一个15岁白人的肝癌组织,油酸钠(sodium oleate,OA)诱导HepG2细胞建立脂质堆积模型广泛应用于脂肪肝及脂质代谢等体外细胞实验研究[9]。本研究通过建立HepG2细胞脂质堆积模型,使用不同浓度的SCFAs对HepG2细胞脂质堆积模型进行干预,观察HepG2细胞形态以及细胞活力,检测TC、TG含量以及细胞AMPK磷酸化水平,探讨SCFAs对HepG2细胞脂质堆积模型脂质代谢的影响,为肥胖及其相关代谢疾病防治提供新思路和实验基础。
1 材料与方法
1.1材料和试剂 实验所用细胞为人肝癌HepG2细胞系,购于ATCC细胞库。胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、磷酸盐缓冲液(phosphate buffered saline,PBS)、DMEM培养基(以色列Biological Industries公司);甲醇、异丙醇,无水乙醇(天津市凯通化学试剂有限公司);二甲基亚砜(DMSO)(美国SIGMA公司);油酸钠(西安鲲创科技有限公司);噻唑蓝(MTT)(美国Amresco公司);TC、TG试剂盒(南京建成生物工程研究所);油红O(成都艾科达化学试剂有限公司);蛋白质定量试剂盒(BCA法)(北京普利莱基因技术有限公司);AMPK抗体,P-AMPK抗体(英国Abcam公司);细胞裂解液(碧云天生物技术研究所);脱脂奶粉、AMPK抑制剂Compound C(美国MCE公司);SDS-PAGE凝胶试剂盒,Tris、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Tween20(博士德生物工程有限公司)。
1.2方法
1.2.1HepG2细胞脂质堆积模型的建立 HepG2细胞冻存于-80 ℃保存,复苏后将细胞接种于10 cm培养皿中,在含有双抗体和10 %FBS的DMEM培养基中培养,放置于37 ℃、CO2浓度为5 %的培养箱内。待培养皿底部HepG2细胞汇合率达到70 %时,更换无血清培养基培养细胞24 h,取出培养皿弃去原有培养液,加入浓度为0.5 mmol/L油酸钠的高脂培养基培养24 h。使用油红O染色法观察细胞内脂质堆积,倒置显微镜下观察出现橙红色或橘红色脂滴说明高脂细胞模型已经建立。
1.2.2MTT法检测HepG2细胞存活率 96孔板内接种对数生长期并且生长状态良好的HepG2细胞悬液,每孔培养液为100 μL,细胞密度为104个/mL,设置6个重复孔。加入不同浓度梯度的SCFAs,选用0、6、12、24、36 mmol/L的SCFAs(乙酸、丙酸、正丁酸)干预HepG2细胞,在0 h、12 h、24 h和48 h采用MTT法检测细胞的活力值,酶标仪450 nm处测吸光度并进行存活率计算。
1.2.3HepG2细胞脂质堆积模型TC、TG含量检测 通过HepG2细胞活力值结果显示,选择6、12、24 mmol/L的SCFAs对HepG2细胞脂质堆积模型进行干预处理。干预12 h后弃掉上清,取HepG2细胞TC、TG试剂盒检测TG、TC含量。
1.2.4HepG2细胞脂质堆积模型蛋白含量检测 通过上述实验,选择12 mmol/L的SCFAs为干预浓度进行蛋白测定时,用Western blot检测AMPK、p-AMPK、ACC和p-ACC蛋白的表达。

2 结果
2.1HepG2细胞脂质堆积模型的建立 使用油红O染色法观察细胞内脂质堆积,HepG2细胞脂质堆积模型使用油红O染色后,倒置显微镜下观察出现橘红色脂滴,说明成功建立HepG2细胞脂质堆积模型。见图1。
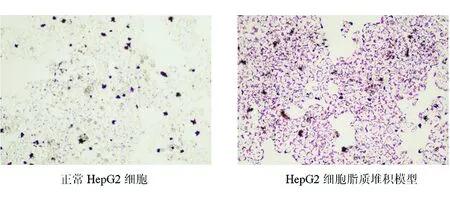
图1 正常HepG2细胞与HepG2细胞脂质堆积模型对比图(×100)
2.2SCFAs对HepG2细胞存活率的影响 随着SCFAs干预时间的延长,HepG2细胞的活性显著降低(P<0.05);干预时间为12 h时细胞状态较好,24 h和48 h时细胞死亡较多;SCFAs浓度为48 mmol/L时细胞大量死亡。见图2。
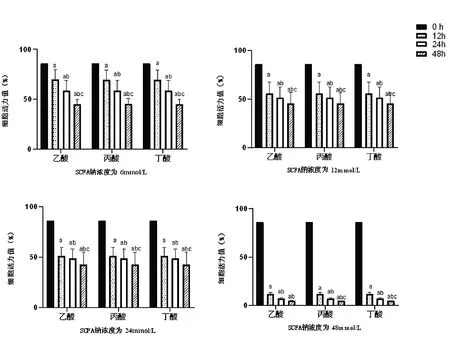
图2 SCFAs在不同时间对HepG2细胞脂质堆积模型细胞活性的影响注:a,与0 h相比,P<0.05;b,与12 h相比,P<0.05;c,与24 h相比,P<0.05
选择时间为12 h检测细胞活力值,加入不同浓度SCFAs对HepG2细胞活性有抑制作用(P<0.05),HepG2细胞的生长对SCFAs存在剂量依赖性,即随着SCFAs浓度的升高,HepG2细胞活性逐渐降低。见表1。
表1 SCFAs对HepG2细胞脂质堆积模型吸光度的影响
2.3SCFAs干预HepG2细胞脂质堆积模型后细胞形态学变化 加入不同浓度SCFAs后细胞形态发生不同程度的改变。对照组HepG2细胞呈梭形,单层贴壁生长,状态良好,排列均匀且紧密,折光率高,增殖旺盛,胞体大;加入OA后镜下观察细胞出现亮点,说明脂滴已经形成,细胞内脂质堆积程度明显增加;6 mmol/L组细胞排列开始松散;12 mmol/L时细胞折光率减弱,细胞间距变大,贴壁能力下降,但细胞形态完整;24 mmol/L时细胞开始变小变圆,部分细胞脱落悬浮于培养液中;36 mmol/L时可见大部分细胞明显变圆,细胞体积缩小,细胞数量明显减少。见图3、图4。
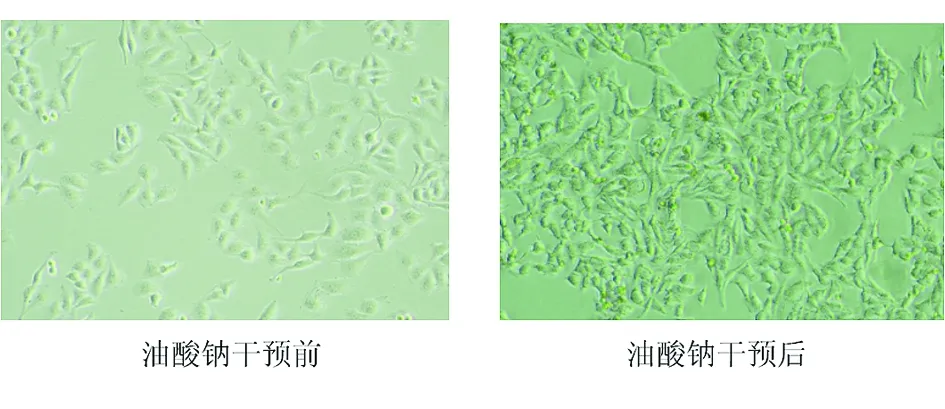
图3 油酸钠干预前后HepG2细胞形态学的变化(100×)
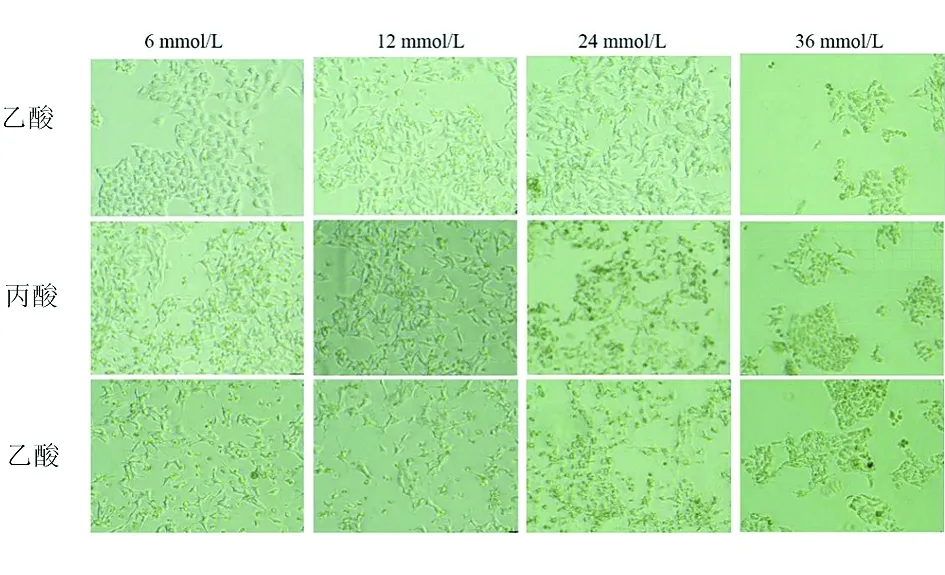
图4 不同浓度的SCFAs干预后HepG2细胞形态学的变化(100×)
2.4HepG2细胞脂质堆积模型TC、TG含量检测结果 HepG2细胞脂质堆积模型组TC含量与正常对照组相比升高(P<0.05);在干预12 h后,不同浓度的SCFAs作用HepG2细胞脂质堆积模型,TC含量降低(P<0.05),随着SCFAs浓度升高TC含量降低。见图5。
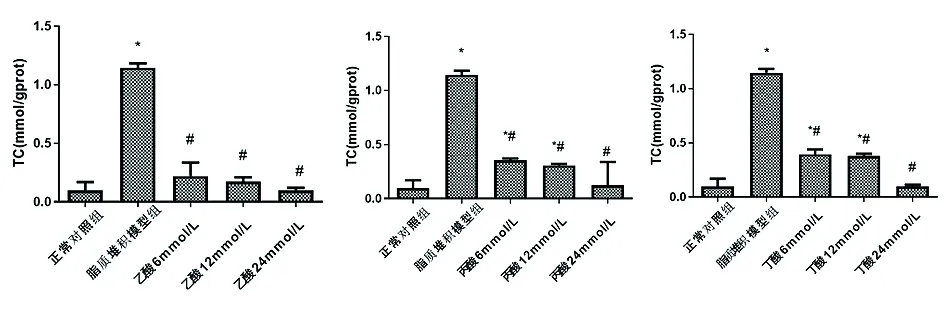
图5 SCFAs对HepG2细胞脂质堆积模型TC含量的影响注:*与正常对照组相比,P<0.05;#与HepG2细胞脂质堆积模型组相比,P<0.05
HepG2细胞脂质堆积模型组TG含量与正常对照组相比升高(P<0.05);使用不同浓度的SCFAs对HepG2细胞脂质堆积模型干预12 h后,TG含量降低(P<0.05),随着SCFAs浓度升高TG含量降低。见图6。
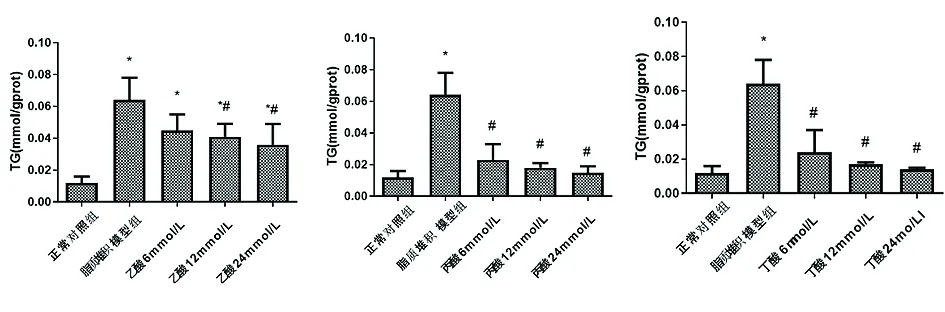
图6 SCFAs对HepG2细胞脂质堆积模型TG含量的影响注:*与正常对照组相比,P<0.05;#与HepG2细胞脂质堆积模型组相比,P<0.05
2.5HepG2细胞脂质堆积模型蛋白表达结果 使用SCFAs对HepG2细胞处理均可抑制p-AMPK的表达水平,其中使用丁酸处理能够最有效地抑制p-AMPK的表达,其次为丙酸,效果最低的为乙酸,但细胞AMPK总体表达水平变化不大,说明SCFAs可抑制AMPK信号通路的激活。见图7、图8。
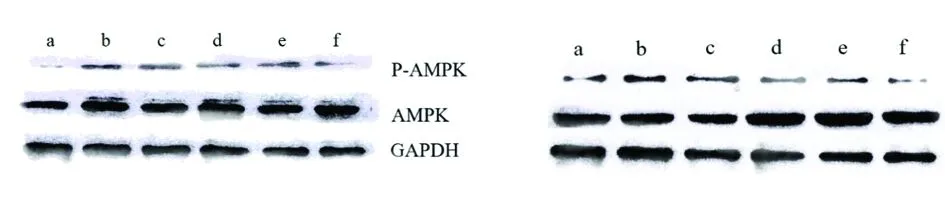
图7 不同种类SCFAs激活AMPK、ACC的量效关系注:a为正常对照组;b为脂质堆积模型组;c为乙酸12 mmol/L组;d为丙酸12 mmol/L组;e为丁酸12 mmol/L组;f为Compound C组

图8 不同种类的SCFAs对激活细胞内AMPK、ACC的影响注:*与正常对照组相比,P<0.05
3 讨论
《中国居民膳食指南(2022)》显示,目前我国成年居民超重或肥胖已经超过一半。全球肥胖在过去20年内急剧增长,全球共有10亿人属于肥胖患者,中国肥胖人数高居世界第一,超重肥胖已成为一个日益严重的全球公共卫生问题[10]。
机体内肠道菌群产生多种代谢产物,这些代谢产物是肠道菌群和宿主之间的信使,其中包括SCFAs在内的大部分会对宿主健康产生有益影响[11]。SCFAs是肠道有益细菌代谢膳食纤维等碳水化合物所产生的代谢物,它既是体内重要能量来源,也作为新型信号分子调节人体能量代谢[12]。诸多研究已经表明SCFAs在消化、营养代谢、能量供应、维持肠道稳态等各种生物过程和病理状态中发挥重要作用,此外,SCFAs还可以通过激活肝脏和肌肉中的AMPK活性来增加能量消耗[13]。通过干预生活方式和饮食习惯调整肠道菌群,例如减少高脂肪饮食、增加体育运动以及补充膳食纤维等方式,可以有效促进肠道菌群的改善,调控肠道发酵相关基因的微生物表达,继而减少肥胖相关疾病的发生发展[14]。
基于上述背景,SCFAs调节脂质代谢作用及其机制的研究对肥胖的发生发展有重要意义。本研究选择0、6、12、24、36 mmol/L的5个浓度梯度的SCFAs对细胞进行干预处理,随着SCFAs浓度的增加,对HepG2细胞活性的抑制作用逐渐增强,出现明显的剂量依赖性,高浓度的SCFAs对HepG2细胞具有直接损伤作用。说明SCFAs可对HepG2细胞的增殖分化产生一定的抑制作用,方剑等[15]的研究也发现SCFAs可促进HepG2细胞凋亡。
TC可作为脂质代谢的指标,TG在维持体内能量代谢中发挥重要作用[16-17]。SCFAs可使高脂饮食诱导的肥胖小鼠体重减轻,调节脂质代谢的紊乱;也可以在体内改变宿主的能量吸收和代谢过程,调节机体内能量的平衡[18]。油酸钠可以使细胞内产生脂质代谢紊乱,并促进脂质的合成,导致细胞内TC、TG含量增加。油酸钠诱导HepG2细胞脂质堆积模型建立后细胞TC、TG代谢异常,SCFAs干预后,TC、TG含量与HepG2细胞脂质堆积模型组相比显著降低,说明SCFAs能够促进脂肪自身分解,抑制TC、TG的合成,从而降低HepG2细胞模型中脂质的含量。
为了进一步研究SCFAs调节脂质代谢的机制,我们检测了AMPK通路相关蛋白的表达。机体内能量的改变是活化AMPK的经典途径,部分研究认为,被活化的AMPK可使其下游的脂肪酸合成关键酶ACC失活,致使机体合成代谢关闭,分解代谢开启,继而抑制脂肪酸的累积和脂质的合成,调节脂质代谢并促进脂肪酸氧化,抑制TC、TG和脂肪的合成[19-20]。SCFAs与位于脂肪细胞上的G-蛋白偶联受体43(G-protein coupled receptor43,GPR43)结合后能够促使细胞分泌瘦素,瘦素作用于机体使摄食量减少,且可以增加能量的释放,抑制脂肪细胞的增殖合成,影响脂质代谢[21-22]。本研究结果表明,SCFAs能够不同程度地抑制油酸钠诱导的脂质堆积模型组细胞内AMPK、ACC的磷酸化表达,且具有量效关系。同时,细胞内TC、TG含量的检测结果也进一步表明抑制AMPK信号通路可以降低细胞脂质的积累[23]。Anthony等[24]的研究表明,AMPK的活化可以抑制啮齿动物脂肪细胞中脂肪溶解,促进脂肪的积累,这可能与激素敏感性甘油三酯脂肪酶(hormone-sensitive lipase,HSL)在脂滴表面定位有关,HSL可影响脂肪水解以及脂类的积累,AMPK可影响HSL活化。AMPK通路的活化对脂肪积累促进或抑制作用是有争议的[25],因此,SCFAs对于脂肪代谢及AMPK活性的影响,仍需要深入探讨。
人体中SCFAs以酸的形式存在,本实验采用乙酸、丙酸和正丁酸进行实验,但是SCFAs在体内具有复杂的生物学活性,易挥发,在体外的细胞实验中不能完全模拟其在体内分布状态;此外体内部分SCFAs以结合形式存在,直接穿过上皮屏障发挥作用[26]。因此本实验还存在一定局限性,在今后的研究中还需进一步探究其盐类对细胞的作用机制以及动物实验明确SCFAs对机体作用效果。
综上所述,SCFAs可以调节HepG2细胞脂质代谢,可以有效降低HepG2细胞脂质堆积模型中TC、TG含量,SCFAs对HepG2细胞脂质堆积模型AMPK通路蛋白表达产生一定的影响作用,对预防肥胖及相关疾病的发生和发展有重要意义。

