2种广叶绣球菌多糖分子量分布及抗炎活性比较
王宏雨,张迪,罗贝贝,翁梦婷,曾辉,林衍铨
1. 福建省农业科学院食用菌研究所(福州 350014);2. 特色食用菌繁育与栽培国家地方联合工程研究中心(福州 350014)
广叶绣球菌(Sparassis latifolia),子实体洁白细嫩,口感脆嫩爽滑,具有很高的营养保健价值。研究结果表明,绣球菌中β-葡聚糖含量丰富,具有抗肿瘤、抗氧化、抗辐射、免疫调节、抗炎、抗病毒、降血糖、降血脂、提高机体造血功能等多种生物活性[1-5]。其中,抗炎活性是广叶绣球菌重要的生物学活性,Kim等[6]研究表明绣球菌水提物能够抑制40/80化合物诱导的小鼠全身过敏反应和血清组胺的释放,并降低PMA和A23187刺激的促炎性细胞因子的表达,在抗炎和抗过敏治疗方面具有潜在的应用价值;Choi等[7]对绣球菌80%甲醇提取物的研究表明该成分能够通过抑制IκBα的磷酸化从而降低LPS诱导的RAW264.7巨噬细胞的NO的释放水平;Han等[8]对绣球菌甲醇提取的氯仿萃取部分进行高效制备液相分离,获得一个高抗炎活性的成分SCF4,其能显著抑制LPS诱导的促炎介质NO、前列腺素E2及相关炎症因子TNF-α、IL-6、IL-1β的产生,且不表现出细胞毒性。
课题组已有的研究表明,不同干燥方法得到的绣球菌子实体干制品的水溶性多糖分子量分布差异显著,烘干品水溶性多糖成分分子量分布于10~30 kDa区域,而冻干品水溶性多糖成分则分布于200~400 kDa区域[9]。试验进一步对2种不同干制方法获得的绣球菌干品的水溶性多糖的主要成分进行分离纯化,以初步纯化后的广叶绣球菌子实体烘干品可溶性多糖成分SCG-G和冻干品可溶性多糖成分SCG-D为研究对象,对其具体的HPSEC分子量分布特性进行比较,并通过检测,分析其对RAW264.7巨噬细胞增殖影响,以及对RAW264.7巨噬细胞炎症模型中NO释放量及炎症因子TNF-α、IL-1β、IL-6释放量等指标的影响,比较2种绣球菌可溶性多糖成分的体外抗炎活性,为绣球菌可溶性多糖抗炎生物活性的应用提供理论依据,并为相关功能成分的食品与保健品生产过程中原料干燥方式和提取方法的选择提供参考。
1 材料与方法
1.1 材料与试剂
绣球菌子实体鲜品(福建天益菌业有限公司)。右旋糖酐分子量标准10种(中国食品药品检定研究院);Dextran、DXT1090K、DXT2370K右旋糖酐分子量标准(美国APSC);CellCounting Kit-8(日本DOJINDO Laborataries);DMSO D2650(美国SIGMA);RPMI-1640(美国GIBCO);FBS(美国ExCell Biology);RAW264.7细胞、0.25% Trypsin-EDTA、小鼠TNF-α、IL-1β、IL-6 ELISA检测试剂盒(中国江苏凯基生物技术股份有限公司);NO含量测定试剂盒(苏州格锐思生物科技有限公司);其余试剂均为国产分析纯、色谱纯;试验用水为超纯水。
1.2 仪器与设备
超净工作台(中国苏州净化);IX51生物倒置显微镜(日本OLYMPUS);多功能酶标仪(美国BioTek);xd-101 CO2培养箱(日本SANYO);U1900紫外扫描分光光度计(日本Hitachi公司);Waters 2695液相色谱仪(美国WATERS公司);UM 5000蒸发光检测仪(北京通微分析仪器有限公司);TSKgel GMPWxl色谱柱(日本东曹株式会社);Centrifuge 5804 R离心机(德国艾本德公司);Pilot3-6L真空冷冻干燥机(北京博医康有限公司);Milli-Q plus超纯水器(Millipore公司)。
1.3 方法
1.3.1 绣球菌水溶性多糖成分的制备与纯化
广叶绣球菌热风干燥品多糖和真空冷冻干燥品多糖的制备方法参照文献[8],采用热水提取,三氯乙酸脱蛋白的方法进行。
烘干品水溶性多糖组分SCG-G的纯化:将烘干品多糖用蒸馏水溶解,离心取上清定容为100 mg/mL的溶液,加入等体积的无水乙醇,混匀后静置过夜,以8 000 r/min离心10 min取上清,收集上清液减压浓缩至原体积的1/3,用截留分子量1 000的透析袋,对蒸馏水透析48 h,透析后冷冻干燥即为烘干品水溶性多糖SCG-G。
冻干品水溶性多糖组分SCG-D的纯化:冻干品多糖用蒸馏水溶解后离心取上清定容为100 mg/mL的溶液,加入等体积的无水乙醇,混匀后静置过夜,以8 000 r/min离心10 min取沉淀部分,沉淀部分用蒸馏水溶解后以8 000 r/min离心10 min取上清,用截留分子量14 000的透析袋,对蒸馏水透析48 h,透析后冷
冻干燥即为冻干品水溶性多糖SCG-D。
1.3.2 绣球菌多糖成分SCG-D、SCG-G分子量测定与多糖含量测定
多糖分子量分布测定采用高效凝胶渗透色谱法,参考张迪等[10]试验方法并稍作调整。
色谱条件:流动相采用0.05 mol/L乙酸铵,流速0.6 mL/min;柱温40 ℃;进样量20 μL;色谱柱TSKgel GMPWxL(7.5 mm×300 mm)。ELSD检测器:载气为空气;载气压力4.5 bar;流量2 L/min;漂移管温度60 ℃;数据分析系统Empower GPC。
以重均分子量2 700,5 250,13 050,64 650,135 350,300 600,922 000和1 719 000 Da的右旋糖酐为标准品,以保留时间对分子量的对数作线性回归。多糖样品和标准品用0.05 mol/L乙酸铵溶液溶解为约2 mg/mL的浓度,用于HPSEC分析。
多糖含量测定采用苯酚-硫酸法,多糖样品用蒸馏水配制成1 mg/mL浓度,取样100 μL蒸馏水补足至1 mL后参照NY/T 1676—2008《食用菌中粗多糖含量的测定》[11]中的检测方法进行测定。
1.3.3 CCK-8法检测细胞增殖活力
采用CCK-8法检测2种绣球菌多糖对RAW264.7细胞增殖活力的影响。试验方法参照文献[12]。将RAW264.7细胞消化、计数、配制成浓度5×104个/mL的细胞悬液,于96孔细胞培养板中每孔加入100 μL细胞悬液,置于37 ℃,5% CO2培养箱中培养24 h。设立阴性对照组,不同质量浓度绣球菌多糖试验组,96孔细胞培养板中每孔加入100 μL相应的含药培养基,置于37 ℃,5% CO2培养箱中培养72 h。加入10 μL CCK-8溶液,继续孵育3 h,摇床10 min轻轻混匀后,450 nm处检测吸光度(A)。
1.3.4 细胞上清液中NO、TNF-α、IL-1β、IL-6浓度的检测
ELISA检测方法根据试剂盒说明书和参考文献[13]中所述方法略作修改,将RAW264.7细胞消化、计数、配制成浓度5×105CFU/mL的细胞悬液接种到培养板中,设置空白组,LPS模型组(1 μg/mL),绣球菌多糖组(多糖10 μg/mL+LPS 1 μg/mL,多糖50 μg/mL+LPS 1 μg/mL,多糖100 μg/mL+LPS 1 μg/mL,多糖150 μg/mL+LPS 1 μg/mL),置于37 ℃,5% CO2培养箱中,药物与LPS共同孵育24 h,然后测定细胞上清液中NO、TNF-α、IL-1β、IL-6含量。
1.3.5 数据处理与分析
试验数据应用SPSS 23.0软件分析处理,采用ANOVA方差分析进行组间差异性检验。
2 结果与分析
2.1 绣球菌多糖成分SCG-G和SCG-D的高效凝胶渗透色谱分析
由图1和图2可知,绣球菌多糖SCG-G和SCG-D在色谱图上均呈现单一色谱峰。如表1所示,苯酚-硫酸法测得的多糖含量均在95%以上,说明二者均为均一多糖。通过重均分子标准曲线得到其重均分子量分别为1.48×104Da和2.47×105Da,最高峰分子量分别为1.20×104Da和2.14×105Da,多分散性指数表明2种多糖均具较好的均一性。

图1 绣球菌子实体烘干品多糖SCG-G成分的凝胶色谱图

图2 绣球菌子实体冻干品多糖SCG-D成分的凝胶色谱图

表1 绣球菌多糖成分SCG-G和SCG-D HPSEC数据
2.2 绣球菌多糖成分对RAW264.7细胞增殖的影响
SCG-G和SCG-D这2种多糖对RAW264.7细胞增殖影响如图3所示。SCG-D在低浓度时对RAW264.7增殖与空白对照组相近;质量浓度60 μg/mL以上时RAW264.7细胞增殖活性开始降低;质量浓度250 μg/mL时,细胞增殖活力为79.03%,呈剂量效应关系。由图3可见,SCG-D对RAW264.7细胞增殖活力影响较小,具有低细胞毒性的特点。与对照空白组相比,SCG-G对RAW264.7细胞增殖活力影响较大,呈明显抑制作用,且同等浓度下,SCG-G对RAW264.7细胞增殖抑制作用明显强于SCG-D。

图3 绣球菌多糖对RAW264.7细胞增殖的影响
2.3 绣球菌多糖成分对LPS诱导的RAW264.7细胞NO分泌量的影响
LPS是革兰阴性菌细胞壁外壁的组成成分,作用机体时激活巨噬细胞产生NO和释放细胞免疫因子。由图4可知,LPS干预后的RAW264.7细胞模型组分泌的NO浓度从空白组的4.09 μmol/L升高到20.34 μmol/L,升高约5倍,说明LPS对RAW264.7细胞炎症性反应建模成功。绣球菌冻干品多糖SCG-D在试验浓度范围内对LPS诱导的NO分泌具有极显著抑制作用(P<0.01),且呈现剂量效应关系。绣球菌烘干品多糖SCD-G在低浓度(10和50 μg/mL)对LPS诱导NO的分泌与LPS组相比具有显著抑制作用(P<0.01),但到高质量浓度(150 μg/mL)时对NO的分泌反而表现出一定促进作用。

图4 绣球菌多糖对RAW264.7巨噬细胞分泌NO的影响
2.4 绣球菌多糖成分对LPS诱导巨噬细胞RAW264.7分泌炎症因子水平的影响
2.4.1 绣球菌多糖成分对LPS诱导巨噬细胞RAW264.7分泌TNF-α的影响
TNF-α是炎症初期最早出现的炎症因子,主要由巨噬细胞分泌,能促进炎症的发生与发展。由图5可见,空白组分泌TNF-α浓度23.20 pg/mL,LPS诱导组分泌TNF-α浓度为60.45 pg/mL,LPS诱导下TNF-α的分泌水平增加近3倍。与LPS诱导组相比,SCG-D在低浓度(10 μg/mL)下即可显著抑制LPS诱导的TNF-α分泌(P<0.05),且随着浓度增加呈现剂量效应关系。SCG-G对LPS诱导的TNF-α分泌无显著抑制作用,且高浓度(100和150 μg/mL)时,反而表现出极显著促进作用(P<0.01)。
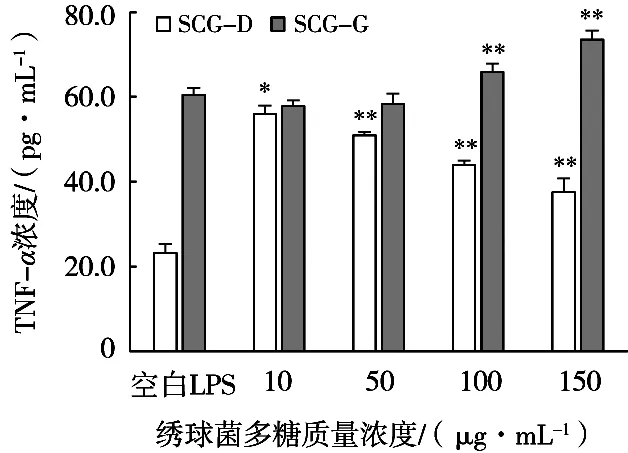
图5 绣球菌多糖对LPS诱导RAW264.7巨噬细胞分泌TNF-α的影响
2.4.2 绣球菌多糖成分对LPS诱导巨噬细胞RAW264.7分泌IL-6的影响
由图6所示,空白组IL-6浓度21.07 pg/mL,LPS诱导组IL-6浓度43.14 pg/mL。与LPS组相比,SCG-D在质量浓度50 μg/mL时即呈现对LPS诱导的IL-6分泌的显著抑制作用(P<0.01);随着SCG-D浓度上升,抑制作用逐渐增强,呈剂量效应关系,SCG-D浓度150 pg/mL时,IL-6浓度为27.63 pg/mL,抑制率达到70.29%。SCG-G对LPS诱导巨噬细胞RAW264.7分泌IL-6无显著抑制作用,高质量浓度(150 μg/mL)时则表现出显著促进作用(P<0.05)。

图6 绣球菌多糖对LPS诱RAW264.7导巨噬细胞分泌IL-6的影响
2.4.3 绣球菌多糖成分对LPS诱导巨噬细胞RAW264.7分泌IL-1β的影响
由图7所示,空白组IL-1β浓度15.33 pg/mL,LPS诱导组IL-1β浓度35.17 pg/mL。与LPS组相比,SCG-D对LPS诱导的IL-1β分泌的抑制作用在50 μg/mL浓度时候即达极显著水平(P<0.01),并随着浓度升高呈现剂量效应关系;质量浓度150 μg/mL时,IL-1β浓度为20.67 pg/mL,抑制率达到73.09%。而烘干品多糖SCG-G在50~150 μg/mL浓度范围内则表现出促进LPS诱导的IL-1β分泌的作用。

图7 绣球菌多糖对LPS诱导RAW264.7巨噬细胞分泌IL-1β的影响
3 讨论与结论
相关研究结果表明,绣球菌中的可溶性多糖具有很好的免疫调节和体外抗肿瘤、抗炎的活性[16-18],因此绣球菌水提物作为功能食品原料具有很好的应用价值。
在绣球菌水溶性多糖的结构和活性研究方面,有研究表明不同材料和提取方法获得的水溶性多糖的分子量分布和构成都有较大差异,同时,提取材料和提取方法对其活性成分的活性也有较大影响。Ohno等[14]对绣球菌干品水提多糖的分析表明,其水溶多糖中也存在β-葡聚糖,主要存在于1倍乙醇沉淀级份中,其分子量也较大,但含量较低;Yamamoto等[19]发现绣球菌的热水提取的分子量8 000以下的小分子成分能够显著抑制S180荷瘤小鼠的生长,增加其脾淋巴细胞INF-g的释放,并抑制肿瘤血管的生成,而该成分在传统的水提醇沉的多糖提取工艺中往往无法回收。张晓菲[20]采用超声波提取的绣球菌菌丝水溶性多糖的分子量主要分布在70~8 000 kDa区域,其中8×107Da的均一多糖能显著提高人单核白血病THP-1细胞株IFN-α释放水平,表现出增强免疫的活性。张雪梦等[21]通过水提分级醇沉获得8个水溶性多糖成分,其中激活Dectin-1受体活性最强的20E成分的重均分子量约500 kDa。郝正祺等[22]分离得到分子量1.04×104Da的绣球菌可溶性多糖成分SIP,其能显著提高巨噬细胞的吞噬能力、NO分泌量,增加细胞内TNF-α、IL-1β、IL-6、IL-3、IL-10、IFN-β免疫因子mRNA的表达量。试验通过热水提取法从绣球菌真空冷冻干燥品原料和热风干燥品原料中获得不同分子量分布构成的绣球菌水溶性多糖,并对它们的主要成分分别进行分离纯化,得到2个均一多糖,重均分子量分别为2.47×105Da和1.48×104Da,其中分子量较小的烘干品多糖SCG-G,其最高峰分子量为1.2×104Da,与郝正祺等[22]从烘干品中分离得到的绣球菌多糖SIP的分子量相似。
通过CCK-8法检测绣球菌多糖成分对巨噬细胞RAW264.7增殖活力的影响,结果表明SCG-D具有较低的细胞毒性,对RAW264.7增殖影响较小,而烘干品多糖成分SCG-G在高试验浓度(50~150 μg/mL)下能显著抑制RAW264.7细胞的增殖,250 μg/mL浓度时抑制率接近50%,表现出显著的细胞毒性。郝正祺等[22]分离获得的SIP与试验获得的SCG-G的分子量基本一致,但SIP对RAW264.7细胞未发现显著的细胞毒性,但亦无突出的促进增殖活性,考虑其试验处理浓度在1.95~31.25 μg/mL的低质量浓度范围内,推测降低SCG-G处理浓度,控制在10 μg/mL质量浓度范围内有可能消除其对细胞增殖的抑制,但有待进一步验证。
炎症是在致炎因素的作用下,由炎症细胞及其释放的炎症介质参与引起的一系列病理生理过程,过度的炎症反应产生的损伤因子会直接或间接造成组织和细胞的破坏[23]。以LPS诱导的RAW264.7巨噬细胞炎症模型对2种可溶性绣球菌多糖的抗炎活性进行检测和比较,结果表明SCG-D对LPS诱导的NO、TNF-α、IL-1β、IL-6的分泌具有显著的抑制作用,这与Choi等[7]前期对绣球菌水提物抗炎活性的研究结果相符。而SCG-G对LPS诱导的RAW264.7巨噬细胞炎症因子的分泌基本无明显的抑制效果,反而在较高浓度时还表现出显著的刺激作用,这与郝正祺等[22]对绣球菌SIP多糖对RAW264.7细胞免疫因子mRNA表达量影响的趋势一致,同时也与王萌皓等[24]对绣球烘干品中可溶性β-D-葡聚糖成分促进RAW264.7巨噬细胞NO释放,以及IL-6、TNF-α因子转录和蛋白表达的变化趋势相符。NF-κB通路是研究较为广泛的促炎细胞因子调节通路,也是LPS细菌脂多糖的主要作用通路,同时其与细胞凋亡也有密切关系[25],试验中SCG-G多糖高浓度处理组表现出显著的促炎作用,同时高浓度处理组72 h细胞增殖率亦表现出较高的细胞毒性,推测可能与其通过促炎细胞因子调节通路诱导的后期细胞凋亡作用有关。
综上所述,在绣球菌活性多糖提取及相关绣球菌水提物功能产品研发中,应当根据具体的目标功能成分的需求,慎重选择提取原料和提取工艺,无差别的传统水提醇沉工艺可能会造成目标功能成分的丢失或起不到功能成分富集增效的目的。试验中绣球菌冻干品原料和烘干品原料的活性差异显著,绣球菌冻干品可溶性多糖SCG-D具有较好的体外抗炎作用,可见在抗炎活性多糖成分提取中,宜以绣球菌冻干品为原料,采用热水提取工艺,以100 kDa以上中高分子量部分为目的成分进行提取制备,而有关SCG-D的具体构效关系和抗炎作用机理也有待进一步深入研究。

