茯苓微粉的粉体特征、多糖含量及抗氧化性研究
丁强,吴嬗嬗,耿璐娜 ,张越, ,王妍妍,陈卫东, ,
1. 安徽中医药大学(合肥 230012);2. 安徽敬道生物科技有限公司(亳州 236814);3. 直接口服中药饮片亳州市重点实验室(亳州 236000);4. 中药复方安徽省重点实验室(合肥 230012)
茯苓[Poria cocos(Schw.)Wolf]为多孔菌科真菌茯苓的干燥菌核[1],主要分布于我国的云南、贵州、湖北、安徽等地[2],具有利水渗湿、健脾宁心等功效。此外,茯苓作为可食用真菌,其营养价值和药用价值日益受到关注。现代药理研究表明,茯苓中含有多糖、三萜、甾体、氨基酸等化学成分[3-4],其中茯苓多糖具有抗肿瘤[5]、免疫调节[6]、抗氧化[7-9]等功效。然而,由于茯苓粉水溶性较差,这限制了其新产品的开发和利用。有研究表明药材经超微粉化处理后能提高其活性成分的溶出率和生物利用率,不仅能增强药效,提高中药的临床应用能力,而且能使中药资源得到更加充分的利用[10-12]。
茯苓超微粉方面的研究较少,主要集中在茯苓超微粉挥发性成分的研究[13]、茯苓超微粉粉碎工艺的研究[14]等方面,而缺少对茯苓不同粒径的粉体学性质、有效成分含量及药效活性的考察。因此,试验采用药典检验筛对茯苓粉末进行过筛分级,得到不同粒径的茯苓粉末,应用激光粒度分析仪对不同粒径粉末的粒度及其分布进行表征;并对不同粒径粉末进行粉体学相关性质考察,包括粉末休止角、堆密度、润湿性;采用苯酚-浓硫酸法测定不同粒径茯苓粉末中水溶性多糖的含量,考察不同粒径茯苓粉末的体外抗氧化能力,包括对DPPH·自由基的清除能力和ABTS·自由基的清除能力的考察,选定适宜的茯苓粉末粒径。
1 材料与方法
1.1 材料与仪器
1.1.1 茯苓来源
茯苓粉均(批号190107,安徽敬道生物科技有限公司),经安徽中医药大学俞年军教授鉴定,符合《中华人民共和国药典(2020年版)》一部各项规定,为茯苓Poria cocos(Schw.)Wolf的粉末。
1.1.2 试剂
苯酚(海麦克林生化有限公司);硫酸(上海捷企化学试剂有限公司);DPPH(上海源叶生物科技有限公司);ABTS(合肥博美生物科技有限责任公司);抗坏血酸(上海润捷化学试剂有限公司);抗坏血酸(上海润捷化学试剂有限公司);D-无水葡萄糖(中国食品药品鉴定研究院);无水乙醇(江苏强盛功能化学股份有限公司);甲醇(上海星可高纯溶剂有限公司)。
1.1.3 仪器与设备
多功能酶标仪(Multiskan FC,赛默飞世尔科技有限公司);1/10万电子天平(AB135-S,德国梅特勒-托利多仪器有限公司);激光粒度仪(MS2000,英国马尔文仪器有限公司);超声波清洗仪(AS30600BT,天津奥特塞恩斯仪器有限公司);紫外可见分光光度计(UV-5100,上海元析仪器有限公司);纯水仪(CascadaⅢ.Ⅰ10纯化水系统,颇尔过滤器北京有限公司);药典检验筛(R40/3系列,绍兴市上虞华丰五金仪器有限公司)。
1.2 试验方法
1.2.1 茯苓不同粒径粉末的制备及粒径测定
将茯苓粉末依次通过孔径为355 μm(45目),125 μm(120目),75 μm(200目),45 μm(325目)和38 μm(400目)的药典检验筛分级过筛得不同粒径的粉末。经激光粒度仪采用干法测定不同粒径粉末的体积、面积、比面积平均粒径大小,测定条件:样品折射率1.800+0.100i,介质折射率1.330,分析模式General purpose。
1.2.2 茯苓不同粒径粉末的粉体学性质考察
1.2.2.1 休止角的测定[15]
采用固定漏斗法测定休止角。取5 g样品粉末,水平放置绘图纸并在其上方固定玻璃漏斗,使样品匀速通过漏斗,自由下落至绘图纸上,自然堆积成最大直径圆锥体,测量该圆锥体直径和高度。重复上述步骤测定3次,按式(1)计算。
式中:H为圆锥体高度,cm;R为圆锥体直径,cm。
1.2.2.2 堆密度的测定[15]
采用量筒法测定堆密度。取1个量筒,将样品粉末匀速通过玻璃漏斗加入量筒,记录此时粉末体积与量筒总质量,重复上述步骤测定3次,按式(2)计算。
式中:M1为量筒质量,g;M2为量筒加样品粉末的总质量,g;V为粉末体积,mL。
1.2.2.3 润湿性的测定[16]
润湿性反映的是粉体完全悬浮于水中的时间,在直径10 cm的培养皿中,加入50 mL水,加入0.1 g样品粉末,记录粉末被水完全润湿的时间,重复上述步骤测定3次,参考结果进行不同粒径茯苓样品粉末的润湿性比较。
1.2.2.4 水分测定[1]
按照《中华人民共和国药典(2020年版)》四部中0832水分测定法中第二法烘干法对茯苓不同粒径粉末进行水分测定,计算各茯苓样品中含水量。
1.2.3 茯苓不同粒径粉末水溶性总多糖含量测定
1.2.3.1 溶液的制备
试验采用苯酚-浓硫酸法测定茯苓水溶性总多糖含量,按照前期试验方法[17]制备葡萄糖对照品溶液、茯苓供试品溶液、苯酚试剂。对照品溶液的制备:称取葡10.00 mg萄糖标准品,用蒸馏水溶解并定容至100 mL,即得0.1 mg/mL的葡萄糖对照品溶液;供试品溶液的制备:取具塞锥形瓶,各加入1.0 g茯苓不同粒径的粉末,按料液比1∶50(g/mL)加入超纯水,在超声功率100 W、超声温度25 ℃的条件下超声30 min后过滤,收取滤液,并取1.0 mL续滤液,稀释100倍,现配现用;苯酚试剂的制备:称取8.00 g苯酚,溶解于100 mL纯水中,得到8%的苯酚溶液。
1.2.3.2 方法学考察
按照前期方法[17]建立葡萄糖标准曲线,并开展方法学考察,包括精密度考察、重复性考察、稳定性考察及加样回收率考察。葡萄糖标准曲线的建立:分别精密吸取0.1,0.2,0.4,0.6,0.8和1.0 mL葡萄糖标准品溶液于试管中,加入超纯水至1.0 mL,精密加入1 mL 8%苯酚溶液和4 mL浓硫酸,沸水浴30 min后冷水浴10 min,摇匀,在490 nm处测定其吸光度。
1.2.3.3 茯苓样品溶液水溶性多糖含量测定
取不同粒径的茯苓粉末,各6份,按照供试品溶液的制备方法制备待测的样品,精密吸取1.0 mL待测样品溶液,按苯酚-浓硫酸法进行显色,在490 nm波长下测定吸光度,并计算茯苓不同粒径的粉末水溶性多糖的含量。
1.2.4 茯苓不同粒径粉末体外抗氧化活性测定
按照1.2.3.1的供试品溶液制备方法制备茯苓不同粒径的粉末的水溶性,考察不同粒径粉末溶液的清除DPPH·自由基和ABTS·自由基的能力。
1.2.4.1 DPPH·自由基清除能力的测定
参照文献及前期方法[18-19],并稍作修改。测量茯苓不同粒径粉末样品的DPPH·自由基清除率。用无水乙醇配制0.2 mmol/L的DPPH·溶液,冷暗处保存备用。取0.5 mL不同粒径的茯苓样品溶液与0.5 mL的DPPH溶液充分混匀后,常温暗处静置30 min,在517 nm处测定吸光度。重复上述步骤测定3次,按式(3)计算:
式中:A0为DPPH乙醇溶液的吸光度;A1为样品和DPPH乙醇溶液的吸光度;A2为样品溶液的吸光度。
1.2.4.2 ABTS·自由基清除能力的测定
参照文献及前期方法[19-20],并稍作修改。测量茯苓不同粒径粉末样品的ABTS·自由基清除率。将2.45 mmol/L过硫酸钾溶液和7 mmol/L ABTS溶液等体积混合后常温避光反应14 h后制得ABTS阳离子储备液。稀释ABTS阳离子储备液使其在734 nm的吸光度为0.700±0.020,即得ABTS阳离子溶液。取0.5 mL不同粒径的茯苓样品溶液与2.5 mL的ABTS阳离子溶液充分混匀后,常温暗处静置10 min,在734 nm处测定吸光度。重复上述步骤测定3次,按式(4)计算:
式中:A0为ABTS溶液的吸光度;A1为样品和ABTS溶液的吸光度;A2为样品溶液的吸光度。
2 结果与分析
2.1 茯苓不同粒径粉末的制备
如表1所示:茯苓粉末依次通过孔径为355 μm(45目),125 μm(120目),75 μm(200目),45 μm(325目)和38 μm(400目)的药典检验筛过筛,得到5种不同粒径的茯苓粉末,依次命名为粗粉、细粉、微粉Ⅰ、微粉Ⅱ、微粉Ⅲ。随着目数的增加,茯苓粉末的颜色逐渐由米白色偏向白色。

表1 茯苓5种不同粒径的粉末
2.2 茯苓不同粒径粉末粒径测定及其分布
激光粒度仪测定茯苓粒径分布结果如表2所示,与粗粉相比,茯苓微粉的D50由131.77 μm降低到28.09 μm,D90由247.32 μm下降到66.30 μm;茯苓不同目数粉体的体积平均粒径随粉体所过的目数增加而降低,与粗粉相比,茯苓微粉的体积平均粒径由139.12 μm降低至32.44 μm。5种茯苓粉末中,微粉Ⅲ的表面积平均粒径、体积平均粒径、D10、D50和D90均最低,比表面积最大。如图1所示,通过粒度分布测定,单峰模式下粗粉、细粉、微粉Ⅰ、微粉Ⅱ、微粉Ⅲ粒度分布均呈正态分布。
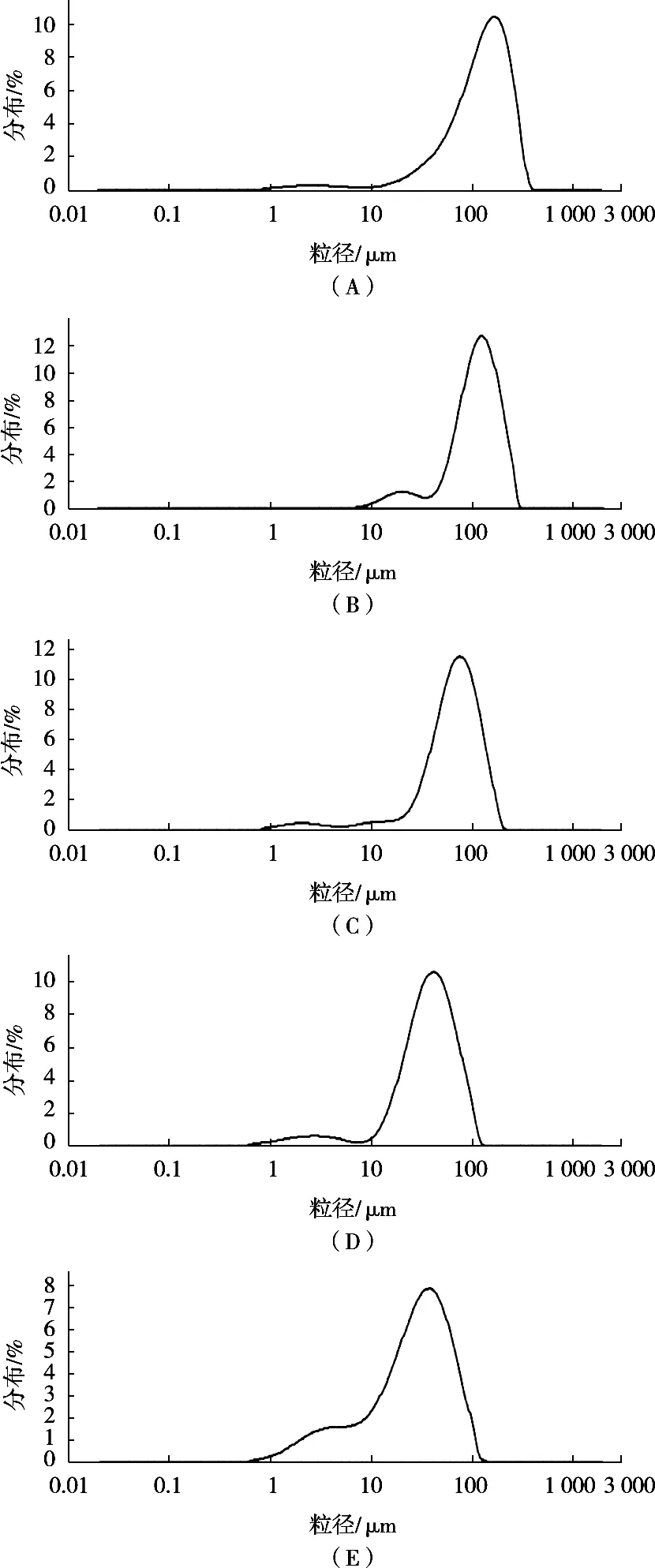
图1 茯苓不同目数粉体粒径分布图
2.3 茯苓不同粒径粉末的粉体学性质
粉体学性质是影响中药制剂生产过程的重要因素。休止角是评价粉体流动性的一个重要因素,也是衡量粉体黏着性的一个间接指标,粉末粒径减小,粉体表面粗糙,黏着性增大,则休止角也越大[21]。如表3所示,随着茯苓粉末粒径的减小,其休止角呈现增大趋势,粉体休止角由粗粉的27.68°增大至微粉Ⅲ的43.88°。堆密度也与粉末的流动性和黏着性有一定关系,粉末粒径减小,粉体间摩擦力增大,妨碍粉体堆积,流动性差[22]。如表3所示,随着茯苓粉末粒径的减小,其堆密度呈现减小趋势,粉体堆密度由粗粉的0.68 g/mL减小至微粉Ⅲ的0.32 g/mL。休止角和堆密度结果表明随着茯苓粉末粒径的减小,粉末流动性逐渐变差,微粉Ⅲ的流动性最差。润湿性是与固体制剂溶解性和崩解性有关的重要的物理性质,也是评价粉体加工性能的一个重要指标。在平行条件下,粉末完全润湿所需时间越短,则对应粉末的润湿性越好,而润湿性越好的粉末,加工性能越好,相关成分越易被人体吸收[23]。如表3所示,试验结果表明粗粉和细粉的完全润湿时间分别48 h和45 h,微粉Ⅰ、Ⅱ、Ⅲ的完全润湿时间为分别为27,24和23 h,微粉的润湿性要强于粗粉和细粉,这也表明微粉拥有更好的速溶性。此外,经过测定,5种粒径茯苓粉末的水分均小于18.0%,符合《中华人民共和国药典(2020年版)》标准[1],表明即使茯苓达到微粉状态,其吸湿性并未增加,不易发霉、变质,储存条不需要进一步严格。

表3 茯苓不同粒径粉末的粉体学性质
2.4 茯苓不同粒径粉末水溶性总多糖含量
以浓度(C)为横坐标,吸光度(A)为纵坐标绘制葡萄糖标准曲线,进行线性回归,回归方程为A=12.646C-0.026 2(线性范围0.01~0.1 mg/mL,r2=0.994 8)。仪器精密度SRSD为0.31%,表明精密度良好。重复性试验中,SRSD为0.28%,表明该方法重复性良好。样品稳定性试验中,SRSD为0.79%,表明该样品稳定性良好。加样回收率试验中,平均加样回收率为97.40%,SRSD为1.96%,表明该试验准确度高。由图2可知,在355 μm(45目,粗粉)~ 45 μm(325目,微粉Ⅱ)范围内,茯苓粉末水溶性总多糖含量随粉末粒径减少而稳步增加,而到38 μm(400目,微粉Ⅲ)时含量则不再增加,微粉Ⅱ的水溶性总多糖含量提取率最高,提示茯苓粉末粉碎到一定程度后,提取的有效成分水溶性总多糖的含量则趋于稳定,这也与文献报道的黄柏有效成分含量随目数变化的结果基本相一致[24]。
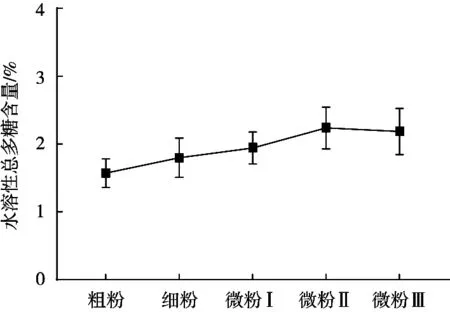
图2 茯苓不同粒径粉末水溶性多糖含量
2.5 茯苓不同粒径粉末体外抗氧化活性
由表4可知:茯苓5种不同粒径粉末水溶液均有一定的抗DPPH·自由基和ASBT·自由基能力,在355 μm(45目,粗粉)~ 45 μm(325目,微粉Ⅱ)范围内,茯苓粉末水溶性抗DPPH·自由基和ASBT·自由基能力随粉末粒径减少而稳步增加,而到38 μm(400目,微粉Ⅲ)时,抗DPPH·自由基和ASBT·自由基能力则不再增加,微粉Ⅱ的抗DPPH·自由基和ASBT·自由基能力,提示茯苓粉末粉碎到一定程度后,提取的有效成分水溶性总多糖的含量则趋于稳定。此外,茯苓5种不同粒径粉末水溶液的抗DPPH·自由基和ASBT·自由基能力与茯苓水溶性总多糖含量呈现同样的变化趋势,间接表明茯苓水溶性总多糖含量具有一定的抗DPPH·自由基和ASBT·自由基能力,可能是茯苓发挥抗氧化活性的主要成分,这也与前期的试验结果[19]及文献[25]报道的茯苓水溶性多糖具有显著的抗氧化能力结果相一致。

表4 茯苓不同粒径粉末体外抗氧化活性
3 结论
通过将茯苓粉碎后依次经过孔径为355 μm(45目),125 μm(120目),75 μm(200目),45 μm(325目)和38 μm(400目)的药典检验筛过筛分级,分别得到粗粉、细粉、微粉Ⅰ、微粉Ⅱ、微粉Ⅲ这5种不同粒径的茯苓粉末。粒径分布结果表明:不同粒径粉末的粒径大小随目数增加而降低,微粉Ⅲ的粒径最小;随着茯苓粉末粒径减小,粉体流动性逐渐降低,粗粉>细分>微粉Ⅰ>微粉Ⅱ>微粉Ⅲ;润湿性逐渐增加,粗粉<细分<微粉Ⅰ<微粉Ⅱ<微粉Ⅲ;茯苓水溶性总多糖提取率,粗粉<细分<微粉Ⅰ<微粉Ⅱ≈微粉Ⅲ;茯苓水溶液抗DPPH·自由基和ASBT·自由基能力,粗粉<细分<微粉Ⅰ<微粉Ⅱ≈微粉Ⅲ。粉体越细流动性越差,越不利于制剂生产;粉体润湿性越好,加工性能越好,相关成分越易被人体吸收。因此,综合中医临床用药和制药企业用药的实际情况,建议茯苓饮片粉碎时粉体过45 μm(325目,微粉Ⅱ)较为适宜。基于前期开展茯苓多糖在人工胃液、肠液中的降解及其在体肠吸收研究[26],后续可利用所建立的试验方法考察茯苓不同粒径粉末在胃肠中的吸收情况是否有差异,以进一步明确茯苓微粉的粉体优势。试验结果为茯苓破壁口服饮片或其他新型茯苓药品、功能性食品等开发提供技术支撑。

