基于倾向性匹配评分法评估宫颈扩张球囊对足月初产妇产程及母儿结局的影响
陈丽珊 古芳 李理 刘立群 黄莹
引产指在自然临产前通过药物或机械性装置等方法促宫颈成熟,从而发动产程,达到分娩的目的。引产术是产科常见的干预措施之一,在临床的使用率高达30%,在全球范围内呈上升趋势[1]。现认为引产成功的关键在于宫颈成熟度,在有明确引产指征但宫颈不成熟的情况下,应通过促宫颈成熟以提高引产的成功率。促宫颈成熟的理想方法应该是有效、安全且易于使用[2]。目前存在多种促宫颈成熟的方法,多项研究表明,使用前列腺素E1(PGE1) 或 PGE2 和宫颈扩张球囊(球囊)均可促宫颈成熟并诱导子宫收缩[3-6]。球囊能最大程度对宫颈内口施加压力并间接增加PG 的局部分泌,从而促进宫颈软化、成熟[7-8]。然 而,临床医师对于促宫颈成熟的最佳方法仍未达成共识[9]。为此,本研究使用倾向性匹配评分法(PSM)评估球囊对宫颈不成熟的足月单胎头位初产妇妊娠结局及新生儿结局的影响,为临床实践提供参考。
对象与方法
一、 研究对象
选择2020 年1 月至2022 年2 月期间在本院产科住院待产、宫颈不成熟、足月单胎头位的150例初产妇为研究对象。纳入标准:孕37~41+6周,单胎,头位,有引产指征而未临产的初产妇,宫颈 Bishop 评分 ≤6 分,胎心监护反应型,有阴道试产意愿。排除标准:合并生殖道感染者,软产道异常导致阴道分娩困难者,有子宫手术史者,前置胎盘或前置血管者,胎盘早剥者,明显头盆不称者,胎位异常者,胎儿经体重评估为巨大儿者,有严重基础疾病(如心力衰竭、肝衰竭、肾衰竭等)无法行阴道分娩者。本研究的引产指征为延期妊娠或过期妊娠、羊水过少、胎盘功能不佳、妊娠期糖尿病和妊娠期高血压疾病等。本研究方案经医院医学伦理委员会批准,2 组产妇及家属已签署知情同意书。
二、方 法
将研究对象分为放置球囊组(球囊组)60 例和未放置球囊组(非球囊组)90 例。球囊组予放置COOK 双球囊12 h,若12 h 后仍未临产,予拔除球囊并再次评估宫颈成熟度,然后予人工破膜,若30 min 后仍未临产,予2.5 U 缩宫素稀释于500 mL生理盐水中静脉滴注引产。非球囊组直接采用小剂量催产素静脉滴注引产(用法同球囊组)。记录2 组产妇的基本情况、产程和母儿结局。
三、统计学处理
采用SPSS 26.0 处理数据,PSM 扩展程序按照1∶1 匹配法,设置卡钳值0.02,匹配的资料变量为年龄、BMI 和分娩孕周。采用Shapiro-Wilk 法进行正态分布检验,符合正态分布的计量资料以表示,组间比较采用独立样本t 检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U 检验。计数资料以例(%)表示,组间比较采用χ2检验、连续性校正χ2检验或Fisher 确切概率法。P < 0.05 为差异有统计学意义。
结 果
一、2 组产妇在PSM 前后的基本情况比较
本研究经PSM 后55 对孕妇成功匹配,2 组孕妇匹配前后的基本情况见表1。

表1 2 组产妇在PSM 匹配前后的基本情况比较
二、PSM 后2 组产妇的妊娠及新生儿结局比较
球囊组的第一产程及总产程均比非球囊组缩短(P 均< 0.05),非球囊组新生儿出生体重较高(P < 0.05),2 组产妇的第二产程、第三产程、产后 24 h 出血量、新生儿1 min 阿普加评分、新生儿脐血pH比较差异均无统计学意义(P均> 0.05)。见表2。

表2 PSM 后2 组产妇的妊娠及新生儿结局比较
三、PSM 后2 组产妇的分娩方式比较
球囊组的阴道分娩率为78%(43/55)、剖宫产率为22%(12/55);非球囊组的阴道分娩率为80%(44/55)、剖宫产率为20%(11/55)。分娩方式组间比较差异无统计学意义(χ2= 0.055,P =0.815)。
四、PSM 后2 组母儿的不良妊娠结局比较
2 组的母体宫内感染、新生儿窒息的发生率及产后24 h 出血量比较差异均无统计学意义(P 均>0.05)。见表3。
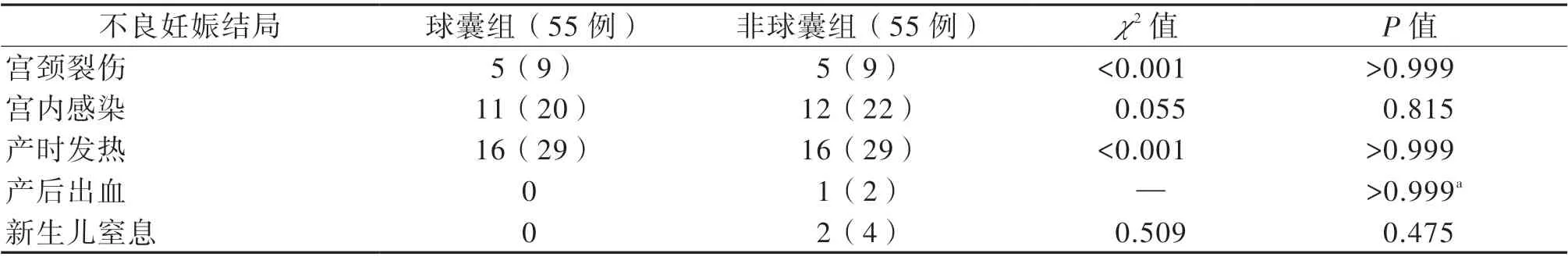
表3 PSM 后2 组母儿不良妊娠结局比较[例(%)]
讨 论
晚期妊娠引产旨在降低过期妊娠的发生率、减少母婴并发症及保护胎儿免受不利的宫内环境影响[10]。晚期妊娠引产成功的关键在于宫颈成熟度,宫颈成熟是指宫颈缩短、变软、变薄和扩张,是经阴道分娩的必备条件[1]。临床上常用的促宫颈成熟方法有药物和机械法,药物有缩宫素、米索前列醇及地诺前列酮,机械法有单球囊和COOK双球囊。既往研究表明药物引产可能增加产妇宫缩过强、子宫破裂,以及胎儿窘迫和新生儿窒息的风险[11-12]。药物引产的难点在于药物用量的控制,用量过多可导致宫缩过强,用量过低则不能达到满意的宫缩效果。有研究表明,使用COOK 双球囊引产在改善妊娠结局上优于缩宫素和米索前列醇[13-14]。另一研究显示,COOK 双球囊引产与地诺前列酮栓的促宫颈成熟效果、阴道分娩率及不良妊娠结局相近[15]。本研究显示, COOK 双球囊应用于宫颈不成熟的足月单胎头位初产妇的引产,可缩短产妇的第一产程及总产程,且未增加宫颈裂伤、宫内感染、产时发热、产后出血及新生儿窒息等母儿不良结局的风险。虽然直接使用小剂量缩宫素滴注引产的非球囊组的产时发热、新生儿窒息的发生率及产后24 h 出血量稍高于球囊组,但组间比较差异无统计学意义。本研究中2 组新生儿的体重比较差异有统计学意义,但2 组的分娩方式比较差异均无统计学意义,考虑2 组新生儿体重均在正常新生儿体重范围内,且与研究纳入样本量较少及试产过程中球囊组个别孕妇要求行剖宫产术终止妊娠有关。
理论上,球囊作为一种侵入性异物会增加宫内感染的风险,所以引产前要排除产妇存在生殖道炎症,避免病原体上行感染而发生产时或产褥期感染。但来自荟萃分析的有限数据并未显示促宫颈成熟的机械方法会增加宫内感染的风险[16]。本研究中,2 组患者的宫内感染发生率比较差异无统计学意义,与既往研究结果一致[17]。宫内感染的临床表现之一为产时发热(体温 ≥38 ℃),而产时发热不一定为宫内感染。产时发热的原因包括感染性和非感染性。在感染性原因中最常见的是绒毛膜羊膜炎,非感染性原因中最常见的是麻醉分娩镇痛。Vijayasree[18]研究显示,在引产和分娩过程中许多孕妇因宫内感染而行剖宫产术终止妊娠。本研究中,球囊组出现产时发热16 例,其中宫内感染11例,有6 例因宫内感染行剖宫产术终止妊娠。这表明宫内感染是球囊引产的危险因素。Ragusa 等[19]研究表明,大多数使用球囊的孕妇需要人工破膜,这增加了宫内感染的可能性。宫内感染与人工破膜间的关系尚需要进一步的研究证实。
本研究为回顾性分析,存在一定的局限性,虽然使用PSM 以调整2 组基础资料的差异,仍然存在混杂因素的影响。下一步笔者团队将考虑进行前瞻性队列研究,以验证球囊组与非球囊组产程、母儿结局的不同。
综上所述,球囊对于足月单胎头位的初产妇引产效果良好,且未增加剖宫产率及母儿不良结局,值得临床推广应用。

