介稳态高镁尾卤变温提取结晶硫酸镁的分离参数优化
张 寻,李琳琳,成怀刚,2,吴海滨*
(1.山西大学 资源与环境工程研究所,山西 太原 030032;2.青海大学 化工学院,青海 西宁 810016)
我国盐湖种类多、数量大,蕴藏有丰富的钾、钠、镁、锂等资源,为我国农业、环保、新能源、有色金属材料等产业提供了有力保障。尤其是在农业方面,2021年我国对钾肥的需求量已超过1 800万t。随着钾肥的大量提取,副产了可以二次回收利用的尾卤镁资源[1-4]。提取钾肥后的尾卤是以MgCl2为主、NaCl/KCl组分为次的共饱和溶液,在热力学上属于零自由度体系,存在回收困难、经济效益低等问题。从热力学角度分析,对于零自由度体系而言,通过引入新的自由度是激发新的相分离的有效策略之一,也是盐湖化工生产中的一条可行途径。
提钾后的尾卤中MgCl2浓度很高、粘度大,针对这些特点,有关研究人员研发出一系列回收利用提钾尾卤中镁资源的技术方法,如有研究将MgCl2转变为广泛应用于肥料、制革、医学等行业的化工原料MgSO4[5-7],即通过复分解反应打破原有零自由度体系的分离限制。侯殿保等[8]把泻利盐矿、提钾尾卤作为原料,通过中温溶浸、冷却结晶的方法制取工业级MgSO4,冷冻结晶法的收率达到80.25%。牛韩根等[9]把MgCl2、NaSO4当作原料,采用分解转化—冷却结晶法制取MgSO4·7H2O,其粗品纯度达到85.3%、收率达到83.2%。谈霞等[10]以提钾后的尾盐矿为原料,通过转化、浮选法的工艺生产硫酸钾镁肥,在最佳条件下尾盐中的硫酸钾镁的回收率超过了55%。魏廷祥等[11]将以兑卤方式在得到的卤水加入粗芒硝,采用冷析的方法制取MgSO4。王朝乾等[12]以制盐母液为原料,兑入一定比例的MgCl2废液,使MgSO4收率提高到50%,粗镁质量提高到95%以上。吴辉等[13]把盐田泻利盐矿和卤水作为原料,采用兑卤、热溶、结晶的方法,制备MgSO4,得到纯度99%以上的MgSO4。高姣丽等[14]采用兑卤法、非平衡动态降温结晶工艺,可以制备出纯度较高的MgSO4·7H2O。
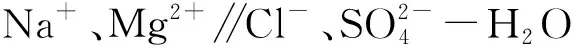
将富含MgCl2的稳态提钾尾卤转化为介稳态的MgSO4饱和溶液[18],可保证在变温分离过程中得到高纯度MgSO4结晶盐[19]。在此基础上,文章拟重点探讨变温工艺的过程规律及其影响因素,针对精准脱镁过程中相态变化及降温条件问题,根据水盐体系相图数据[20],通过控制卤水的介稳态,考察提钾尾卤在不同条件下晶体的纯度变化规律及机理,优化工艺并为高品质MgSO4的规模化制备提供参考。
1 实验材料和方法
1.1 材料
氯化钠(NaCl)、七水硫酸镁(MgSO4·7H2O)、十水硫酸钠(NaSO4·10H2O)、六水氯化镁(MgCl2·6H2O)均来自中国国药集团有限公司,所用的实验药品均为分析纯;实验用水为MiLiQ超纯水,电导率小于18.2 MΩ·cm。
1.2 分析测试仪器

1.3 模拟转化提钾尾卤非平衡动态降温结晶工艺

在降温结晶过程中控制搅拌转速为60 r/min,使用的反应容器是500 mL的烧杯,搅拌转子尺寸为Φ10 mm×25 mm。记录饱和卤水的温度实时变化和不同时刻的结晶情况,并定时取样观察晶体的形貌分析晶体纯度。
2 实验结果与讨论
2.1 提钾尾卤的冷却条件
提钾尾卤的降温速率受冷却条件的影响,图1为不同条件下转化尾卤溶液的降温速率。由图1可知,静置条件下降温速率缓慢,室温、搅拌转速为60 r/min的条件下降温速率有所增加,23 ℃的常温水浴降温、搅拌转速为0的条件下快速下降。
溶液的过饱和度促使溶质发生相变,降温速率快慢决定过饱和度变化速率,同时影响晶体析出及其生长速率[21-23]。针对提钾尾卤,在静置条件下,从60 ℃降温至30 ℃,大约需要214 min,降温速率为-0.14 ℃/min,整体降温速率较缓慢,散热受干扰,溶液温度持续稳定的下降。在室温、搅拌转速为60 r/min的条件下,从60 ℃降温至30 ℃,大约需要214 min,降温速率为-0.14 ℃/min,与降温速率为-0.14 ℃/min、搅拌转速为0时的总体降温时间、降温速率都相近;但是在60 ℃到45 ℃的前半段温度下降区间,显然增加搅拌还是起到了强化作用,温度下降的比无搅拌的实验要快,因为搅拌引起了溶液内部的热对流,对流散热比热传导更快,整个散热过程更加均匀。在后半段45 ℃到30 ℃的降温区间,搅拌起到的作用并不大,降温速率变得缓慢。
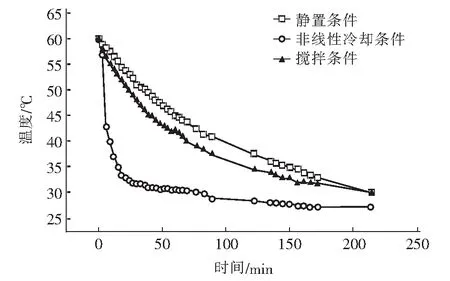
图1 不同条件下模拟转化尾卤溶液的降温速率Fig.1 The cooling rate of simulated transformed tail brine solution under different conditions
在23 ℃的常温水浴降温、搅拌转速为0的条件下,从60 ℃降温至30 ℃,大约需要82 min,温度下降得非常快,降温速率为-2.73 ℃/min。与之前两种降温条件相比,降温速率是静置降温结晶实验、搅拌降温结晶实验的20倍。这是因为热量从高温物体向低温物体传递,转化尾卤溶液的温度高于常温水浴的温度,热量快速传递使得转化尾卤溶液的温度急剧下降,温度差越大,降温速率越大。
2.2 结晶过程与结晶形貌
结晶是在化工制药和电子工业中从溶液和盐的混合物中获得盐的一个重要的分离和纯化过程[24],且盐湖卤水提取钾肥后形成的尾卤废液含有大量的Mg2+、Cl-、Na+等离子[25],对于提钾尾卤,在相同降温速率不同搅拌速度下,结晶过程不同。图2是相同降温速率、不同搅拌转速下的结晶过程,提钾尾卤在不平衡状态下不发生明显变化的时间段内发生结晶完成“一次成核”,过早析出的针状晶体当作母晶,为其他晶核的形成提供了成核附着点位,促进“二次成核”的发生,把依靠附着在母晶上析出的过程称为“二次成核”;搅拌可以缩短“一次成核”和“二次成核”的持续时间,进行压缩结晶。

图2 降温速率为-0.14 ℃/min,不同转速时结晶过程Fig.2 The cooling rate is -0.14 ℃/min, and the crystallization process is at different speeds
溶液的过饱和度驱动溶质由液相变为固相,降温速率快慢和搅拌转速决定过饱和度变化速率,从而影响晶核数量及晶体生长速率[26-28]。针对提钾尾卤,考察-0.14 ℃/min无搅拌、-0.14 ℃/min以60 r/min搅拌、-2.73 ℃/min无搅拌这3种不同的降温速率和搅拌下其晶体的析出和形貌变化。图3为不同降温速率、不同搅拌转速下提钾尾卤的结晶盐形貌。由图3可知,温度从60 ℃降温至30 ℃的过程中没有结晶盐析出。在图(3)a中,静置降温约4.5 h,开始一次成核有细长的针状晶体出现,以“一次成核”阶段中过早析出的针状晶体当作母晶,为其他晶核的形成提供了成核附着点位,促进二次成核的发生;接着开始二次成核,其晶体生长的时间大约为2 h,过程中有大量结晶盐快速析出,这个过程中结晶盐的形貌与结晶量并没有太大变化。在图3(b)中,搅拌降温约4.2 h,开始有结晶盐出现,溶液在不平衡状态下不发生明显变化的时间为4.2 h,进入“二次成核”阶段,整个烧杯内出现了大量细碎的结晶盐,“一次成核”“二次成核”晶体生长阶段大约持续了0.5 h,最后结晶过程中结晶盐的形貌与结晶量仍没有太大变化。在图3(c)中,静置降温约4.8 h,开始有细长的针状晶体出现,溶液在不平衡状态下不发生明显变化的时间约为4.8 h。该现象与图3(a)结晶过程大致相同,结晶过程中结晶盐的形貌与结晶量仍然没有太大变化。
同一降温速率下,从图3(a)中整个结晶过程共用了6.5 h,图3(b)中搅拌使得“一次成核”过程中形成的晶核太碎,未达到肉眼观察的大小,进入“二次成核”阶段,杯内出现了大量细碎的结晶盐,整个结晶过程只用了4.7 h,大约缩短了1.8 h。对于非平衡动态降温结晶实验,增加搅拌后析出的固体结晶镁盐呈细砂状,并不具备良好的晶型,推测是因为搅拌加快MgSO4晶体在溶液中的移动,从而不利于晶体间的粘合形成大体积的结晶。

图3 不同条件下析出的结晶盐形貌Fig.3 The morphology of the precipitated crystalline salt under different conditions
2.3 液—固相离子变化规律
不同工艺条件对降温速率影响不同,对MgSO4晶纯度也有一定影响。图4为-0.14 ℃/min无搅拌、-0.14 ℃/min以60 r/min搅拌、-2.73 ℃/min无搅拌三种工艺条件下结晶硫酸盐的含量变化。实时监控溶液中的结晶情况,发现与MgSO4—H2O体系、MgSO4—NaCl—H2O体系的结晶情况不同,在60 ℃降温至30 ℃的过程中,并没有结晶盐析出,结晶盐的析出跟温度的下降并没有关系,因此在新的体系里,改变了固相样品按照温度点取样的方法,从结晶时间出发。


图4 不同条件下析出的结晶盐中离子的含量变化Fig.4 Changes in the content of ions in the solid-phase crystalline salt precipitated under different conditions
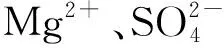

2.4 结晶盐晶型及纯度分析(图5、图6)
由上述分析可知,镁盐析出跟结晶时间有关,因此在新体系里,改变固相样品按照温度点取样的方法,从结晶时间出发。文章在-0.14 ℃/min无搅拌、-0.14 ℃/min以60 r/min搅拌、-2.73 ℃/min无搅拌三种工艺条件下,分别选取了6 h、10 h、17.5 h、22 h、32 h析出的结晶镁盐,经过烘箱60 ℃烘干,研磨成粉末,用X射线晶体衍射仪(XRD)对样品粉末进行定性分析,分析其物质成分及结晶水。
从图5看出,从对三种不同工艺条件下析出的结晶盐定性分析来看,在降温速率为-0.14 ℃/min、搅拌转速为0的条件下析出的结晶盐主要组成是MgSO4·5H2O,在降温速率为-0.14 ℃/min,搅拌转速为60 r/min的条件下析出的结晶盐主要组成也是MgSO4·5H2O,而在降温速率为-2.73 ℃/min、搅拌转速为0的条件下析出的结晶盐主要组成是MgSO4·4H2O,这种现象证实了降温速率确实会影响MgSO4与结晶水的结合:降温速率越快,MgSO4与结晶水的结合能力越弱,越容易形成含有低结晶水分子的镁盐;反之,如果降温速率越慢,MgSO4与结晶水的结合能力越强,越容易形成含有高结晶水分子的镁盐。实验表明,增加搅拌这个工艺,对MgSO4与结晶水的结合没有影响。
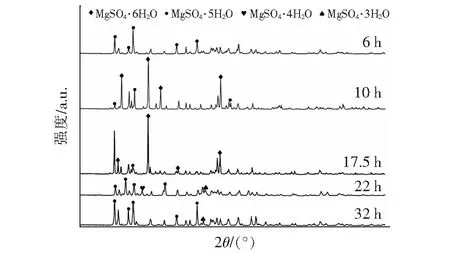
图5 不同条件下结晶镁盐的XRD分析Fig.5 XRD analysis of crystalline magnesium salt under different conditions
针对MgSO4晶体在三种不同工艺条件下析出的纯度问题,将各时刻析出的结晶粉末溶解于纯水,测出各离子的含量,用H表示,则硫酸镁盐的纯度=100%—H(Na+)—H(Cl-)。
由图6可看出,在降温速率为-0.14 ℃/min,搅拌转速为0的条件下,析出的结晶镁盐纯度随时间的变化呈现出先上升然后下降的趋势,并且在24 h时达到了最高值99.118%,镁盐纯度从6 h时的97.99%下降至32 h时的98.74%。在降温速率为-0.14 ℃/min,搅拌转速为60 r/min的条件下,析出的结晶镁盐纯度随时间的变化呈现出先上升然后下降的趋势,镁盐纯度从4.5 h时的98.21%降至6 h时的97.83%,再逐渐上升至20 h时的99.15%,在20 h时达到最高值,最后镁盐纯度开始下降,直至32 h时的纯度为98.84%。在降温速率为-2.73 ℃/min,搅拌转速为0的条件下,析出的结晶镁盐纯度随时间变化大概呈现出先上升后下降趋势,只有轻微幅度的波动。镁盐纯度从6 h时的94.36%下降至18 h时的93.16%,再突然上升至20 h时的95.46%,在20 h时达到最高值,最后镁盐纯度开始下降,直至32 h时的纯度为93.69%。

图6 不同条件下结晶镁盐的纯度分析Fig.6 Purity analysis of crystalline magnesium salt under different conditions
提钾尾卤中含有大量MgCl2,加入Na2SO4升温变为MgSO4后,可形成过饱和介稳态、粘度降低。上述过程发生相态转换和高温除钠,得到高纯硫酸镁,高纯硫酸镁在高温介稳态通过三种不同工艺降温至低温介稳态析出结晶镁盐。在降温过程中可知,增加搅拌能够加大降温速率,为晶体的析出提供驱动力,同时对MgSO4与结晶水的结合没有影响。降温速率为-0.14 ℃/min,搅拌转速为60 r/min的条件下,析出的结晶镁盐纯度为97.83%~99.15%,而且结晶时间4.7 h,实现了老卤中镁盐的精准分离,得到高纯硫酸镁。
3 结论
针对提钾尾卤中镁资源不易分离的问题,文章开展了盐湖提钾尾卤在不同工艺条件下硫酸镁晶体的精准分离及纯化研究。通过相态转换将提钾尾卤转变为介稳态下易分离的过饱和MgSO4尾卤,研究了降温速率为-0.14 ℃/min时静态分离、-0.14 ℃/min时搅拌分离、-2.73 ℃/min时静态分离等三种工艺条件下结晶硫酸镁的分离效果。结果表明,对于模拟提钾尾卤转化体系,降温速率为-0.14 ℃/min时,MgSO4与结晶水的结合能力强,易生成MgSO4·5H2O等含有较多结晶水分子的水合镁盐,Cl-的析出量越小;降温速率为-2.73 ℃/min时,MgSO4与结晶水的结合能力弱,易生成MgSO4·4H2O等含较少结晶水分子的镁盐,Cl-的析出量大,表明转化尾卤的低速降温有利于结晶镁盐的纯化分离。-0.14 ℃/min静置和搅拌条件下得到的结晶盐纯度均在97%以上,增加搅拌对结晶纯度没有影响;-2.73 ℃/min静态条件下,结晶镁盐纯度为93.16%~ 95.46%,说明缓慢的降温速率更有利于分离镁盐。增加搅拌条件时析出的结晶镁盐不具有良好的晶型、呈细砂状,但是增加搅拌可以为镁盐的结晶析出提供动力,结晶时间缩短了1.8 h。通过以上研究可知与等温蒸发分离工艺相比,采用相态转换的变温分离工艺能够实现MgSO4的精准分离,得到高纯结晶硫酸镁产品,其形貌特征则受到降温速率、搅拌等因素的影响,据此可以选择-0.14 ℃/min时静态分离的工艺条件以获得晶型较好的高纯度结晶镁盐产品,也可在该降温速率下使用搅拌手段加快结晶进程。

