藜芦有效成分提取工艺优化*
张蒙蒙 ,魏淑婕 ,沈家圆 ,欧阳慧子 ,常艳旭 ,何俊
(1.天津中医药大学,组分中药国家重点实验室,天津 301617;2.天津中医药大学第一附属医院,天津 300193)
藜芦(Veratrum nigrum L.)又名山葱、葱葵、丰芦等[1],是中国传统的中草药,富含生物碱、黄酮、有机酸等天然活性成分,具有降血压、抗肿瘤、抗氧化、抗炎镇痛等作用[2-8]。甾体生物碱被认为是藜芦的活性物质基础,以芥芬胺、藜芦胺为代表成分[9-11]。芥芬胺为介藜芦型生物碱,藜芦胺为藜芦胺型生物碱,均具备 C-nor-D-homo-[14(13→12)-abeo]环系,A、B、D均为六元环,C为五元环,其相似的化学结构表征两者可能具有相同的药理活性[12-18]。近年来对藜芦的提取分离、含量测定、配伍及药理作用的研究较多[19-20],提取工艺的讨论较为少见。文章对藜芦提取工艺进行优化研究,研究过程中引入了统计分析软件(JMP)实验设计模型,以验证正交实验数据的可行性与有效性。JMP软件是一种交互式可视化统计发现软件,其在医药行业中的用途有实验设计和数据的统计分析。工艺优化需考察多种因素及水平对工艺参数的影响,因此科学合理地设计实验、筛选关键影响因素对提供全面可靠的数据是十分重要的[21-23]。研究以藜芦中芥芬胺和藜芦胺的含量作为评价指标,采用单因素实验、正交实验及JMP软件实验设计模型考察乙醇体积分数、液料比、提取时间、提取次数4种因素对主要活性成分提取的影响,确定最佳提取工艺。
1 材料
1.1 仪器 Agilent1260高效液相色谱仪(美国Agilent公司);AX 205型十万分之一(瑞士Mettler Toledo公司)天平;Milli-Q超纯水制备仪(Millipore公司);3K15型高速离心机(美国sigma公司);XW-80A型涡旋混合器(上海沪西分析仪器厂)。
1.2 试药 甲醇、乙腈均为色谱纯,购自美国Fisher公司;甲酸为色谱纯,购自美国ROE公司;95%乙醇为分析纯,购自天津市康科德科技有限公司;对照品芥芬胺(批号:DST190407-087,HPLC≥98%)、藜芦胺(批号:DST190108-024,HPLC≥99%)由成都德思特生物技术有限公司提供;藜芦购自安徽亳州药材市场。
2 方法与结果
2.1 芥芬胺、藜芦胺含量测定
2.1.1 色谱条件 色谱柱:Agilent ZORBAX SBC18柱(4.6 mm×100 mm,1.6 μm);流动相:A 相 0.1%甲酸水,B 相乙腈;梯度洗脱:0~20 min,15%~35%B;20~25 min,35%~37%B;25~28 min,37%~95%B。检测波长:0~21.8 min,254 nm;21.8~28 min,205 nm。流速:0.5 mL/min,柱温:30℃;进样量:5 μL。结果见图1。

图1 对照品(A)与样品(B)色谱图Fig.1 Chromatograms of reference substance(A)and sample(B)
2.1.2 对照品溶液的制备 精密称取芥芬胺和藜芦胺对照品适量至5 mL的容量瓶中,分别以甲醇溶解并定容至刻度,配制成浓度为1 mg/mL的对照品溶液,4℃冰箱储存备用。
2.1.3 供试品溶液的制备 精密称取藜芦粗粉(过2号筛)10 g,加入80%乙醇150 mL,加热回流提取2 h,回流提取2次,两次药液合并,4℃冰箱储存备用。
2.1.4 线性关系考察 精确量取“2.1.2”项下对照品溶液适量,以甲醇稀释至分别含有芥芬胺和藜芦胺500μg/mL的混合对照溶液,将此溶液用甲醇依次稀释 2、2.5、2、2、2.5、2、2、5 倍得 9 个不同浓度的溶液,按“2.1.1”项下色谱条件,以待测物峰面积(Y)为纵坐标,待测物的浓度(X)为横坐标,得芥芬胺峰、藜芦胺面积与浓度的线性关系分别为Y=23.102X-15.653,r2=0.999 1,0.5~500 μg/mL;Y=70.769X+139.630,r2=0.9992,0.5~500μg/mL。表明各成分线性关系良好。
2.1.5 精密度实验 精密吸取“2.1.4”项下混合对照品溶液适量,以甲醇稀释5倍后按“2.1.1”项下色谱条件测定连续进样测定6次,相对标准差(RSD)值分别为3.9%和2.2%,表明仪器精密度良好。
2.1.6 稳定性实验 精密吸取“2.1.3”项下供试品溶液适量,按“2.1.1”项下方法于 0、3、6、12、24 h 测定芥芬胺和藜芦胺峰面积,24 h内RSD值分别为1.1%和1.0%,表明供试品溶液在24h内稳定性良好。
2.1.7 重复性实验 精密称取藜芦粗粉6份,每份10 g,以“2.1.3”项下方法平行制备供试品溶液,按“2.1.1”项下方法测定芥芬胺和藜芦胺的含量,RSD值分别为2.8%和1.4%,表明该方法重复性良好。
2.1.8 加样回收率 精密称取藜芦粗粉6份,每份5 g,分别准确加入一定量的芥芬胺和藜芦胺对照品溶液,再加入80%乙醇至150 mL,按“2.1.3”项下方法制备并测定,计算芥芬胺和藜芦胺平均回收率分别为103.0%和98.8%,RSD为1.5%和2.7%。
2.2 单因素实验
2.2.1 乙醇体积分数 精密称取藜芦样品10 g,共4份,分别加入体积分数为50%、60%、70%、80%的乙醇,按“2.1.3”项下方法制备供试品溶液,以“2.1.1”项下色谱条件测定芥芬胺和藜芦胺含量。结果见图2 A,乙醇体积分数为60%时,芥芬胺含量最高,体积分数为70%时,藜芦胺含量最高,且芥芬胺含量未明显下降,故确定乙醇体积分数为60%、70%、80%。
2.2.2 液料比 精密称取藜芦样品10 g,共4份,分别加入提取溶液使得液料比为 5∶1、10∶1、15∶1、20∶1,按“2.1.3”项下方法制备供试品溶液,以“2.1.1”项下色谱条件测定芥芬胺和藜芦胺含量。结果见图2 B,液料比为20∶1时,藜芦胺含量最高,芥芬胺含量较高,且两者的含量总和最高,故确定液料比为10∶1、15∶1、20∶1。
2.2.3 提取时间 精密称取藜芦样品10 g,共4份,提取时间分别为 1 h、1.5 h、2 h、2.5 h,按“2.1.3”项下方法制备供试品溶液,以“2.1.1”项下色谱条件测定芥芬胺和藜芦胺含量。结果见图2 C,提取时间为1 h时芥芬胺与藜芦胺的提取含量总和最高,故确定提取时间为 1 h、1.5 h、2 h。
2.2.4 提取次数 精密称取藜芦样品10 g,共3份,提取次数分别为 1、2、3次,按“2.1.3”项下方法制备供试品溶液,测定芥芬胺和藜芦胺含量。结果见图2D,提取次数为3次时,芥芬胺和藜芦胺的提取效果最好,故确定提取次数为1、2、3次。

图2 乙醇体积分数(A)、液料比(B)、提取时间(C)和提取次数(D)对提取效果的影响Fig.2 Effects of ethanol volume fraction(A),liquid-to-solid ratio(B),extraction time(C)and extraction times(D)on extraction effect
2.3 建立JMP实验设计模型
2.3.1 模型设计 基于单因素实验结果,采用JMP软件4因素3水平的定制设计筛选藜芦芥芬胺和藜芦胺含量的影响因素,因素水平设置见表1。
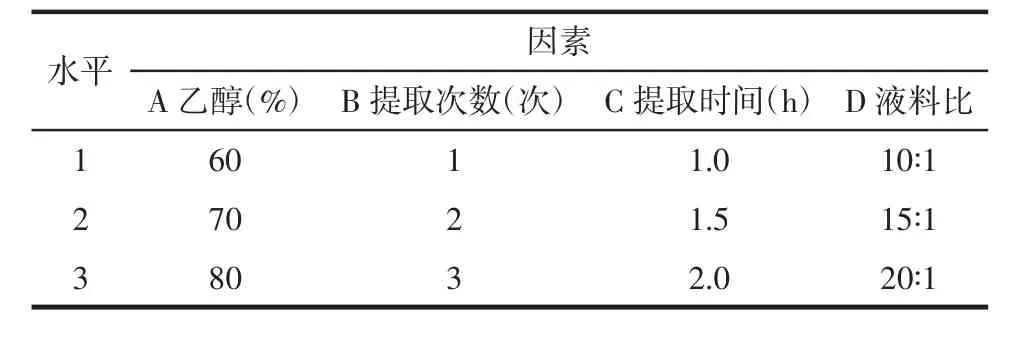
表1 定制设计实验因素水平值Tab.1 Values of different factors investigated with custom design experiment
2.3.2 预测结果 JMP软件设计出具有数据分析意义的实验列表,并对响应值进行模拟,模拟结果见表2。结果表明,该模型预测A1B3C3D3实验条件下响应值最高,即乙醇体积分数60%,提取次数3次,提取时间2 h,液料比20∶1工艺条件下提取的芥芬胺与藜芦胺总量最高。
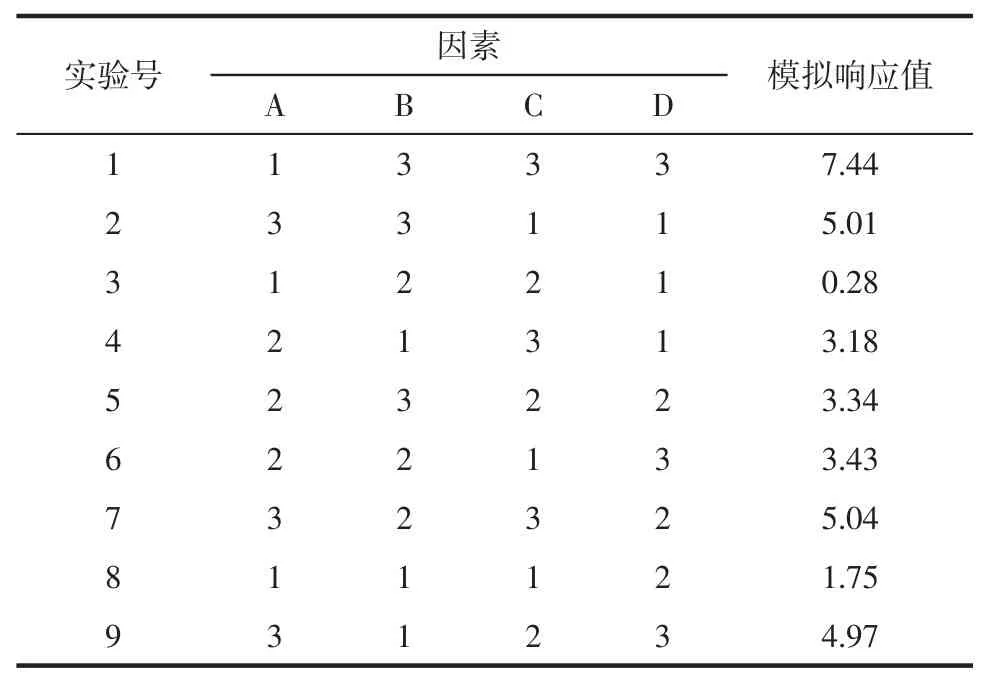
表2 实验条件表及模拟响应值Tab.2 Conditions in the experiments and values of simulated response
2.3.3 数据处理及模型拟合 应用JMP软件对表2中的结果进行最小二乘法拟合分析,根据P值找出影响响应值的关键因素,P<0.05为差异有统计学意义,结果见表3。由表3可知乙醇体积分数、提取次数、提取时间、液料比P值均大于0.05,表明4种因素均对提取工艺有影响,但并非影响提取含量的关键因素,模型预测结果需进一步验证。验设计模型所得结果一致。

表3 提取工艺筛选拟合分析效应汇总Tab.3 Summary of effects of fitting analysis in extraction process screening
极差 RB>RC>RA>RD,即影响藜芦提取物中芥芬胺和藜芦胺含量的主次因素为提取次数>提取时
2.4 正交实验 根据单因素实验结果,在乙醇体积分数、液料比、提取时间、提取次数4因素下分别设置3水平,以芥芬胺和藜芦胺含量为考察指标进行L9(34)正交实验,确定最佳提取工艺条件。因素水平设计见表1。按照表1进行4因素3水平正交实验,实验结果见表4。提取工艺最优参数与JMP软件实间>乙醇浓度>液料比,其结果与方差分析结果一致,见表5。根据均值进行分析可得出藜芦提取的最佳工艺条件为A2B3C3D2,即乙醇体积分数70%,提取次数 3次,提取时间 2 h,液料比15∶1。
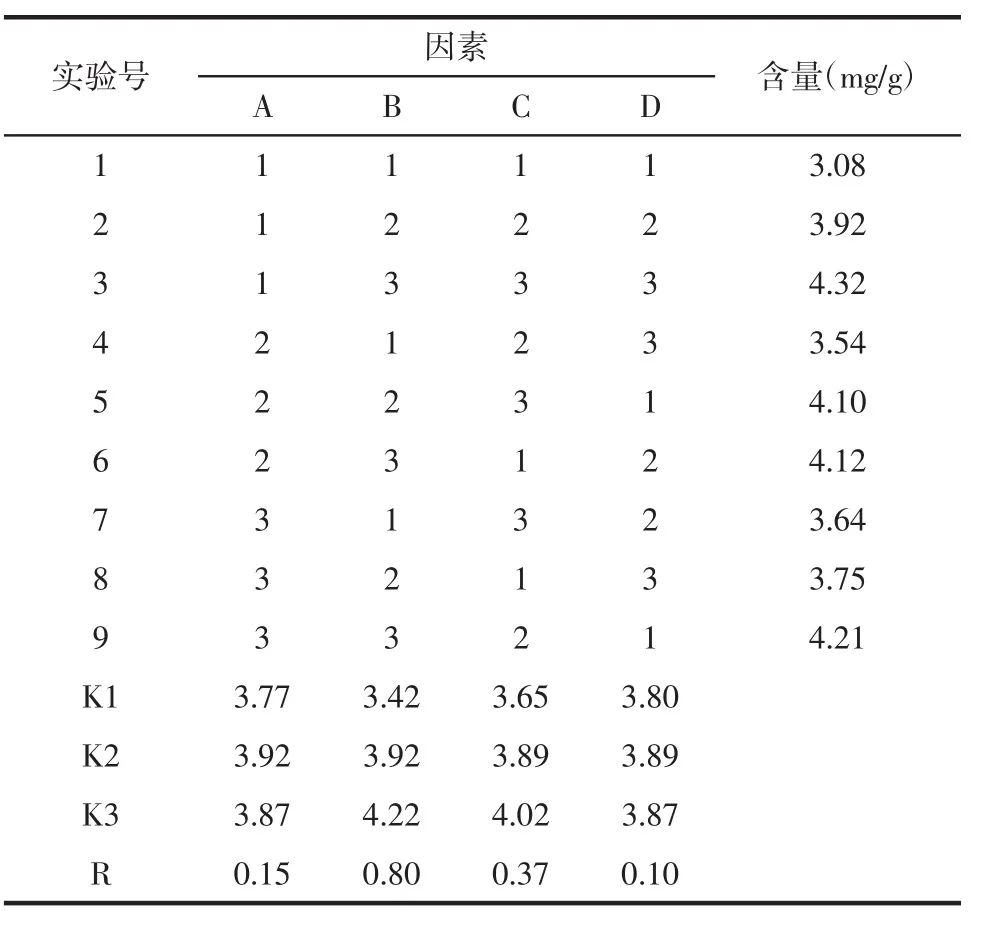
表4 正交实验结果Tab.4 Results of orthogonal experimental
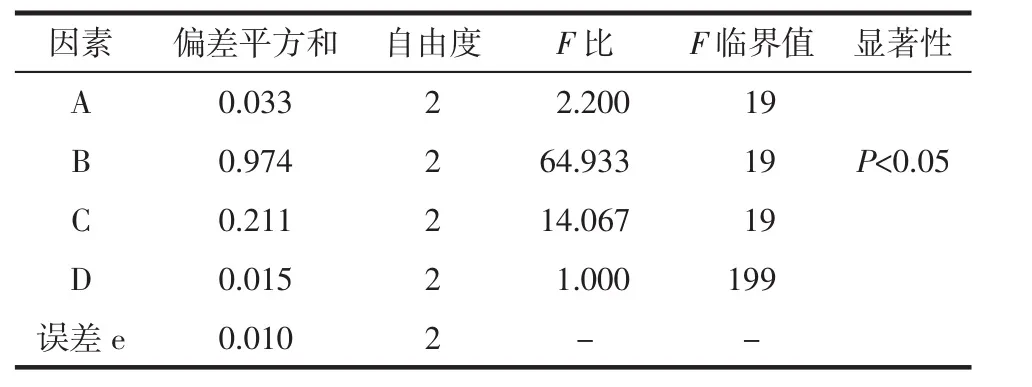
表5 正交实验结果方差分析Tab.5 Analysis of variance of orthogonal experiment results
2.5 验证实验 精密称取藜芦样品3份,每份10 g,置入250mL圆底烧瓶中,按优化工艺进行验证实验,即加入70%乙醇150 mL,回流提取3次,每次2 h,合并滤液后放置室温,补足失重,取上清液经0.45 μm有机微孔滤膜过滤后按“2.1.1”项下色谱条件测定,结果显示芥芬胺和藜芦胺含量的平均值分别为1.60、2.98 mg/g,RSD 分别为 1.0%、1.1%。结果表明该工艺稳定可行。
2.6 等高线图分析 采用JMP软件对正交实验结果以标准最小二乘法回归分析,分析结果见表6,参数估计值见表7,模型与正交实验方差分析结果一致,表明正交实验结果真实有效[23]。利用JMP软件在完成回归方程模型的基础上,借助等高线图直观反映各因素变化对考察指标的影响情况。本研究4种因素两两交互作用对芥芬胺、藜芦胺提取总含量的交互影响情况如图3所示。等高线图将变量描绘在二维图表中,横纵坐标分别代表各自变量,等高线颜色指示含量与该关系的符合程度。图3中显示本研究中各因素两两之间的相关性较弱,当其中1项变化时,另一项并不会随之变化[24],该结论提示正交实验结果有效,所确定工艺为最优提取工艺。

图3 各因素对芥芬胺、藜芦胺提取总含量的交互影响Fig.3 Interaction effects of various factors on the total content of Jervine and Veratramine extracted

表6 模型方差分析结果Tab.6 Outcomes of model by analysis of variance

表7 模型参数估计值Tab.7 Estimated values of model parameters
3 讨论
藜芦是中国传统中药,其化学成分复杂,包括生物碱类、黄酮类、二萜类、茋类等,具有多种药效[2-8]。芥芬胺与藜芦胺为藜芦中主要生物碱型化合物,具有阻断声波刺猬(Shh)信号通路[25]、信号转导抑制作用,是藜芦发挥药效作用的物质基础。
常用的生物碱提取方法有酸水提取法、亲脂性有机溶剂提取法、醇类溶剂提取法、超声提取法、酶提取法等。由于酸水提取法腐蚀性和成盐损耗大、亲脂性有机溶剂毒性高、超声或酶提取法造价高等缺陷,尚未广泛应用于大规模生产,乙醇提取法具有工艺简单、经济便捷、效率高等优点广受厂家青睐,因此本实验选用乙醇提取法。
为降低药效成分在生产过程中的损耗、优化提取效率、增强药效,实验在单因素控制条件下,共考察了影响芥芬胺和藜芦胺提取的4个因素:乙醇体积分数、提取时间、提取次数、液料比。同时分别设置了3水平,进行正交实验。根据正交实验结果得知,工艺为乙醇体积分数为70%,液料比为15∶1,提取3次,每次2 h,芥芬胺与藜芦胺含量最高,可达1.60、2.98 mg/g。同样可由表中数据得知,影响藜芦提取物中含量的主次因素为提取次数>提取时间>乙醇浓度>液料比。运用JMP软件定制设计实验模型,并对正交实验结果以标准最小二乘法回归分析,模型结果与正交实验结果一致,表明正交实验结果真实有效。同时在此基础上,借助等高线图直观反映各因素变化对考察指标的影响情况,全面立体地筛选最佳提取工艺。实验提取得到的芥芬胺与藜芦胺含量较高,工艺稳定,可为藜芦的进一步开发研究提供理论依据。