草莓病害拮抗细菌的筛选及其对草莓褐色叶斑病的防效
王卓妮 覃艮红 王 丽 侯 珲 袁洪波 周厚成 巩文峰 涂洪涛*
(1 中国农业科学院郑州果树研究所,河南郑州 450009;2 西藏农牧学院,西藏林芝 860000)
草莓(Fragaria ananassaDuch.)是一种重要的浆果类作物,也是一种重要的商业水果。其果肉香甜多汁,颜色鲜亮,含有大量矿物质和维生素,营养价值高,除鲜食外还被加工为各种食品(雷家军,2001)。近年来,随着我国草莓种植面积和总产量逐年增加,随之而来的草莓病害也危害到草莓产业的发展(占卫国,2010)。草莓多为温室种植,高温高湿环境及重茬现象导致草莓病害频发(花秀凤 等,2021;黄倩茹 等,2021)。目前草莓最为主要的病害有由链格孢菌(Alternaria alternate)等引起的根腐病,由灰葡萄孢菌(Botrytis cinerea)引起的灰霉病,由羽衣草单囊壳(Sphaerothecaaphanis)引起的白粉病和由尖孢镰刀菌(Fusarium oxysporum)等引起的枯萎病。草莓褐色叶斑病是我国近几年出现的一种新的真菌病害,严重时能够导致绝产,给莓农造成极大经济损失。
当前,草莓病害主要通过化学药剂防治,但长期大量使用化学农药易导致草莓食用安全、环境污染、病原菌抗药性增强等问题,生产上亟需探索新的防治技术。生物防治因具有安全、低毒、高效等特点,逐渐成为替代化学防治的重要手段。目前,虽然已有一些草莓病害广谱拮抗菌株的研究报道(李秀明,2013;陈娟 等,2015;尹大芳,2015;雷白时 等,2016;Niu et al.,2020),但可供选择的菌株资源仍相对较少,仍需大量筛选及鉴定草莓病害广谱、高效拮抗菌株。因此,本试验对草莓内生细菌及根际细菌进行分离和筛选,以期获得对草莓病害具有广谱、高效拮抗活性的菌株,为草莓病害的生物防治提供新菌种资源。
1 材料与方法
1.1 供试材料
供试草莓品种为香野,种植于中国农业科学院郑州果树所草莓试验棚,植株长势良好,分离选取外观健康的植株,并分离根际土。
供试病原菌为草莓褐色叶斑病病原菌(Pilidium concavum)、灰葡萄孢菌(B.cinerea)、尖孢镰刀菌(F.oxysporum)、链格孢菌(A.alternate),均由中国农业科学院郑州果树研究所实验基地分离保存。
供试营养琼脂培养基(NA):牛肉浸膏1.0 g ·L-1,酵母膏2.0 g·L-1,蛋白胨5.0 g·L-1,氯化钠5.0 g·L-1,琼脂粉15.0 g·L-1,pH 值为7.2。马铃薯葡萄糖琼脂培养基(PDA):马铃薯浸粉6.0 g·L-1,葡萄糖20.0 g·L-1,琼脂粉15.0 g·L-1,pH 值为7.0。LB 培养基:酵母提取物5.0 g·L-1,胰蛋白胨10.0 g ·L-1,NaCl 10.0 g·L-1,去离子水定容至1 000 mL,pH 值为7.0~7.2。
1.2 试验方法
1.2.1 内生细菌和根际细菌的分离与纯化 内生细菌分离纯化:取3 株健康草莓植株,用清水冲洗后,将根、茎、叶分别剪成长5 mm、宽5 mm 左右的组织块,75%的酒精消毒1 min,1%次氯酸钠消毒1 min,无菌水漂洗3 次后,取最后1 次漂洗的无菌水作为空白对照涂布于培养基表面。取表面灭菌彻底的样品组织块分别放入离心管中用研磨器充分研磨,用无菌水将研磨液配制成不同浓度(稀释倍数分别为1 × 10-2、1 × 10-4、1 × 10-6、1 × 10-8)的稀释液。吸取100 μL 样品稀释液分别涂布到NA、LB、PDA 培养基平板上,均匀涂布后倒置放入恒温培养箱(智能霉菌培养箱,型号:MJX-260HS,宁波扬辉仪器有限公司,下同)28 ℃黑暗培养2~3 d,挑取不同形态特征的菌落划线于PDA 培养基上,纯化3 次后保存备用。
根际细菌分离纯化:选取3 株健康且长势较好的草莓植株,轻轻抖动去掉浮土,将根系及其根际土壤样品放入无菌采样袋中带回实验室。称取5 g 根际土壤放入45 mL 无菌水中,于28 ℃、150 r ·min-1充分震荡20 min,获得土壤悬液。通过梯度稀释获得1 × 10-6~1 × 10-1的土壤悬液,吸取1 ×10-4、1 × 10-5、1 × 10-63 个浓度梯度的悬液各0.2 mL,分别涂布于NA、LB、PDA 培养基上,倒置于28 ℃培养箱中黑暗培养2~3 d。观察其生长情况,挑取不同形态特征的菌落划线于PDA 培养基上,纯化3 次后保存备用。
1.2.2 拮抗菌株筛选 以草莓褐色叶斑病菌为指示菌,采用平皿对峙法筛选具有抑菌活性的菌株,参照黄秀梨(1999)的方法。具体步骤:在PDA培养基中央放置长5 mm、宽5 mm 的病原菌菌饼,在菌饼上下左右4 个方向滴加2 μL 内生细菌或根际细菌菌液(菌液浓度OD600=0.8),每处理重复3次,未滴加菌液的作为对照组。28 ℃黑暗培养8 d后,采用“十”字交叉法测量病原菌菌落直径,计算抑制率。其中抑制率大于50%的菌株即为拮抗菌,之后测定这些菌株对其他3 种草莓病原菌的抑制率。
同时,利用超景深三维立体显微镜(基恩士VH-Z100UR/W/T)观察草莓褐色叶斑病病原菌菌丝形态特征。
1.2.3 拮抗菌株鉴定 菌株形态学及生理生化鉴定:参照《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001),对筛选出的拮抗菌株形态特征及生理生化特性进行鉴定。
分子生物学鉴定:用细菌基因组DNA 快速提取试剂盒(北京酷来博科技有限公司)提取拮抗菌基因组DNA 后,使用通用引物SR1(5′-AGAGTTTGATCATGGCTCAG-3′)和SR2(5′-ACGGTTACCTTGTTACGACTT-3′)(Yuan et al.,2022)对其16S rDNA 序列进行PCR 扩增。扩增程序为94 ℃预变性5 min,94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸45 s,30 个循环;72 ℃延伸5 min。PCR 扩增产物经1.2%的琼脂糖凝胶电泳检测后,送北京六合华大基因科技有限公司测序。并将测序结果在NCBI 数据库中进行BLAST比对分析。
1.2.4 拮抗菌株上清液抑菌活性测定 将拮抗效果最好的菌株接种于液体LB 培养基中,在恒温摇床180 r·min-128 ℃培养2 d 后,4 000 r·min-1离心20 min,用孔径为0.2 μm 的过滤器过滤得到上清液,将上清液与PDA 培养基混合,配制成含上清液浓度分别为2%、4%、8%的平板。在平板中放置直径为5 mm 的草莓褐色叶斑病原菌菌饼,以未添加上清液的PDA 平板为对照,倒置放入25 ℃培养箱避光培养。8 d 后测量病原菌菌落直径,计算抑制率。
1.2.5 拮抗菌株分泌酶活性分析 蛋白酶水解活性检测:在脱脂牛奶培养基中心位置接种3 μL 拮抗菌株细胞悬液(OD600=0.8),28 ℃培养48 h 后观察消解圈。
纤维素酶活性检测:在CMC 培养基中心位置接种3 μL 拮抗菌株细胞悬液(OD600=0.8),28 ℃培养48 h 后,加入5 mL 刚果红染料染色30 min。倒掉染料,再加入5 mL 1 mol·L-1的NaCl 溶液脱色15 min,观察消解圈。
β-1,3-葡聚糖酶分解活性检测:在苯胺蓝培养基中心位置接种3 μL 拮抗菌株细胞悬液(OD600=0.8),28 ℃培养48 h 后观察消解圈。
1.2.6 拮抗菌株对草莓褐色叶斑病的防治试验 取健康草莓叶片,清水清洗后晾干,用拮抗菌株细胞悬浮液(OD600=1.5)均匀喷施至叶片边缘有水珠滴落,以等量无菌水处理为阴性对照,等量430 g·L-1戊唑醇悬浮液(天津市汉邦植物保护剂有限责任公司)处理为阳性对照。自然风干后每片叶用牙签扎出3 处机械损伤,取直径为5 mm 的草莓褐色叶斑病病原菌菌饼放置在叶片损伤处,以相同大小的琼脂块处理为空白对照。用脱脂棉包裹叶柄尾端保湿后用保鲜膜密封,放置于28 ℃的培养箱光照培养。每处理3 次重复,于接种7 d 后记录病斑直径和发病率。
1.2.7 拮抗菌株在草莓叶片上定殖能力分析 取健康草莓叶片,清水洗净后晾干,参照1.2.6 的方法对叶片进行拮抗菌株细胞悬浮液喷施处理。处理后1~12 d 每天取0.1 g 叶片放入2 mL 离心管中,加入900 μL 无菌水,在研磨器中研磨均匀。取其研磨液100 μL 梯度稀释涂布(稀释倍数分别为1 ×10-2、1 × 10-4、1 × 10-6),28 ℃培养24 h 后进行菌落计数,重复3 次(张玉勋 等,2000)。
1.2.8 数据统计与分析 试验数据采用Excel 2007软件进行统计,并用SPSS 26.0 软件进行ANOVA邓肯差异分析(P<0.05)。
2 结果与分析
2.1 草莓内生细菌及根际细菌分离
利用NA、PDA、LB 3 种培养基,从草莓根、茎、叶及根际土中分离纯化细菌菌株238 株。不同培养基和不同组织分离的菌株数量明显不同,其中根际土和根部组织在LB 培养基上分离的菌株较多;茎、叶部分在PDA 培养基上分离的菌株较多(表1)。
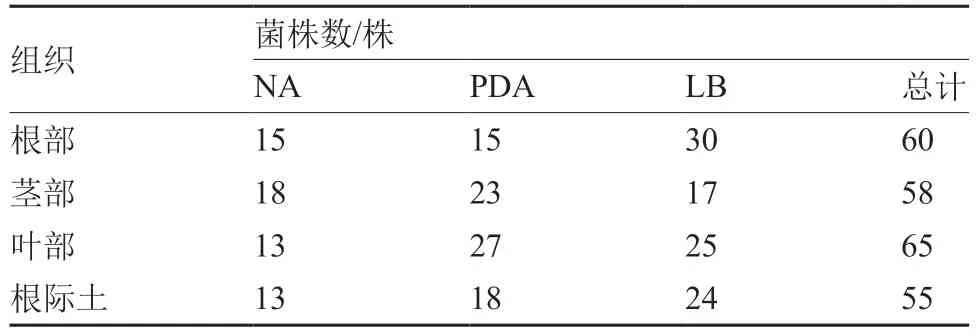
表1 不同培养基草莓内生细菌及根际细菌分离菌株数量
2.2 拮抗菌株筛选结果
利用平皿对峙法对238 株菌株的拮抗活性进行筛选,结果显示,10 株菌株(编号分别为G3-23、J3-20、J6-1、J1-4、G3-20、G3-29、G2-12、G3-k2、J1-11 和G3-17)对草莓褐色叶斑病菌具有明显的拮抗活性(图1),其抑制率在50.1%~72.1%之间(图2-A)。除J1-4 外,其他9 株菌株也能明显抑制灰葡萄孢菌(B.cinerea)、尖孢镰刀菌(F.oxysporum)和链格孢菌(A.alternate)的生长,具有广谱拮抗活性,其中G3-23 菌株效果最明显,对灰葡萄孢菌、尖孢镰刀菌、链格孢菌的抑制率分别为65.9%、76.7%、75.8%(图1、2)。

图1 拮抗菌株对4 种草莓病原菌的拮抗效果
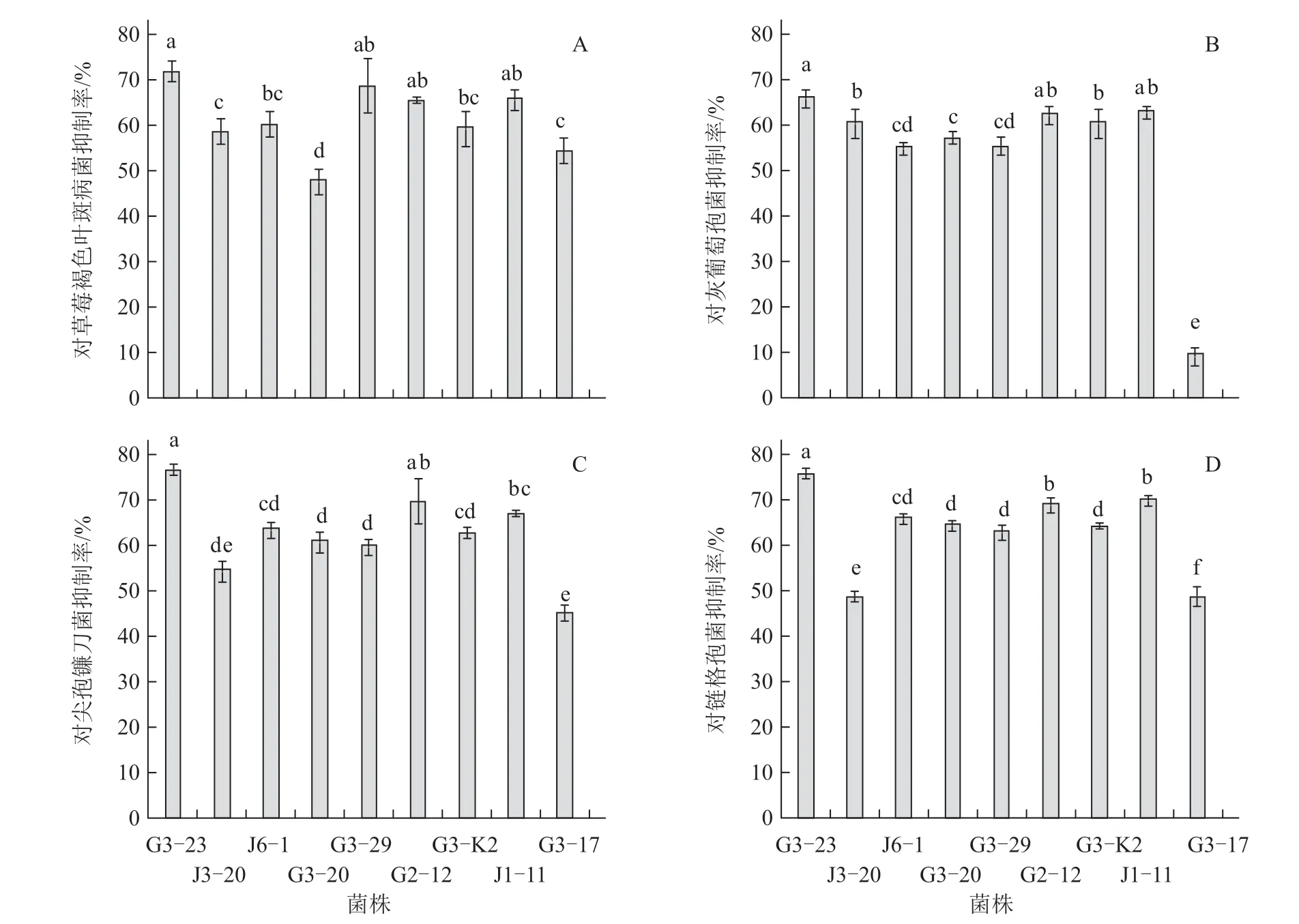
图2 拮抗菌株对4 种草莓病原菌的抑制率
2.3 拮抗菌株鉴定
2.3.1 形态学和生理生化鉴定 拮抗菌株G3-23、J3-20、J6-1、J1-4、G3-20、G3-29、G2-12、G3-k2、J1-11 和G3-17 分别在PDA、NA、LB 培养基上28 ℃恒温培养3 d 后的菌落形态特征如图3、表2 所示,生理生化特征见表3。由此初步鉴定菌株G3-23、J3-20、G3-29 为贝莱斯芽孢杆菌(Bacillus velezensis),J6-1、J1-4、G2-12、G3-k2 和J1-11为枯草芽孢杆菌(Bacillus subtilis),G3-20 为耐盐芽孢杆菌(Bacillus halotolerans),G3-17 为蜡样芽孢杆菌(Bacillus cereus)。
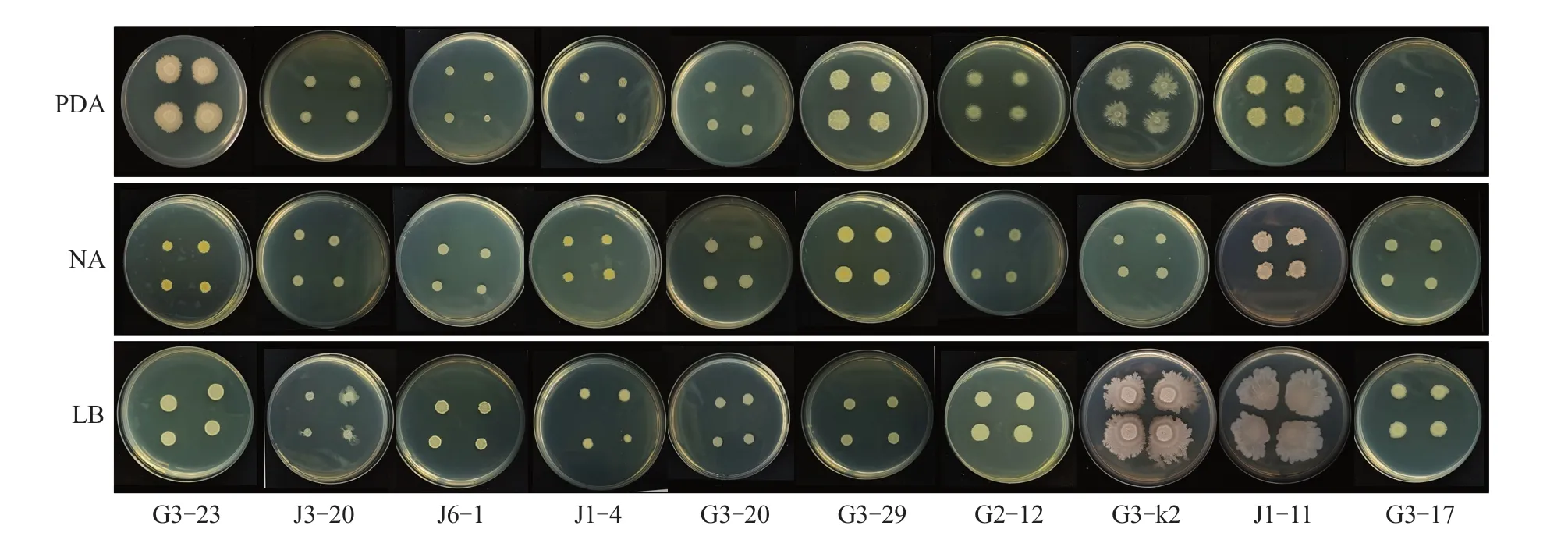
图3 拮抗菌株在不同培养基上的菌落特征
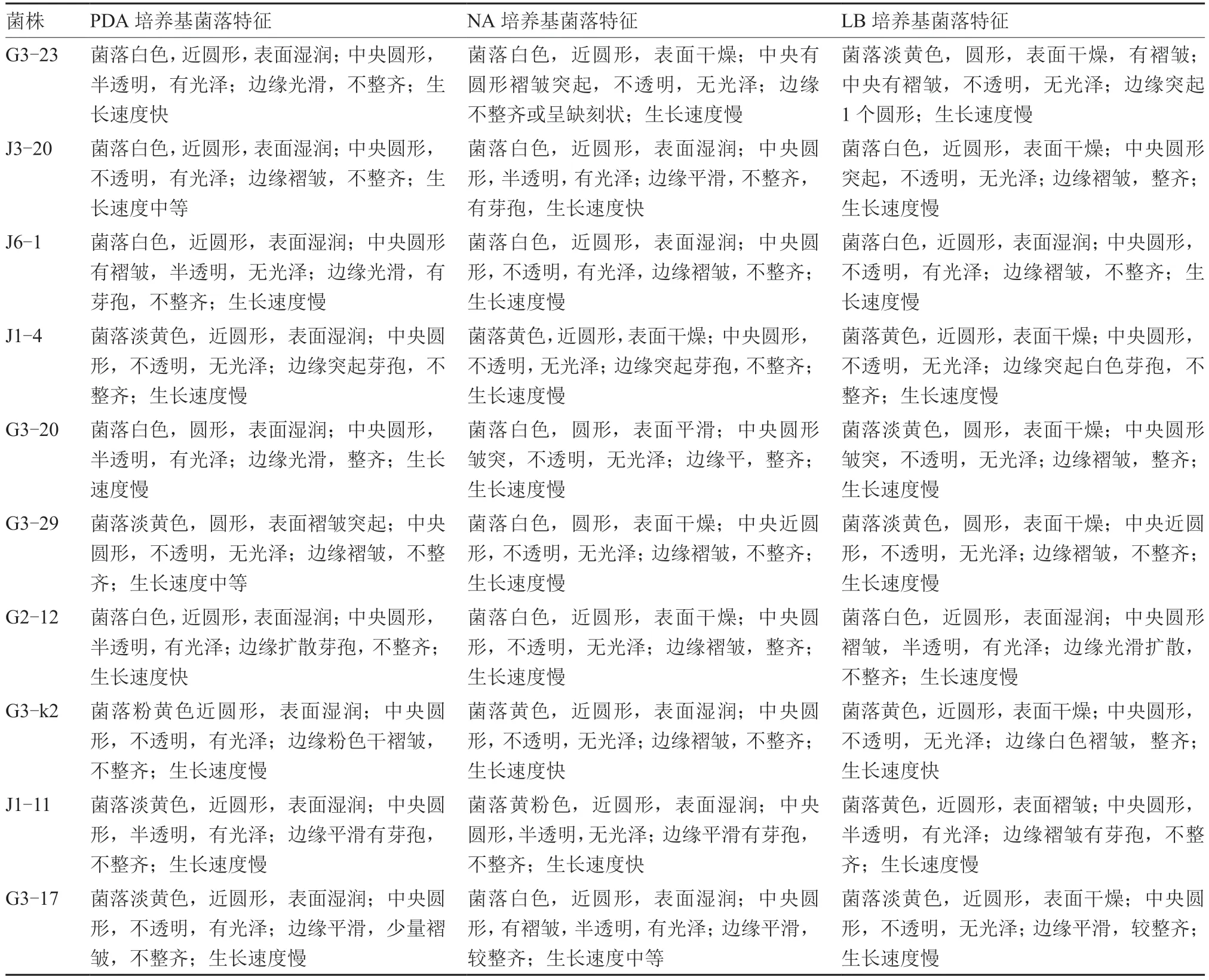
表2 拮抗菌株在不同培养基上的菌落特征
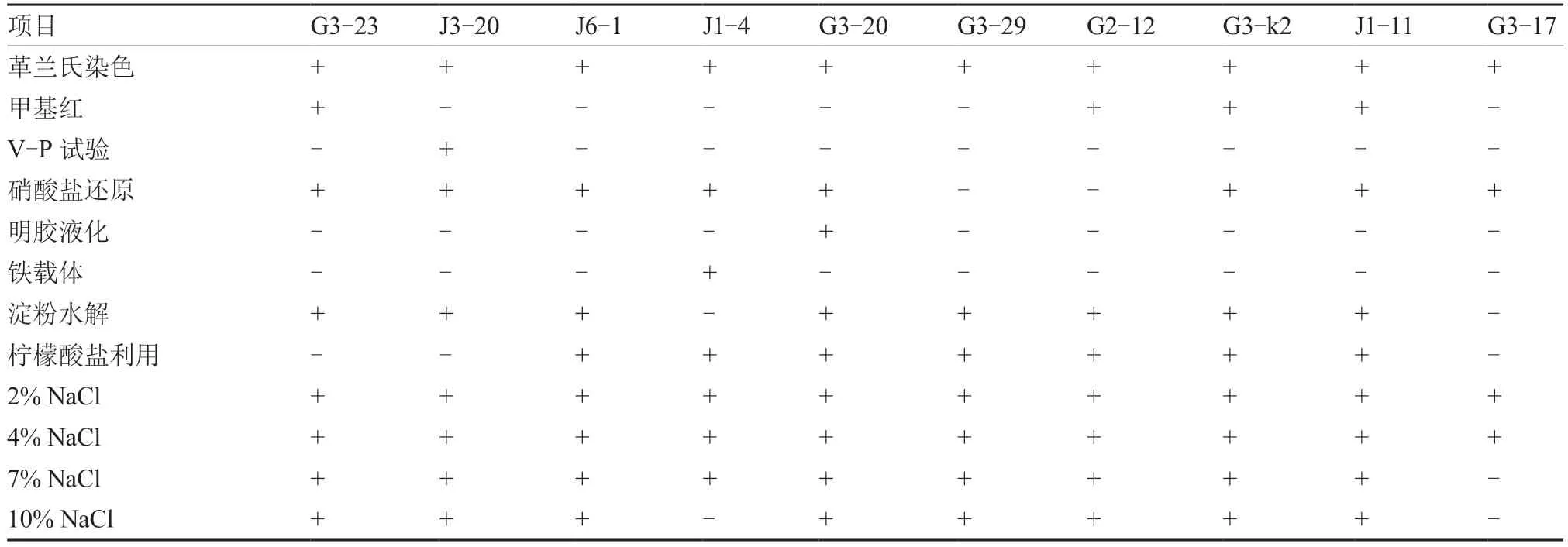
表3 拮抗菌株生理生化特性
2.3.2 分子生物学鉴定 对10 个拮抗菌株的16S rDNA 片段进行扩增,经测序分析后,将该序列在NCBI 数据库中进行BLAST 比对分析,发现菌株G3-23、J3-20 与贝莱斯芽孢杆菌(GenBank 登录号为CP053764.1)的相似性最高,相似度为99.93%,菌株G3-29 与贝莱斯芽孢杆菌(GenBank 登录号为CP053377.1)相似度达100.00%,菌 株J6-1、J1-4、G2-12、G3-k2和J1-11 与枯草芽孢杆菌(GenBank 登录号为CP054177.1)相似度均达100.00%,菌株G3-20 与耐盐芽孢杆菌(GenBank 登录号为CP029364.1)相似度为99.93%,菌株G3-17 与蜡样芽孢杆菌(GenBank 登录号为AB480773.1)相似度为99.79%。
综合形态学特征、生理生化特性和分子生物学鉴定结果,菌株G3-23、J3-20、G3-29 为贝莱斯芽孢杆菌,菌株J6-1、J1-4、G2-12、G3-k2 和J1-11 为枯草芽孢杆菌,菌株G3-20 为耐盐芽孢杆菌,菌株G3-17 为蜡样芽孢杆菌。
2.4 菌株G3-23 对草莓褐色叶斑病菌菌丝形态的影响
利用超景深三维立体显微镜观察拮抗活性最强的菌株G3-23 对草莓褐色叶斑病菌菌丝形态的影响。结果显示,未接种拮抗菌的草莓褐色叶斑病菌菌丝生长正常,粗细匀称且饱满(图4-A);而经菌株G3-23 拮抗8 d 后,草莓褐色叶斑病菌菌丝生长异常,外壁降解,菌丝萎缩,肿胀变形(图4-B),表明细胞壁基质发生了解体。
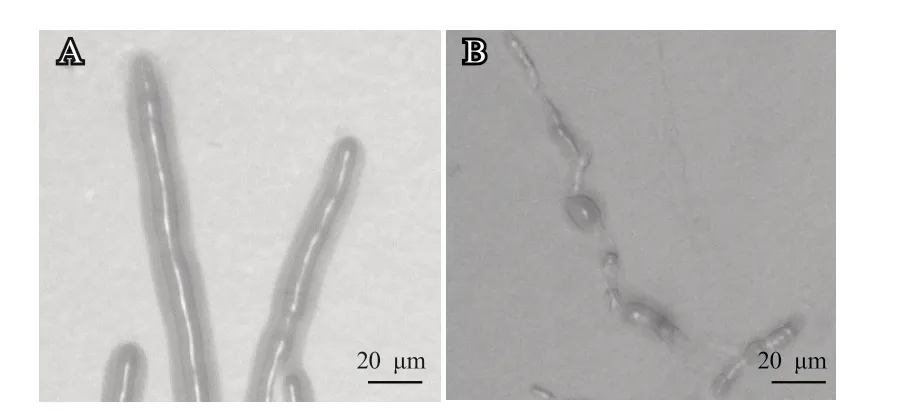
图4 菌株G3-23 对草莓褐色叶斑病菌(P. concavum)菌丝形态的影响
2.5 菌株G3-23 上清液抑菌活性分析
由图5 所示,2%、4%和8%浓度的G3-23 菌株上清液均能抑制草莓褐色叶斑病菌的生长,其抑制率分别为19%、27%、38%,表明菌株G3-23 上清液具有抑菌活性。

图5 不同浓度菌株G3-23 上清液对草莓褐色叶斑病菌(P. concavum)的生长抑制情况
2.6 菌株G3-23 分泌酶活性分析
菌株G3-23 在脱脂牛奶培养基中有明显的透明圈产生(图6-A),在CMC 培养基中经过染色、脱色,形成半透明圈(图6-B),但在苯胺蓝培养基上未形成透明圈(图6-C)。因此推测其代谢产物中含有蛋白酶和纤维素酶,没有β-1,3-葡聚糖酶活性。
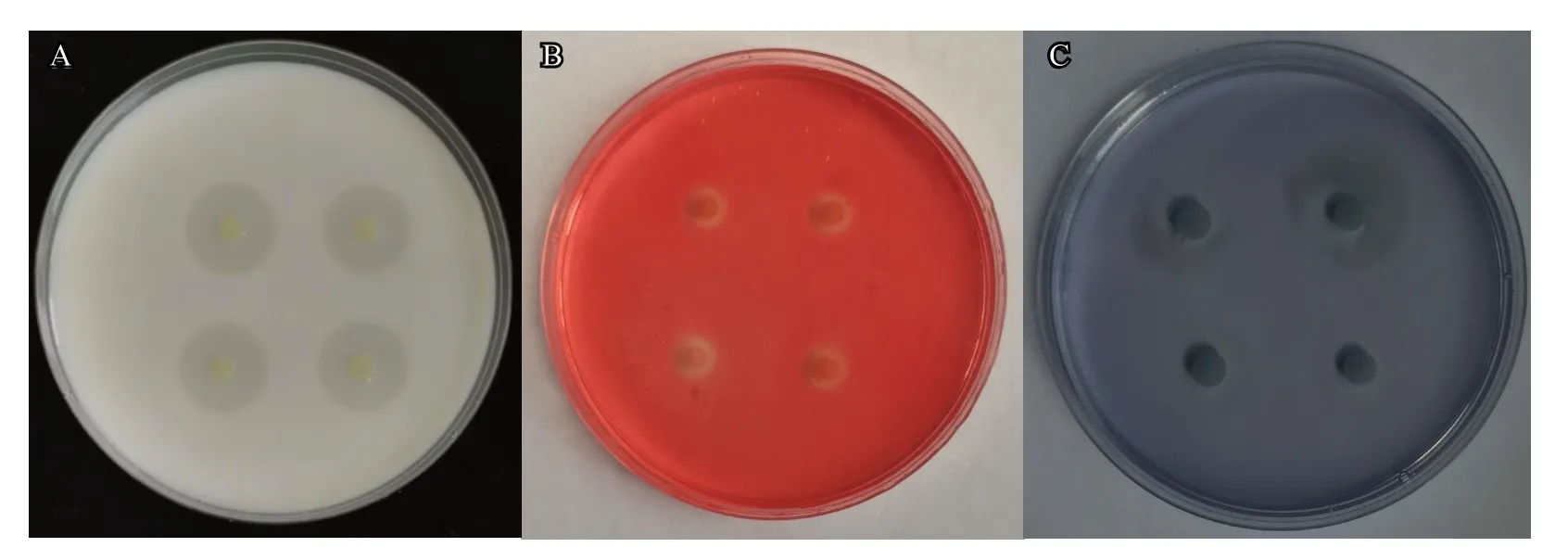
图6 菌株G3-23 分泌酶活性分析
2.7 菌株G3-23 对草莓褐色叶斑病的防治效果
利用离体草莓叶片鉴定菌株G3-23 对草莓褐色叶斑病的防治效果。结果显示,接种7 d 后,仅接种病原菌的阴性对照叶片表现出明显的褐色坏死斑,而菌株G3-23 细胞悬浮液处理的叶片发病程度明显降低(图7-A),发病率为16.67%,平均病斑长度为0.20 cm,均显著低于阴性对照,达到阳性对照戊唑醇的防治效果(图7-B、C)。
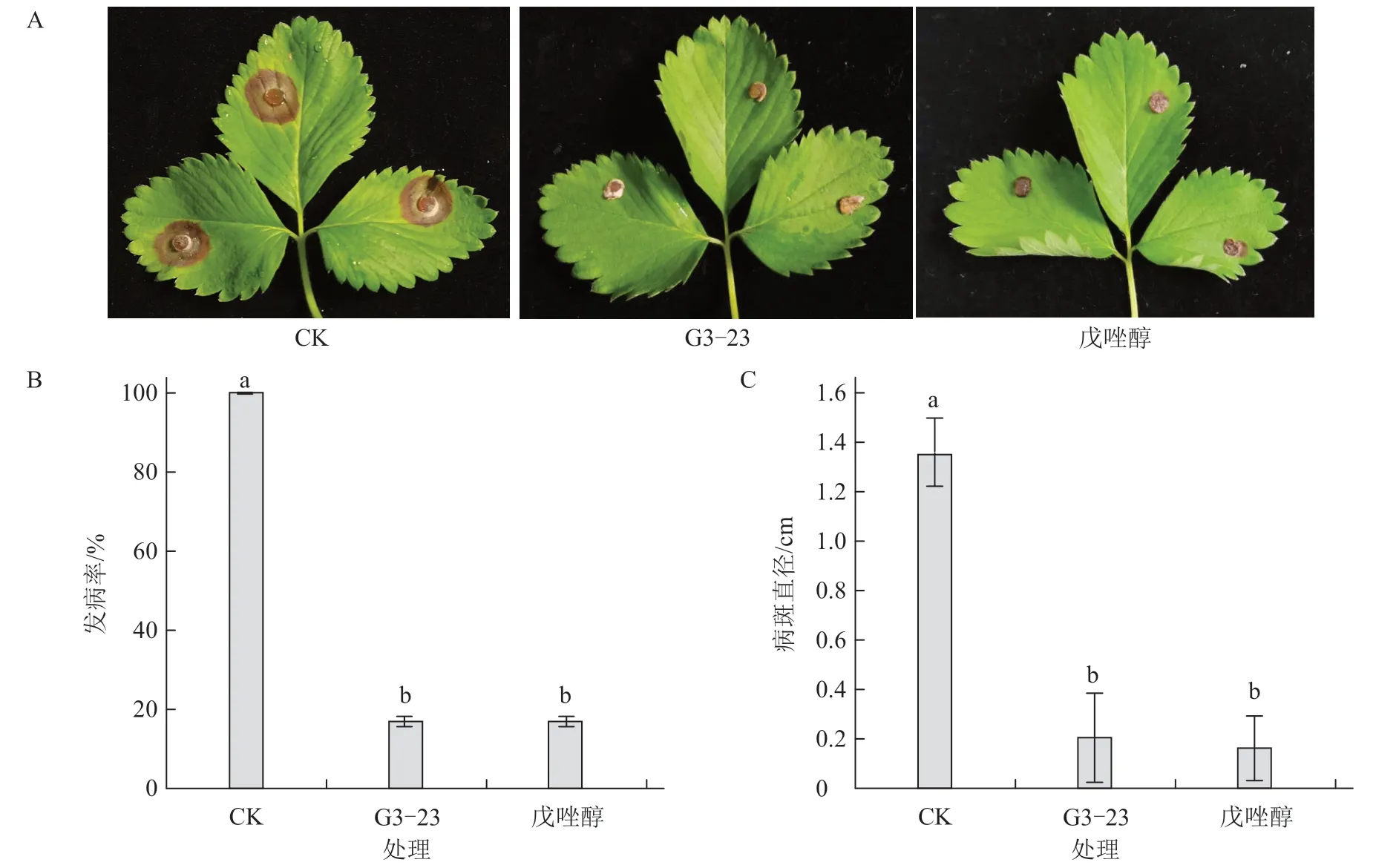
图7 菌株G3-23 细胞悬浮液对草莓褐色叶斑病的防治效果
2.8 菌株G3-23 在草莓叶片上定殖情况
如图8 所示,接种1 d 后,0.1 g 草莓叶片中G3-23 菌落数量为6.7 × 103CFU,第3 天菌落数量迅速增加到6.5 × 104CFU;7 d 后,菌株G3-23 菌落数量达到峰值,为4.9 × 105CFU,在第8 天略有下降;随后,菌株G3-23 的菌落数量缓慢减少,但仍保持在较高的浓度。初步表明菌株G3-23 能够在草莓叶片上成功定殖。
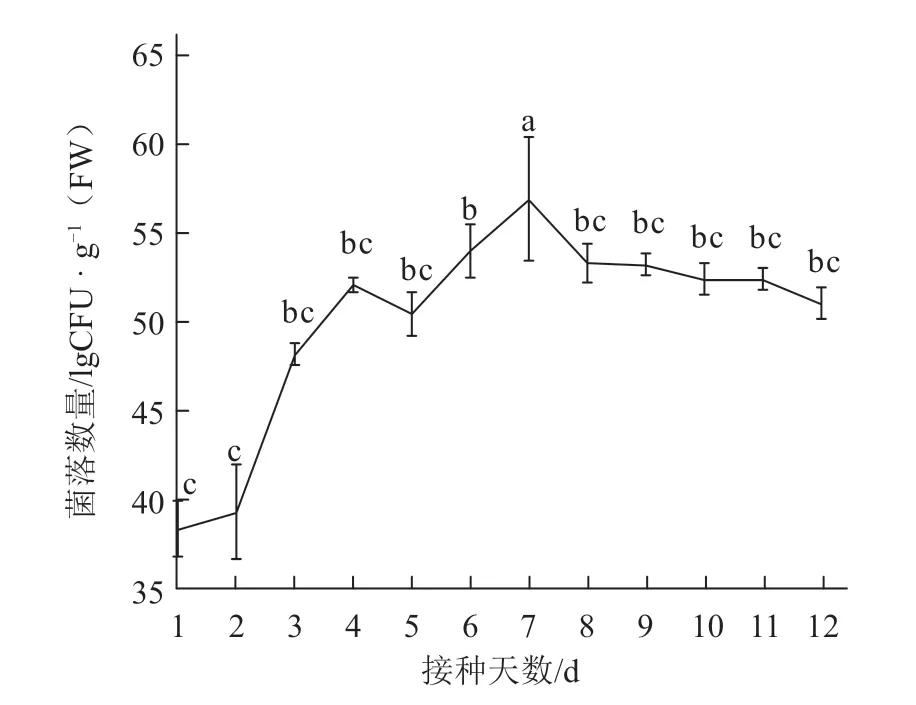
图8 菌株G3-23 在草莓叶片上的定殖情况
3 讨论与结论
利用拮抗菌防治植物病害是生物防治的主要方法。拮抗菌对植物没有损害,而且大多拮抗菌同时具有促生作用,有些还能够诱导植物产生抗病功能。芽孢杆菌制剂在生物制剂中占比很大,因其芽孢具有较强的抗逆性、容易生产、需要营养简单、易于保存和使用,所以市场上商业化的生防制剂大多为芽孢杆菌属(Ongena &Jacques,2008)。在本试验中发现广谱高效的拮抗菌株9 株,根据其形态学及分子鉴定结果,初步鉴定菌株G3-23、J3-20、G3-29 为贝莱斯芽孢杆菌,J6-1、G2-12、G3-k2 和J1-11 为枯草芽孢杆菌,G3-20 为耐盐芽孢杆菌,G3-17 为蜡样芽孢杆菌,其中贝莱斯芽孢杆菌和枯草芽孢杆菌在草莓病害防治方面研究较多,耐盐芽孢杆菌在草莓采后灰霉病的防治中也有所研究。蜡样芽孢杆菌虽在马铃薯防病(郝变青等,2022)及红豆杉促生(冯丹 等,2022)中有所报道,但在草莓病害中鲜见报道,后续可以对该菌株继续研究。
拮抗菌菌株的有效定殖是拮抗菌发挥防治病害功效的重要条件(王占武 等,2003)。本试验结果表明,菌株G3-23 能在离体草莓叶片上较好地定殖,这为其后续投入生产提供了理论基础。但由于田间环境复杂、本土菌群的存在、营养位点的抢占,拮抗菌很有可能被田间优势种群吞噬,拮抗菌株的定殖就遇到更多挑战(Kenig &Abraham,1976)。因此,大田环境下拮抗菌株G3-23 在草莓植株体内和栽培基质中的定殖能力及定殖后的生防能力还有待研究。
拮抗菌对病原菌的抑制作用机理主要有:拮抗菌及次级代谢物直接作用,通过空间位点营养竞争,通过诱导寄主抗性基因表达,或者拮抗菌在其他微生物和因素的影响下发生作用(Walker &Abraham,1970;刘俊,2010;刘磊 等,2017)。本试验结果表明,经菌株G3-23 拮抗处理后,草莓褐色叶斑病菌菌丝出现降解、萎缩、肿胀等畸形现象。芽孢杆菌分泌的常见胞外酶包含几丁质酶、蛋白酶、纤维素酶和β-1,3-葡聚糖酶等(Dahiya et al.,2006;张振坤 等,2016;陶永梅等,2019),胞外酶的种类及其活性可作为筛选拮抗菌的主要标记,通常产生胞外酶种类多的拮抗菌株具有较好的生防效果(邓永卓 等,2020)。菌株G3-23 分泌物具有蛋白酶和纤维素酶活性,可能参与降解病原菌的细胞壁,具体机制还有待进一步的研究。
在从草莓及其根际土壤中分离筛选得到的9 株具有广谱拮抗活性的菌株中,选取抑制效果最好的贝莱斯芽孢杆菌菌株G3-23,通过叶片拮抗试验进一步分析其对草莓褐色叶斑病菌的防治效果,结果表明,菌株G3-23 在叶片上抑制病斑扩展的效果接近阳性对照戊唑醇。本研究为草莓褐色叶斑病害的生物防治提供了菌种资源,为草莓拮抗菌的开发利用奠定了基础。

