2015—2020年某院CRE分布、耐药性及碳青霉烯酶基因检测结果分析
黄加铭,王 启,徐玉金,孙细欢,黄东红△
1.福建医科大学附属第二医院微生物实验室,福建泉州 362300;2.北京大学人民医院检验科,北京 100044
近年来,碳青霉烯耐药的革兰阴性菌,尤其是碳青霉烯耐药肠杆菌(CRE)在全球范围内迅速增长,已经成为一个严重的全球性公共卫生问题。根据美国疾病控制与预防中心(CDC)的数据,CRE耐药率在过去十年中从1.2%上升到了4.2%[1-2],根据中国抗菌药物监测网(CHINET,www.chinets.com)的数据,肺炎克雷伯菌对美罗培南和亚胺培南的耐药率分别从2005年的2.9%和3.0%迅速上升至2018年的26.3%和25.0%,2019—2021年的耐药率均高于23.0%。相关研究已经证明,碳青霉烯酶基因(包括blaKPC-2和blaNDM)的存在是中国CRE对碳青霉烯类抗菌药物耐药的主要机制,分别以肺炎克雷伯菌和大肠埃希菌最多见[3]。本研究对2015—2020年福建医科大学附属第二医院(以下简称本院)临床分离的CRE菌株进行耐药性、临床分布、主要碳青霉烯酶基因型等分析,旨在为本地区CRE感染治疗和流行控制提供科学依据。
1 资料与方法
1.1一般资料 收集2015年1月1日至2020年12月31日本院临床分离的对厄他培南、美罗培南或亚胺培南任意一种药物耐药的非重复性CRE 38株,包括肺炎克雷伯菌15株,大肠埃希菌13株,阴沟肠杆菌3株,黏质沙雷菌3株,解鸟氨酸拉乌尔菌2株,产酸克雷伯菌1株,植生拉乌尔菌1株。培养操作严格按照《全国临床检验操作规程》[4]进行。
1.2仪器与试剂 microflex LRF MALDI-TOF型质谱微生物鉴定仪(德国布鲁克公司),细菌药敏MH培养基、细菌分离培养基由郑州安图生物科技有限公司提供,抗菌药物纸片为英国Oxoid公司产品。阳离子调节的MH肉汤、LB肉汤琼脂购自美国Becton Dickinson公司;PCR仪购自美国Bio-Rad公司;PCR扩增引物由 Invitrogen公司合成;凝胶成像仪购自北京六一生物科技有限公司。
1.3细菌鉴定及药敏分析 采用microflex LRF MALDI-TOF型质谱微生物鉴定仪对细菌进行菌种鉴定复核,质谱鉴定分值>2.0可以鉴定到种水平,分值在1.7~2.0可以鉴定到属水平;采用微量肉汤稀释法检测美罗培南、亚胺培南、厄他培南、阿米卡星、头孢他啶、环丙沙星、米诺环素、氨曲南、头孢吡肟、左氧氟沙星、替加环素、多黏菌素B、头孢他啶/阿维巴坦、头孢哌酮/舒巴坦和哌拉西林/他唑巴坦的最低抑菌浓度(MIC),采用琼脂稀释法检测磷霉素的MIC。多黏菌素和磷霉素的折点参照欧洲临床微生物和感染病学会药敏委员会(EUCAST)推荐的标准[5]。替加环素的折点参考美国食品和药物管理局(FDA)推荐的标准,其他药物折点参照美国临床和实验室标准协会(CLSI,2020)执行标准[6],头孢哌酮/舒巴坦的折点采用头孢哌酮的折点。质控菌株为大肠埃希菌ATCC25922。
1.4碳青霉烯酶和mcr-1基因检测 所有的CRE菌株采用加热煮沸法提取细菌DNA,采用聚合酶链反应(PCR)扩增几种常见的碳青霉烯酶基因(blaKPC、blaNDM、blaOXA-48、blaIMP和blaVIM)[7-8]。引物由Invitrogen公司合成。PCR反应体系体积25.0 μL,包括DNA模板3.0 μL,相应上、下游引物(10 μmol/L)各0.2 μL,2×PCR Mix 12.5 μL,ddH2O 9.1 μL。94 ℃预变性120 s,94 ℃变性30 s,退火延伸30 s,30个循环,最后72 ℃延伸10 min。PCR检测多黏菌素耐药基因mcr-1[9]。PCR扩增产物经1%琼脂糖凝胶电泳后,用紫外凝胶成像与分析系统观察结果,PCR扩增产物送北京擎科新业生物技术有限公司进行测序,测序采用双向通道;并将测序结果进行BLAST序列比对(http://blast.ncbi.nlm.nih.gov/;http://www.bldb.eu/Enzymes.php) 。
1.5同源性分析 采用多位点序列分型(MLST)对碳青霉烯耐药肺炎克雷伯菌(CRKP)进行同源性分析。扩增肺炎克雷伯菌的7个管家基因:rpoB、gapA、mdh、pgi、phoE、infB 和tonB,PCR反应体系同1.4,所得 PCR 产物送北京擎科新业生物技术有限公司进行测序,测序结果于网站数据库进行比对(http://www.pasteur.fr/recherche/genopole/PF8/mlst/Kpneumoniae.html),获取CRKP序列型别(ST型)。
1.6统计学处理 采用Excel 2007软件进行数据处理,计数资料以例数或百分率表示。
2 结 果
2.1CRE菌株鉴定与分布情况 2015年1月至2020年12月本院临床共分离出肠杆菌目细菌5 908株,其中38株为CRE菌株,总检出率为0.6%,肺炎克雷伯菌15株,大肠埃希菌13株,其他肠杆菌目细菌10株。38株CRE经质谱仪鉴定,分值均>2.0。CRE主要分离自普内科、普外科、呼吸内科与危重症医学科,标本来源主要为痰液、血液、尿液等标本。见表1。
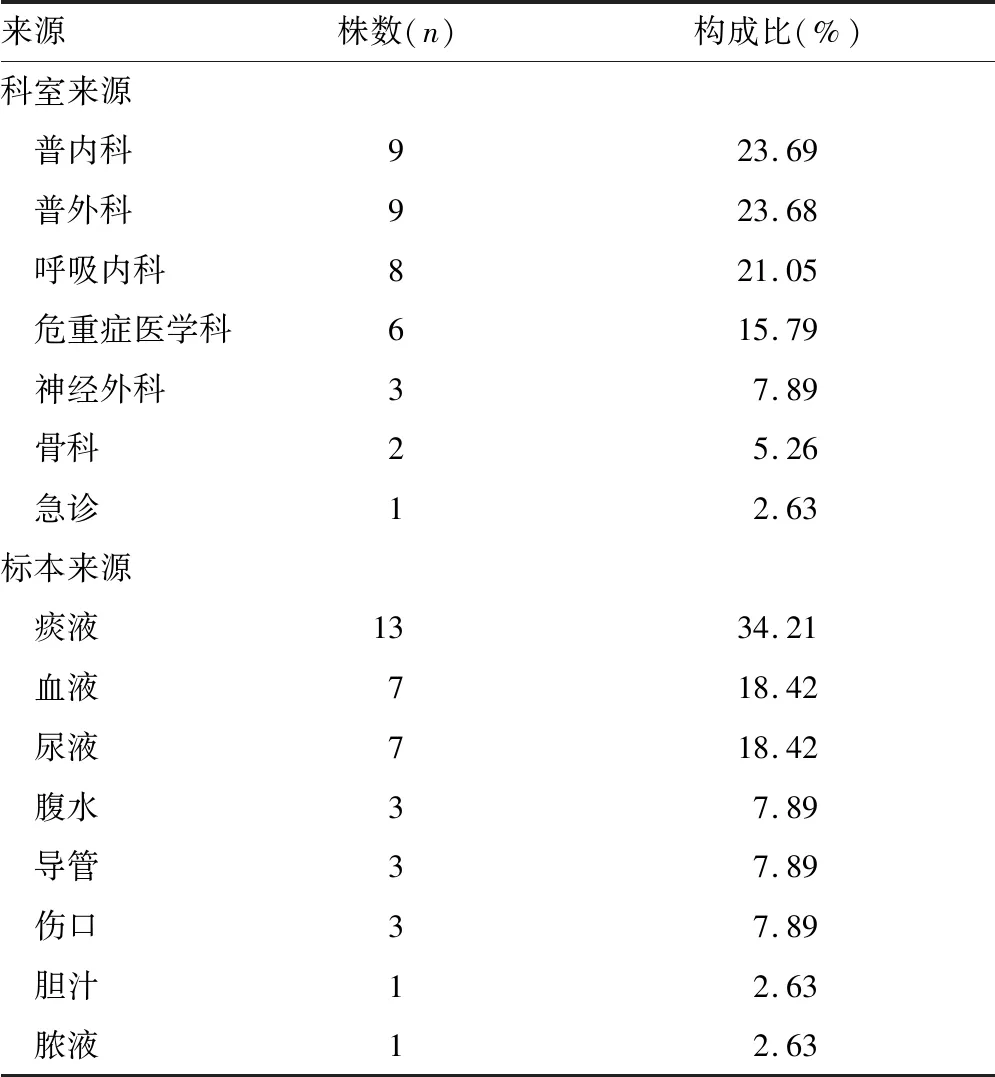
表1 CRE科室来源和标本来源分布情况
2.2药敏结果 大多数CRE菌株对头孢他啶、头孢吡肟、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦和碳青霉烯类抗菌药物耐药性较高。CRE菌株对多黏菌素B和替加环素敏感率分别为78.95%和89.48%。对阿米卡星、磷霉素和米诺环素敏感率分别为60.53%、55.26%和44.74%,其次是氨曲南(39.47%)、头孢他啶/阿维巴坦(28.95%)、环丙沙星(15.79%)和左氧氟沙星(15.79%)。见表2。产blaKPC-2、blaKPC-3的CRE对头孢他啶/阿维巴坦100%耐药。然而,所有产金属酶的CRE对头孢他啶/阿维巴坦都有耐药性(MIC>64 mg/L)。
2.3碳青霉烯酶和mcr-1基因检测结果 38株CRE中,有35株碳青霉烯酶基因阳性和2株mcr-1基因阳性,1株未产酶。碳青霉烯酶基因包括23株blaNDM(65.71%,23/35)、8株blaKPC(22.86%,8/35)、3株blaIMP(8.57%,3/35)、1株blaVIM(2.86%,1/35),未检测到blaOXA-48基因阳性的菌株。CRKP中blaKPC-2检出率最高(40.00%,6/15),CRE中均为blaNDM-5(100.00%,13/13)。35株产碳青霉烯酶CRE的分布见表3。
2.4同源性分析结果 15株CRKP菌株MLST分型结果为ST11型7株(46.67%)、ST540型1株(6.67%),ST1800型1株(6.67%),ST2026型1株(6.67%),ST22型1株(6.67%),ST2666型1株(6.67%),ST356型1株(6.67%),ST394型1株(6.67%),ST567型1株(6.67%)。
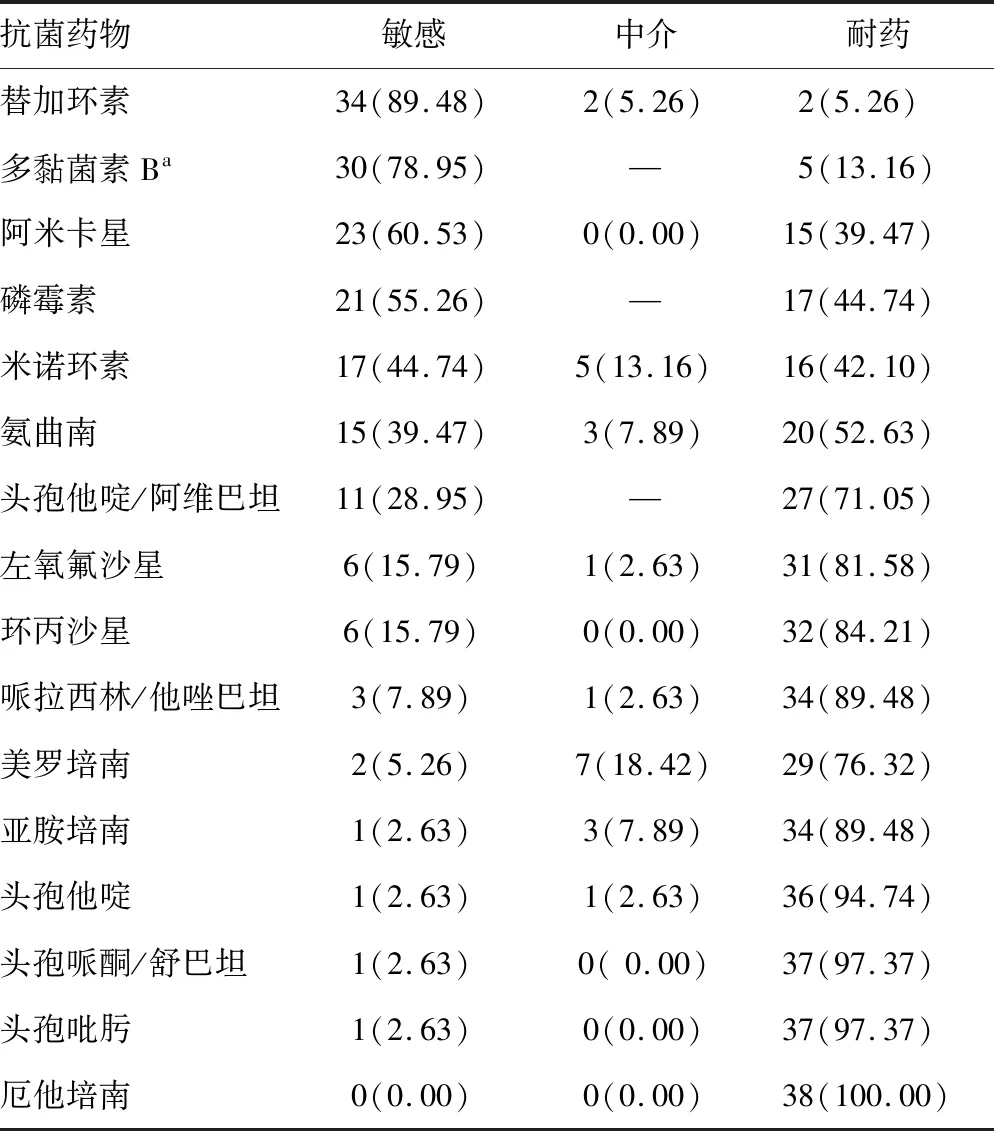
表2 38株CRE的药敏试验结果[n(%)]
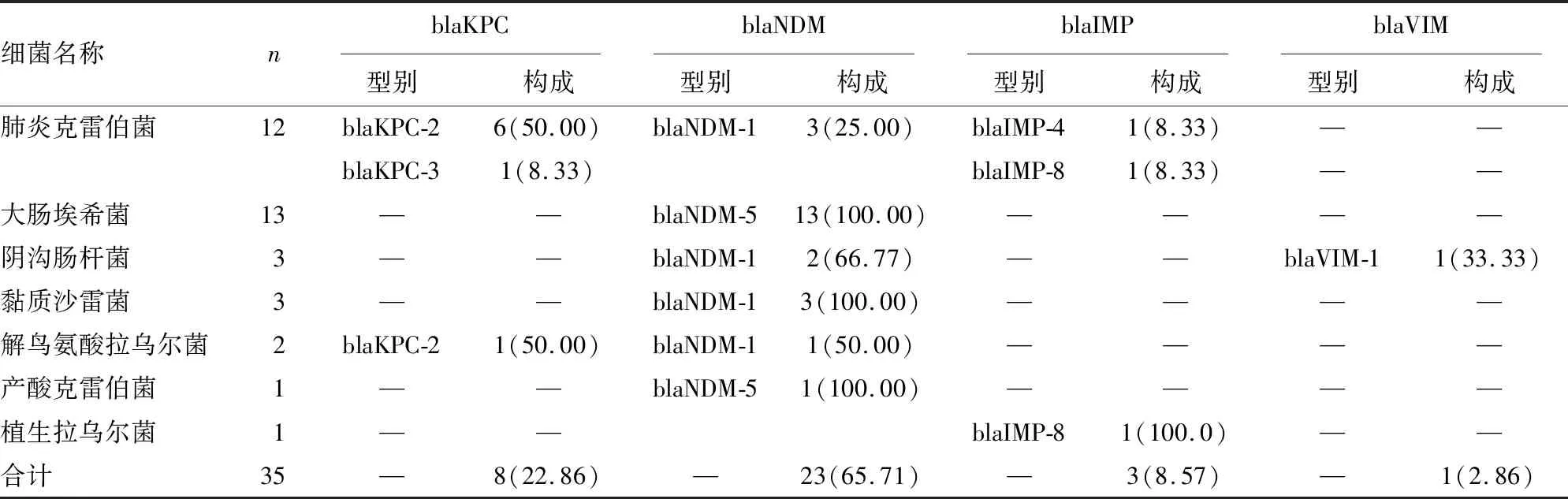
表3 35株产碳青霉烯酶CRE的分布
3 讨 论
随着碳青霉烯类抗菌药物在临床治疗中的广泛使用,CRE急剧增加。国内多中心研究显示,临床上的CRE主要是肺炎克雷伯菌,其次是大肠埃希菌和阴沟肠杆菌[10-11]。与CRE感染相关的医疗风险因素包括住院时间长、存在侵入性操作、使用过抗菌药物、存在血液透析及长期护理设施暴露、入住重症监护病房(ICU)等,还有研究发现服用左氧氟沙星和甲氧苄啶/磺胺甲噁唑可能增加CRE感染风险[12]。
碳青霉烯类抗菌药物治疗临床上大多数的革兰阴性菌有效。然而,CRE不仅对相关碳青霉烯类抗菌药物耐药,而且还对许多其他抗菌药物耐药,因此,CRE可导致难以治疗的严重感染。此外,临床上分离的CRE菌株包括大肠埃希菌、克雷伯菌肠杆菌属、沙雷菌属、变形杆菌属等,这些细菌是各种感染性疾病的常见致病菌。与此同时,碳青霉烯类抗菌药物耐药基因通常在质粒上,从医院感染和公共卫生的角度来看,更需特别关注。
CRE包括产生碳青霉烯酶的CRE(CP-CRE)和不产生碳青霉烯酶的CRE(非CP-CRE)。CP-CRE比非CP-CRE具有更高的MIC和更高的病死率。此外,碳青霉烯酶的编码基因通常存在于可移动的遗传元件上,因此CP-CRE的感染控制风险可能高于非CP-CRE[13]。本院的CP-CRE占比达到92.11%(35/38),需引起重视。
在中国,KPC-2、NDM和OXA-48型碳青霉烯酶在CRE临床分离株中占优势,碳青霉烯酶基因最多见的是肺炎克雷伯菌分离株中的blaKPC-2,以及儿童大肠埃希菌分离株中的blaNDM[14]。本院尚未发现有儿童检出CRE,且目前本院产碳青霉烯酶CRE以blaNDM为主,达到65.71%,这可能与本院检出的CRE菌株数量较少有关,也与细菌的地域分布差异有关。本院药敏分析结果显示,所有产金属酶的CRE对头孢他啶/阿维巴坦都耐药,大多数产金属β-内酰胺酶的CRE,尤其是那些产NDM型酶的CRE对β-内酰胺类和大多数非β-内酰胺类抗菌药物(氨基糖苷类、甲氧苄啶/磺胺甲噁唑、四环素、氟喹诺酮类)高度耐药,尽管阿维巴坦对金属酶缺乏活性,但它与氨曲南在少数体外和动物研究中显示出协同效应[15],且这种联合应用需要在临床实践中进一步评估。最近开发的氨曲南/阿维巴坦(ATM-AVI)组合用药方案提供了一种新的治疗选择[16],然而,相关研究揭示了多种产生NDM-5的大肠埃希菌分离株具有不同的克隆背景,表现出对ATM-AVI的MIC升高,并已在全球传播(瑞士、巴基斯坦、印度、科威特、泰国、土耳其、哥伦比亚、委内瑞拉和美国)[17],主要原因是产NDM-5大肠埃希菌的质粒都携带有blaCMY β-内酰胺酶基因,其中blaCMY-42等位基因占优势[18]。
本研究结果显示,在15株CRKP中,主要以blaKPC为主,占53.33%(8/15),与国内研究基本一致[14]。而丹麦检出的在CRKP中主要以blaOXA-48为主[19]。本研究结果显示15株CRKP菌株MLST分型主要以ST11型为主(46.67%),ST11型高致病性肺炎克雷伯菌菌株对人类健康构成重大威胁,因为它们同时具有高致病性、多药耐药性和高度传染性。因此,应采取控制措施,防止CRKP在医院环境和社区中进一步传播[20]。
本研究结果显示,大多数CRE菌株对常用抗菌药物表现出高度耐药性,潜在有用的药物是替加环素、多黏菌素B、阿米卡星和磷霉素。本院在2015—2020年共检出5株对多黏菌素B耐药的CRE菌株,其中2株产mcr-1基因,有研究显示目前我国产mcr-1的肺炎克雷伯菌为0.11%[21],美国首次在耐多药大肠埃希菌中发现了质粒介导的多黏菌素耐药性,这引起了对泛耐药细菌的担忧[22]。多黏菌素(黏菌素和多黏菌素B)被认为是治疗CRE感染的最后选择。尽管没有多黏菌素暴露,但临床CRE分离株仍存在多黏菌素耐药性。药敏试验结果显示,我国多黏菌素的耐药率为3.8%[23]。随着新的β-内酰胺/β-内酰胺酶抑制剂的引入,患者有了更多的选择方案,避免使用多黏菌素而引起相关的不良反应[24]。对于一种或多种抗菌药物仍具有活性的CRE菌株,大多数菌株使用联合治疗能取得良好的效果,经常使用的方案包括碳青霉烯类、多黏菌素、氨基糖苷类或替加环素等抗菌药物的组合[25]。
临床微生物实验室的工作人员在预防CRE传播和协助患者治疗方面发挥着重要作用,实验室人员应能够提供准确的药敏试验结果,应提供CRE的相关酶型检测结果,必要时应该加做个体化联合药敏试验,同时结合各地区各医院的数据,合理使用抗菌药物。总之,本院的CRE总体分离率不高,本院尚未发现有儿童CRE菌株,且目前本院成人的CRE以blaNDM为主,未发现有CRE克隆菌株暴发流行,但本研究样本量较小,后期需要再进一步分析。

