基于VEGF-VEGFR通路探究Avastin对DR模型大鼠干预效果
庄宪丽 张莹 杨家干 杨延振
(徐州医科大学附属滕州市中心人民医院眼科,山东 滕州 277500)
糖尿病视网膜病变是糖尿病最常见的微血管并发症之一,是否会发生糖尿病视网膜病变取决于患者血压、血糖、血脂的控制情况及患病时间的长短〔1,2〕。患有糖尿病视网膜病变的患者会出现失明、视物模糊及视力下降等临床表现,糖尿病视网膜病变常见的眼部表现为视网膜微动脉形成及点状出血,如果出现玻璃体积血、黄斑水肿就会导致严重的视力下降〔3〕。患者可以通过控制血压、血糖等减轻糖尿病视网膜病变进程,通过联合玻璃体腔药物注射的方法来减轻黄斑水肿,改善视力。贝伐单抗(Avastin)可通过抑制血管内皮生长因子及受体(VEGF-VEGFR)的表达,进而改善视力〔4〕。目前关于Avastin用于糖尿病视网膜病变模型大鼠缺乏相关资料数据。本研究基于VEGF-VEGFR通路探究Avastin对糖尿病视网膜病变模型大鼠的干预效果。
1 材料与方法
1.1研究动物 选取75只SPF级大鼠,由冠科生物技术(中山)有限公司提供〔动物许可证号:SYXK(粤)2020-0240〕,鼠龄3~6个月,平均(4.27±1.43)个月,体重227~268 g,平均体质量(235.12±19.48)g,将大鼠放置室温23~25℃,湿度40%~70%,自然光照、通风的无病原菌干净笼子中饲养,饮用的水和食物均经消毒。本实验经医院伦理委员会批准。主要试剂:酶联免疫吸附试验(ELISA)试剂盒购于上海将来实业股份有限公司;VEGF抗体购于江西江蓝纯生物试剂有限公司;VEGFR-2抗体购于厦门仑昌硕生物科技有限公司;β-actin抗体购于上海梵态生物科技有限公司。
1.2方法
1.2.1建模 在75只大鼠中随机选取15只为正常组不做任何处理,其余大鼠随机分为模型组、低剂量组、中剂量组、高剂量组各15只,参照陈向东等〔5〕研究实验中糖尿病视网膜病变建立方法建立糖尿病视网膜病变大鼠模型,除正常组外,其余各组大鼠均按照30 mg/kg腹腔内注射枸橼酸钠缓冲液诱发大鼠糖尿病视网膜病变,每周1次,持续2 w,累计剂量达到60 mg/kg,正常组给予同法注射等体积生理盐水。建模成功标准:大鼠视力下降,出现视物模糊症状。
1.2.2给药 低剂量组、中剂量组、高剂量组大鼠分别给予Avastin(齐鲁制药有限公司;国药准字H20020535;6.25 mg/ml)灌胃6 w,剂量分别为0.09、1.00、1.25 mg,正常组和模型组给予等体积生理盐水灌胃。
1.2.3病理组织学观察 在大鼠灌胃后、禁食不禁水12 h,麻醉处死,迅速摘除眼球后立即固定在染色液中,将所制备的大鼠眼球组织样本在甲醛溶液中固定24 h后,行常规脱水、透明、石蜡包埋,制备厚度为3 μm的组织切片,取眼球组织石蜡包埋切片,经苏木素-伊红(HE)染色,中性树胶封片后,显微镜下观察并拍照分析。
1.2.4脂联素(ADPN)、瘦素(LP)、超氧化物歧化酶(SOD)、丙二醛(MDA)、细胞间黏附分子(ICAM)-1水平评价 抽取各组大鼠的空腹静脉血2 ml,离心半径5 cm平均32 s转速 3 000 r/min进行离心处理3 min,分离上层血清,在-4℃的环境下保存备用,采用ELISA检测ADPN、LP、SOD、MDA、ICAM-1水平,实验步骤:设置10个标准孔并准备相应水平标准品,设置1个空白孔及若干待测样品在10 μl 待测样品中加入40 μl样本稀释液,封板膜封板,置于37℃水浴箱温育30 min,清洗反应板5次,每次间隔30 s,拍干,在除空白孔以外的各孔中加入酶标液50 μl,封膜温育30 min,清洗反应板5次,每次间隔30 s,拍干,在各孔中加入显色A液、B液各50 μl,轻轻震荡混匀,37 ℃避光环境下显色15 min,在反应孔内加入终止液50 μl/孔以终止反应,450 nm波长测量每孔吸光度,检测出ADPN、LP、SOD、MDA、ICAM-1的水平。
1.2.5循环内皮细胞(CEC)、血管内皮祖细胞(EPC)检测 采用流式细胞法检测CEC、EPC;抽取清晨空腹静脉血20 μl,进行抗凝处理后分为两管,其中一管加20 μl CEC单克隆抗体,另一管加入20 μl EPC单克隆抗体,在室温环境下孵育30 min后将融血剂加入至各管中,待完全溶血后行离心处理,3 000 r/min离心5 min,将上清液弃除后,使用洗涤液洗涤,之后将150 μl固定剂加入至各管中,使用0.6 ml磷酸盐缓冲液(PBS)混合均匀制备为悬液,将细胞浓度调整为1×105~1×106/ml,完成之后使用流式细胞仪检测(美国BectonDickinso公司)CEC、EPC水平,并计算CEC、EPC比值。
1.2.6VEGF-VEGFR信号通路蛋白表达量评价 采用Western印迹法检测蛋白表达量,实验步骤:将视网膜组织接种于6孔板中,24 h贴壁后各组进行处理,并使用BCA法测定浓度,制备电泳样品,上样量50 μg进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白转至聚偏氟乙烯(PVDF)膜,加入脱脂奶粉封闭1 h,一抗(1∶1 000)4℃ 孵育过夜,洗膜5 min/次,共3次,二抗(1∶4 000)室温孵育1 h,洗膜5 min/次,共3次,取重叠值。采用软件分析蛋白条带灰度值,内参蛋白为GAPDH。
1.3统计学处理 采用SPSS20.0软件进行方差齐性检验、独立样本t检验、χ2检验。
2 结 果
2.1各组病理组织学观察 如图1所示,正常组大鼠内外丛状层呈网状排列,未有毛细血管扩张、充血情况;模型组大鼠出现水肿,且结构疏松,内外颗粒层细胞排列紊乱无序,出现充血及扩张的毛细血管;药物干预后,低剂量组、中剂量组大鼠内外丛状层肿胀减轻,排列相对规整;高剂量组大鼠视网膜各层结构基本完整,未见明显水肿,内外颗粒层细胞排列相对规整,各层未见明显扩张及充血的毛细血管,内丛状层及外丛状层肿胀情况减轻,未见新生血管。
2.2各组ADPN、LP、ICAM-1比较 如表1所示,高剂量组、中剂量组、低剂量组、模型组ADPN水平均低于正常组,LP、ICAM-1水平均高于正常组,具有统计学差异(P<0.05);高剂量组、中剂量组、低剂量组ADPN水平高于模型组,LP、ICAM-1水平低于模型组,具有统计学差异(P<0.05);高剂量组、中剂量组ADPN水平高于低剂量组,LP、ICAM-1水平低于低剂量组,具有统计学差异(P<0.05);高剂量组ADPN水平高于中剂量组,LP、ICAM-1水平低于中剂量组,具有统计学差异(P<0.05)。
2.3各组CEC、EPC比较 如表1所示,高剂量组、中剂量组、低剂量组、模型组CEC水平均高于正常组,EPC水平均低于正常组,具有统计学差异(P<0.05);高剂量组、中剂量组、低剂量组CEC水平低于模型组,EPC水平高于模型组,具有统计学差异(P<0.05);高剂量组、中剂量组CEC水平低于低剂量组,EPC水平高于低剂量组,具有统计学差异(P<0.05);高剂量组CEC水平低于中剂量组,EPC水平高于中剂量组,具有统计学差异(P<0.05)。

图1 各组眼球组织病理组织学观察(HE染色,×400)

表1 各组ADPN、LP、ICAM-1、CEC、EPC比较
2.4各组VEGF-VEGFR通路蛋白表达量比较 高剂量组、中剂量组、低剂量组、模型组VEGF、VEGFR-2、β-actin水平均高于正常组,具有统计学差异(P<0.05);高剂量组、中剂量组、低剂量组VEGF、VEGFR-2、β-actin水平低于模型组,具有统计学差异(P<0.05);高剂量组、中剂量组VEGF、VEGFR-2、β-actin水平低于低剂量组,具有统计学差异(P<0.05);高剂量组VEGF、VEGFR-2、β-actin水平低于中剂量组,具有统计学差异(P<0.05)。见图2、表2。
2.5各组SOD、MDA比较 如表2所示,高剂量组、中剂量组、低剂量组、模型组SOD水平均低于正常组,MDA水平均低高于正常组,具有统计学差异(P<0.05);高剂量组、中剂量组、低剂量组SOD水平高于模型组,MDA水平低于模型组,具有统计学差异(P<0.05);高剂量组、中剂量组SOD水平高于低剂量组,MDA水平低于低剂量组,具有统计学差异(P<0.05);高剂量组SOD水平高于中剂量组,MDA水平低于中剂量组,具有统计学差异(P<0.05)。
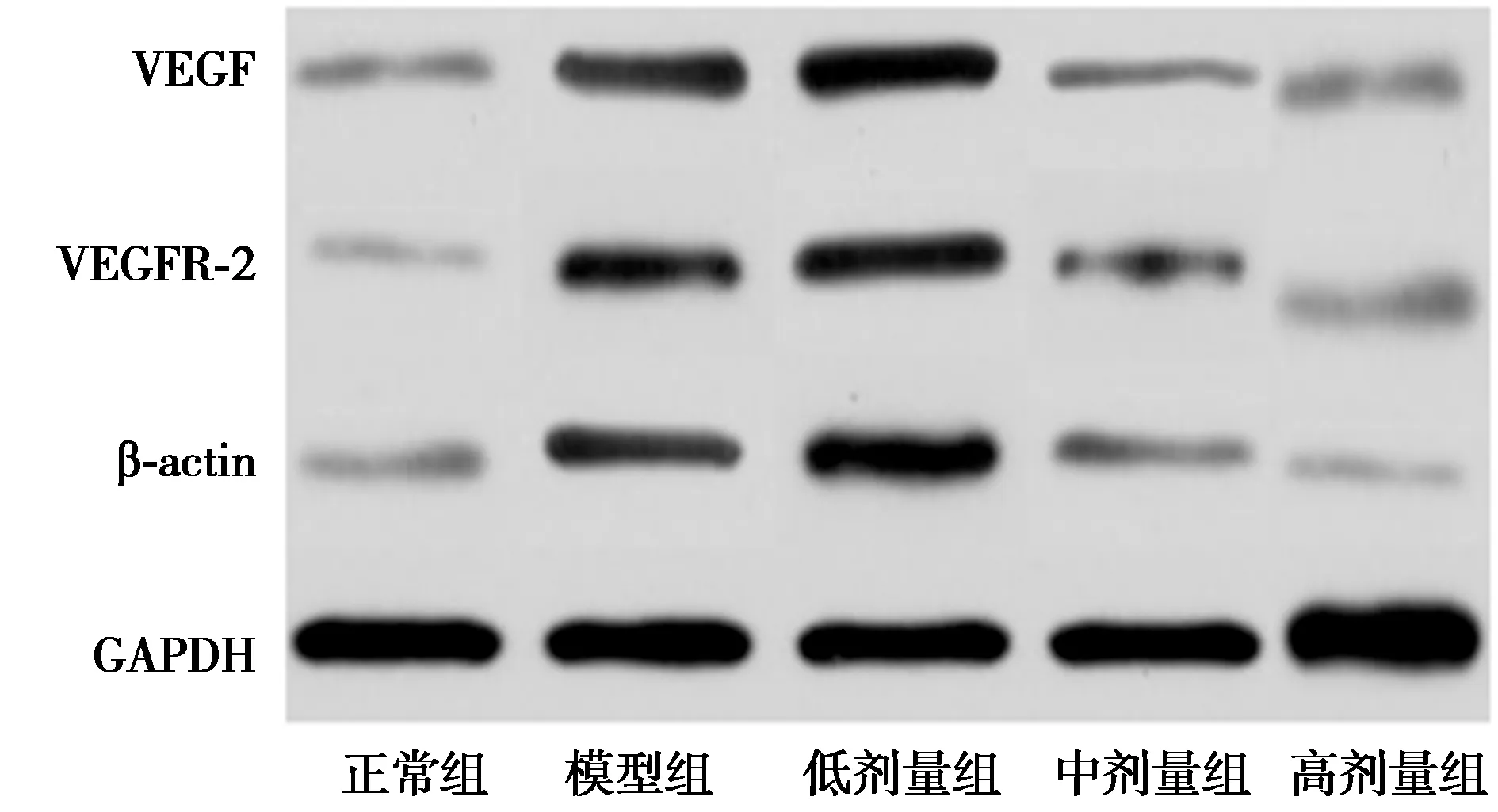
图2 各组VEGF-VEGFR通路蛋白Western印迹

表2 各组SOD、MDA水平及VEGF-VEGFR通路蛋白表达量比较
3 讨 论
糖尿病视网膜病变属于眼科疾病及内分泌疾病的一种,是糖尿病常见并发症,是神经病变及糖尿病微血管病变在视网膜中的表现,是致盲的主要原因之一〔6〕。糖尿病病程越长诱发此病的概率就越大,此病的病理改变为周细胞对视,导致微动脉瘤形成及血视网膜屏障破坏,从而造成的毛细血管及小动脉闭塞〔7〕。糖尿病视网膜病变早期的干预措施为视网膜激光光凝,一般合并视网膜脱落及玻璃体积血的患者需要进行玻璃体视网膜手术进行治疗,平时一定要注意血压及血糖的控制,从而减缓糖尿病视网膜病变的进程〔8,9〕。糖尿病视网膜病变患者若未得到及时治疗或治疗不佳时,会导致病情恶化,从而导致视力受损。
Avastin属于抗VEGF药物,可以对新生血管起到很好的抑制作用,可有利于降低血管渗透、黄斑水肿等,此外,有刘岩等〔10〕研究发现,使用Avastin后患者症状明显出现好转且视力明显上升,进一步的证实了注射Avastin的有效性及安全性,与本文研究结果一致。采取Avastin治疗可以在一定的程度上降低眼底疾病的眼压,加快视力恢复,有效降低黄斑水肿等并发症的发生率〔11〕。本研究结果显示,高剂量Avastin可更好的减少并发症的出现,促进视力恢复,改善糖尿病视网膜病变大鼠视力水平。
研究显示〔12〕,ADPN、LP、ICAM-1与糖尿病视网膜病变存在密切关联,且在糖尿病视网膜病变的发生、发展过程中可伴随疾病的进展过程改变视力变化。其中ADPN属于脂肪组织,可以存储脂肪,又有着分泌作用,是胰岛素作用的重要靶器官之一,可以参与脂类及糖类的代谢,是胰岛素免疫、敏感性、炎症等过程的重要调节因子之一,同时也是一种特异性血浆蛋白,由脂肪组织分泌,参与糖类代谢具有降血糖的作用。LP可以作为肥胖基因在脂肪的细胞中表达产物中参与能量消耗及代谢,同时还可以参与新生血管的生成〔13~15〕。ICAM-1可导致细胞毒性物质及大量细胞因子的急剧释放,由此可说明ICAM-1可以导致微血管损伤的加剧,内皮修复功能受到抑制,从而造成大量的新生血管的形成,加重糖尿病视网膜病变〔16~18〕。CEC、EPC、SOD、MDA可作为诊断糖尿病视网膜病变的客观有效指标,可参与糖尿病视网膜病变等病理过程的发生、发展和转归〔19〕,提示LP、ADPN及LP、ADPN对糖尿病视网膜病变新生血管具有重要的促进作用,CEC、EPC、SOD、MDA可作为诊断糖尿病视网膜病变的客观有效指标,以上指标的变化有利于判断糖尿病视网膜病变的严重程度。
VEGF-VEGFR通路是经典信号通路之一,其中VEGF、VEGFR-2、β-actin是VEGF-VEGFR通路中的蛋白因子,此信号通路被证实在多种疾病中存在表达失调现象,且是一条重要的调节通路〔20〕。除此之外还可以作为内皮细胞的特异性丝裂原,同时也是已知最强的血管通透剂,可以提高血管的通透性,诱导血管内皮细胞的迁移与增殖〔21〕。故在本研究中,高剂量Avastin可能通过抑制VEGF-VEGFR信号通路,下调VEGF、VEGFR-2、β-actin表达,缓解糖尿病视网膜病变的发展,有较好的治疗价值。
综上,Avastin可通过调控VEGF-VEGFR信号通路中相关重要信号传导分子的基因表达,改善糖尿病视网膜病变模型大鼠视力水平。

