过表达SIRT1对口腔癌细胞增殖、免疫应答及氧化应激的影响
毕磊 贺钊 刘辉 武燃 陈晖
(1华北理工大学附属医院口腔科,河北 唐山 063000;2唐山市第二医院麻醉科)
口腔癌是头颈部常见的恶性肿瘤之一,由于早期无明显症状,导致许多患者确诊时已发生淋巴结转移〔1〕。据统计,全球口腔癌发病率呈逐年递增的趋势,且多发于中年男性〔2〕。研究表明,口腔癌发病与长期生活作息不良、吸烟及口腔类疾病长期刺激有关〔3,4〕。目前,临床上针对口腔癌的治疗方法主要有手术治疗、放射治疗、化疗和中医中药治疗等〔5,6〕。沉默信息调节因子(SIRT)1是NAD+依赖的去乙酰化酶,通过使底物去乙酰化而参与调节细胞凋亡、免疫应答、氧化应激等生理功能〔7~10〕。研究发现,SIRT1过表达在多种肿瘤和癌细胞中发挥抑癌作用,如SIRT1过表达通过增强局部炎症反应抑制乳腺癌细胞生长〔11〕,SIRT1过表达通过抑制p65乙酰化抑制炎症细胞因子激活的诱导型一氧化氮合酶(iNOS)产生,破坏间质干细胞免疫抑制能力12,SIRT1过表达通过抑制核转录因子(NF)-κB信号传导减弱骨桥蛋白诱导的非小细胞肺癌细胞增殖、侵袭和迁移〔13〕等。但SIRT1过表达在口腔癌中的研究鲜见报道,本研究通过口腔癌CAL27细胞转染SIRT1过表达,检测SIRT1过表达对CAL27细胞增殖、免疫应答及氧化应激水平的影响。
1 材料与方法
1.1细胞、试剂及仪器 人口腔癌细胞CAL27由中国科学院上海细胞生物研究所提供,pcDNA过表达质粒和载体购自上海艾博思生物技术有限公司。转染试剂Lipofectamine®2000购自美国CST公司(货号11668030),反转录-聚合酶链反应(RT-PCR)试剂盒、Trlzol试剂盒和二喹啉甲酸(BCA)提取试剂盒购自北京索莱宝科技有限公司(货号RP1100、RP2401、PC0020),酶联免疫吸附试验(ELISA)试剂盒购自北京迈瑞达科技有限公司(货号MF01544、MF01310、MF01360、MF01963、MF16742、MF16113),10%胎牛血清和DMEM培养基购自美国Gibco公司(货号10100147、10313039),兔抗鼠SIRT1单克隆抗体(ab32441)、兔抗鼠含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3多克隆抗体(ab13847)、大鼠p21单克隆抗体(ab107099)、兔抗鼠NF-κB p65多克隆抗体(ab16502)、兔抗鼠活性氧(ROS)单克隆抗体(ab238986)及辣根过氧化物酶(HRP)标记的对应山羊抗兔免疫球蛋白(Ig)G均购自美国Abcam公司。GeneAmp PCR系统9700、ABI7500 Real-Time PCR系统(Applied Biosystems);酶标仪(Rayto,RT6100),台式高速离心机(大龙,D3024R),成像系统(上海天能科技有限公司,Tanon-1600R),光学显微镜(日本尼康,Nikon Eclipse E100)。
1.2细胞培养及转染 口腔癌细胞CAL27置于含10%胎牛血清的DMEM培养基中,5%CO2、37℃培养箱中培养至对数生长期后用于实验研究。按照转染试剂Lipofectamine®2000说明书将pcDNA过表达质粒和空载体转染至CAL27细胞中,转染24 h后,收集细胞进行后续实验。CAL27细胞分为对照组、阴性对照组和SIRT1过表达组,阴性对照组和SIRT1过表达组按照转染试剂Lipofectamine2000说明书将空载体和pcDNA SIRT1过表达质粒转染至CA127细胞中,对照组不转染,24 h后收集细胞进行后续实验。
1.3RT-PCR检测SIRT1 mRNA表达水平 选择对数生长期的CAL27细胞,经胰酶消化处理后收集细胞悬液,用Trlzol试剂盒提取细胞总RNA,测定RNA浓度和纯度。按逆转录试剂盒说明书进行逆转录合成cDNA,按RT-PCR试剂盒操作说明配制反应体系。在PCR扩增仪上进行扩增(扩增条件:保持步骤96℃ 15 s,和40个循环95℃ 10 s和60℃ 30 s)采用2-ΔΔCt法分析结果。独立重复实验3次,取平均值。SIRT1上游引物:5′-TGCGGGAATCCAAAGGATAATTCA-3′,下游:5′-CTT-CATCTTTGTCATACTTCATGGCT-3′;GADPH上游引物:5′-GGAGCGAGATCCCT-CCAAAAT-3′,下游:5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.4克隆形成实验检测细胞生长 收集各组生长至对数生长期的细胞,经胰酶消化后制备细胞悬液,将细胞按梯度倍数进行稀释并接种至培养皿中,培养2~3 w,至肉眼可见克隆时终止培养,弃上清液,结晶紫染色液染色10~20 min,选取培养皿拍照计数,克隆形成率=(克隆数/接种细胞数)×100%。
1.5Western印迹检测SIRT1、caspase-3、P21和p-P65蛋白水平 取各组对数生长期的CAL27细胞,胰酶消化处理细胞。用RIPA蛋白裂解液提取细胞总蛋白,BCA蛋白浓度测定试剂盒测定细胞蛋白浓度,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转模、脱脂奶粉封闭后,加入抗体SIRT1(1∶200)、caspase-3、p21、P65(1:500),4℃孵育摇床过夜。回收一抗,加入按比例稀释HRP标记的对应二抗(1∶5 000),室温孵育2 h。采用电化学发光(ECL)法于暗室下曝光显影(GADPH作内参)。将胶片进行扫描存档,PhotoShop整理去色,Alpha软件分享光密度值。独立实验重复3次,取平均值。
1.6ELISA检测iNOS、白细胞介素(IL)-6、IL-10含量 收集各组对数生长期的CAL27细胞,制备细胞悬液,4℃、10 000 r/min条件下离心15 min,取上清液,按ELISA试剂盒操作说明书测定iNOS、IL-6、IL-10、超氧化物歧化酶(SOD)、丙二醛(MDA)和乳酸脱氨酶(LDH)含量,酶标仪下测450 nm处吸光值,(实验组OD450-空白组OD450)/(对照组OD450-空白组OD450)×100%,重复实验3次,取平均值。
1.7免疫荧光检测ROS含量 取对数生长期细胞,接种至24孔板中,待细胞贴壁爬片后吸取培养基,用提前预热的0.01 mol/L磷酸盐缓冲液(PBS)洗涤3次,用4%多聚甲醛室温固定15 min,加入0.01 mol/L PBS洗涤3次,加入3%牛血清白蛋白(BSA)封闭液,37℃条件下封闭1 h。弃封闭液后加入ROS一抗(1∶300),4℃孵育过夜。0.01 mol/L PBS液洗涤3次,加入对应的二抗(1∶100)室温孵育2 h后加入0.01 mol/L PBS洗涤3次。10 μmol/L DCFH-DA室温标记15 min,PBS洗涤3次,荧光封片后显微镜下观察。独立重复实验3次,取平均值。
1.8统计学分析 采用SPSS17.0软件进行方差分析、LSD法。
2 结 果
2.1SIRT1过表达效率 与对照组相比,阴性对照组SIRT1 mRNA及蛋白表达水平无明显差异(P>0.05),SIRT1过表达组SIRT1 mRNA及蛋白表达水平显著上调(P<0.05)。见表1、图1。提示过表达体系构建成功。
2.2SIRT1过表达对CAL27细胞生长的影响 与对照组〔(32.21±6.88)%〕相比,阴性对照组克隆形成率〔(35.45±7.82)%〕无明显差异(P>0.05),SIRT1过表达组细胞克隆形成率〔(6.46±4.73)%〕明显降低(P<0.05)。见图2。
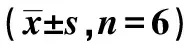
表1 RT-PCR和Western印迹检测各组细胞SIRT1 表达水平

图1 Western印迹检测各组细胞SIRT1表达水平
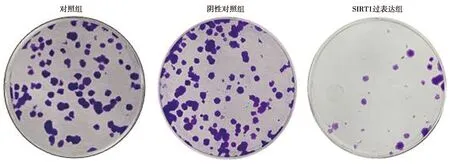
图2 克隆形成实验检测各组SIRT1转染后的细胞增殖(结晶紫染色)
2.3SIRT1过表达对CAL27细胞凋亡的影响 与对照组相比,阴性对照组细胞中Cleaved caspase3/caspase3和p21表达水平无明显差异(P>0.05),SITR1过表达组Cleaved caspase3/caspase3和p21表达水平明显上调(P<0.05)。见表2、图3。
表2 SIRT1过表达对CAL27细胞凋亡相关蛋白表达、iNOS、IL-6和IL-10水平及 p-P65蛋白磷酸化的影响
2.4SIRT1过表达对CAL27细胞免疫因子表达水平的影响 与对照组相比,阴性对照组细胞上清液中iNOS、IL-6和IL-10含量无明显变化(P>0.05),SIRT1过表达组细胞上清液中iNOS和IL-6含量明显降低,IL-10含量明显升高(P<0.05)。见表2。
2.5SIRT1过表达对CAL27细胞中p-P65表达水平的影响 与对照组相比,阴性对照组细胞中p-P65/P65蛋白表达水平无明显差异(P>0.05),SIRT1过表达组细胞中p-P65/P65蛋白表达水平明显降低(P<0.05)。见表2、图4。
图3 Western印迹检测Cleaved caspase3/caspase3和 p21蛋白表达水平
2.6SIRT1过表达对CAL27细胞氧化应激的影响 与对照组相比,阴性对照组SOD、MDA和LDH含量无明显差异(P>0.05),SIRT1过表达组SOD含量明显降低,MDA和LDH含量水平明显升高(P<0.05)。见表3。
2.7SIRT1过表达对CAL27细胞ROS活性氧含量水平的影响 与对照组〔(6.92±2.44)U/ml〕相比,阴性对照组细胞中ROS含量〔(7.48±2.13)U/ml〕无明显差异(P>0.05),SIRT1过表达组细胞ROS活性氧含量〔(26.67±3.58)U/ml〕明显增高(P<0.05)。见图5。
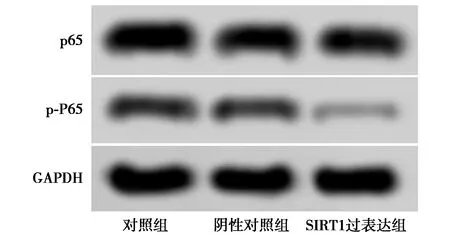
图4 Western印迹检测各组细胞中p-P65/P65 蛋白表达水平
表3 SIRT1过表达对CAL27细胞氧化应激的 影响

图5 免疫荧光检测各组ROS含量(×400)
3 讨 论
研究表明,SIRT1表达水平对口腔癌的病理生理改变具有重要影响,SIRT1表达下调促进口腔癌细胞增殖、侵袭转移,而SIRT1稳定表达或表达上调则抑制口腔癌细胞增殖、侵袭转移,同时SIRT1表达上调能够诱导口腔癌上皮细胞中E-cadherin表达并抑制转化生长因子(TGF)-β介导的口腔癌恶性转化、侵袭和转移〔14~16〕。本研究结果发现,过表达SIRT1显著抑制CAL27细胞增殖,促进细胞凋亡和氧化应激,调节细胞免疫应答。
口腔癌的发生发展依赖于癌细胞增殖、侵袭和转移等过程。p21是近年来发现的细胞周期蛋白依赖性激酶抑制剂家族成员之一,p21与肿瘤增殖、分化和转移密切相关,研究发现,p21在口腔癌细胞中表达上调导致口腔癌细胞中G0/G1细胞周期停滞,抑制细胞增殖,并诱导细胞凋亡〔17,18〕。caspase-3是细胞凋亡执行蛋白,在细胞凋亡过程中,上游的caspase-9启动caspase-3并发生级联反应,诱发细胞凋亡〔19〕。本研究结果显示,过表达SIRT1显著上调p21和caspase-3表达水平,结合克隆形成实验结果进一步说明过表达SIRT1抑制口腔癌细胞增殖并诱导细胞凋亡。
iNOS、IL-6和IL-10是重要的多功能细胞因子,参与调节细胞生长分化、炎症、免疫反应等,与多种肿瘤发生发展密切相关。大量研究表明,IL-6通过调节细胞间的黏附力、活动力及肿瘤细胞特异性抗原的表达而影响肿瘤的发生发展〔20〕。Singh等〔21〕发现,iNOS表达增加可作为口腔鳞状细胞癌的早期诊断指标,同时也是口腔鳞状细胞癌的预后指标。IL-10是一种免疫调节细胞因子,具有抗炎症、免疫抑制、抗衰老等生物学功能。研究表明,IL-10在口腔癌细胞中高表达抑制癌细胞免疫能力,同时,IL-10高表达促进癌细胞增殖、侵袭和转移〔22〕。p65是天然的参与调控细胞免疫、炎症反应的转录因子〔23〕。本研究结果提示,过表达SIRT1通过调节口腔癌细胞中细胞因子表达水平参与口腔癌细胞免疫反应。
氧化应激与癌症发生发展密切相关,SOD是氧自由基清除酶,在氧化与抗氧化平衡过程中发挥重要调控作用。MDA和ROS是细胞线粒体损伤和氧自由基积累的主要产物,过量的MDA和ROS能损坏细胞正常功能,并诱导细胞凋亡或坏死。LDH含量水平常作为诊断恶性肿瘤转移的重要指标〔24,25〕。本研究结果提示,过表达SIRT1通过诱导口腔癌细胞CAL27氧化应激反应,促使细胞凋亡。
综上,过表达SIRT1抑制口腔癌细胞CAL27生长,调节细胞免疫反应,并促进细胞凋亡和氧化应激。后续实验计划通过移植瘤动物模型探讨过表达SIRT1在体外的效果。

