六西格玛管理法在医疗器械临床试验质量控制中的应用
张晓燕,武丽,韩安轲,王学军,朱丹丹
1 内蒙古自治区人民医院医学工程处 (内蒙古呼和浩特 010017);2 内蒙古医科大学计算机信息学院 (内蒙古呼和浩特 010017)
医疗器械作为临床诊断、治疗、疾病防控、公共卫生和健康保障体系中重要的基础装备,上市前需确保其安全性和有效性[1]。临床试验则是验证其安全性和有效性的核心方法之一,临床试验数据是否真实、可靠是医疗器械上市的重要依据,因而临床试验质量控制工作尤为重要[2]。六西格玛管理法是目前较为先进且具有代表性的质控模式,按照定义、测量、分析、改进、控制5个步骤对现有产品、过程、服务的绩效进行改善,从而制订有针对性的问题解决方案[3-4]。六西格玛管理法被广泛应用于企业管理、生产工艺、物流业、医院等一切“过程”领域,包括流程改进、流程设计/再设计及流程管理等[5-10]。将六西格玛管理法运用于医疗器械临床试验的质量控制中,可以精准地确定目标、找出原因,进而有效规范临床试验质控工作,降低问题发生率,提高临床试验质量。本研究通过归纳、分析医疗器械临床试验质量控制过程,并运用六西格玛管理法优化质控流程,以期提高医疗器械临床试验机构质控效率,提升临床试验质量。
1 资料与方法
1.1 研究对象
我院开展的药物涂层球囊(drug-coated balloon,DCB)治疗冠脉疾病临床试验项目较多(共7项),故本研究以药物涂层球囊临床试验项目为研究对象。选取药物涂层球囊临床试验项目2021年5—10月的150份质控报告数据为对照组,2021年11月至2022年4月的150份质控报告数据为观察组。其中对照组采用传统管理模式,观察组采用六西格玛管理模式,对质控管理中的问题进行汇总、分析。
1.2 研究方法
1.2.1 文献调研法
以英文关键词“Six Sigma”“clinical trial”“medical equipment”“quality control”及中文关键词“六西格玛”“临床试验”“医疗器械”“质量控制”等对PubMed、中国知网、万方数据库等进行检索发现,六西格玛管理法应用于医疗器械临床试验质控过程的研究较少。
1.2.2 问卷调查法
采用“问卷星”软件制作问卷,并通过微信、朋友圈等方式发布问卷,对研究者、申办方、临床监查员(clinical research associate,CRA)、临床研究协调员(clinical research coordinator,CRC)及受试者等人员进行问卷调查,了解临床试验质量控制中存在的问题及相关人员对质量控制的需求,收集意见和建议,寻找解决方案[11]。
1.2.3 六西格玛管理法
一是定义阶段:通过确定目标需求,制订六西格玛管理流程优化的实施计划,加强研究团队的专业素养和责任意识,降低质控问题的发生率,提高临床试验的质控效率及项目质量。
二是测量阶段:对DCB 临床试验项目的质控过程及质控报告进行回顾性分析和数据整理,找出影响临床试验质控的人员、DCB、方法、记录、设备5个方面的因素。
三是分析阶段:根据头脑风暴法分析结果画出导致DCB 临床试验项目质控问题较多的鱼骨图(见图1),确定影响临床试验质量控制流程的相关因素。
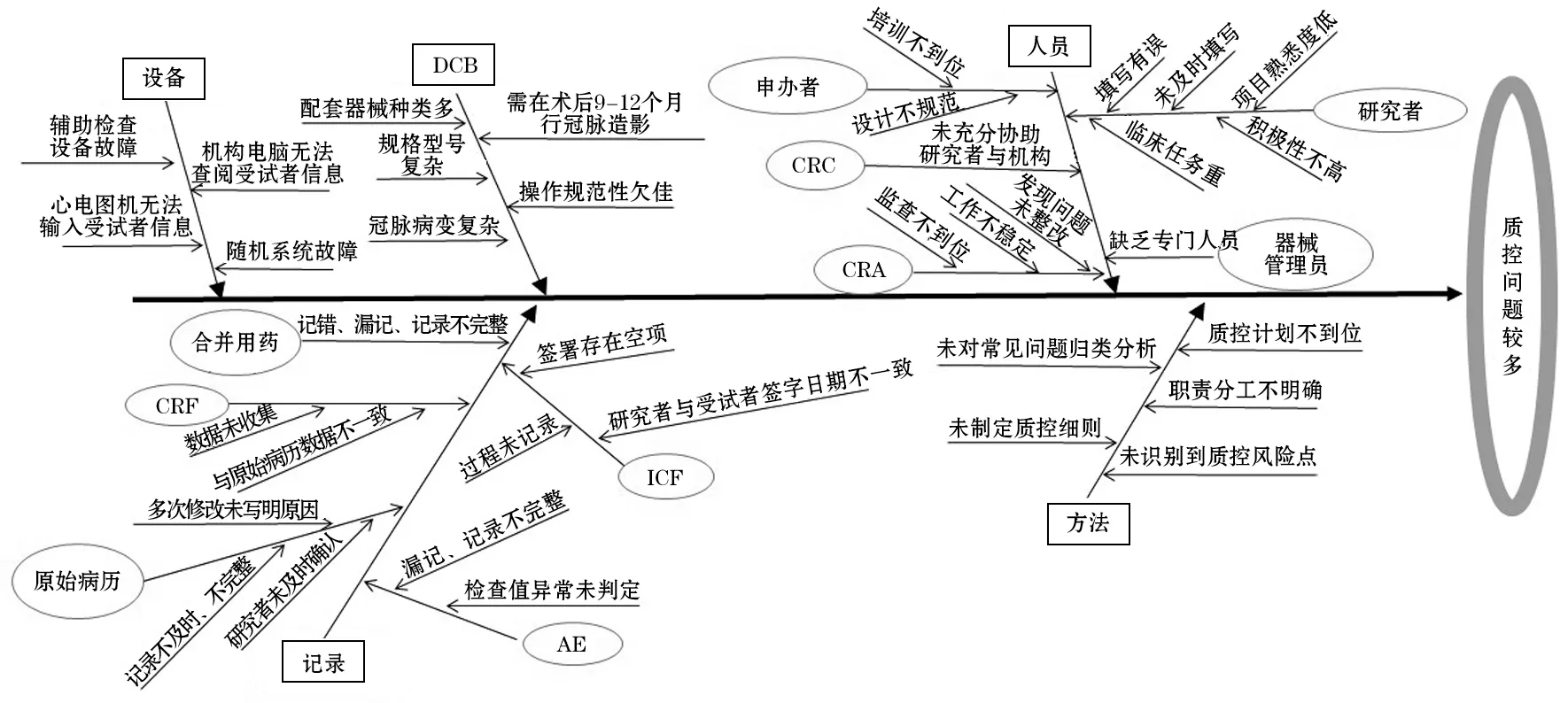
图1 药物涂层球囊临床试验项目质控问题较多的鱼骨图
从传统质控报告的帕累托分析结果(见图2)可以看出,病例报告表(case report form,CRF)填写问题、不良事件(adverse event,AE)和合并用药记录问题、原始病历记录问题、知情同意书(Informed Consent Form,ICF)签署问题占全部临床试验质量控制问题的90.77%,由此得出,原始病历、ICF、CRF、AE 及合并用药方面的问题为影响临床试验质量控制的重要因素。
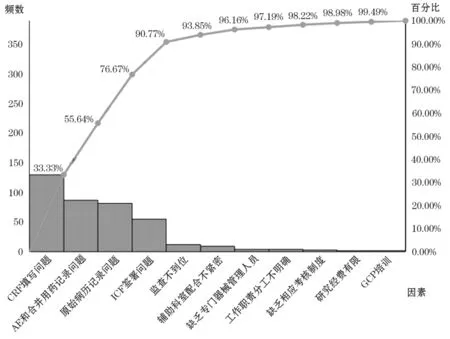
图2 医疗器械临床试验质量控制问题帕累托分析
四是改进阶段:针对分析阶段得出的重要影响因素,结合医院的实际工作及资源分配情况,与临床试验相关人员进行讨论,并优化组织框架,质控员分配到相应的临床科室,更有针对性地进行项目质控;对心内科进行培训,包括医疗器械临床试验质量管理规范及常见问题、不同试验阶段的质控要点,并联合申办方及技术人员对试验器械的规范使用进行培训;针对主要影响因素制定相应的改进措施,优化质控运行方案(见表1);细化质控要点,将宽泛的检查表细化为更具针对性的质控检查表;为临床科室制作项目口袋卡及手册,粘贴于导管室及医生办公室等位置。
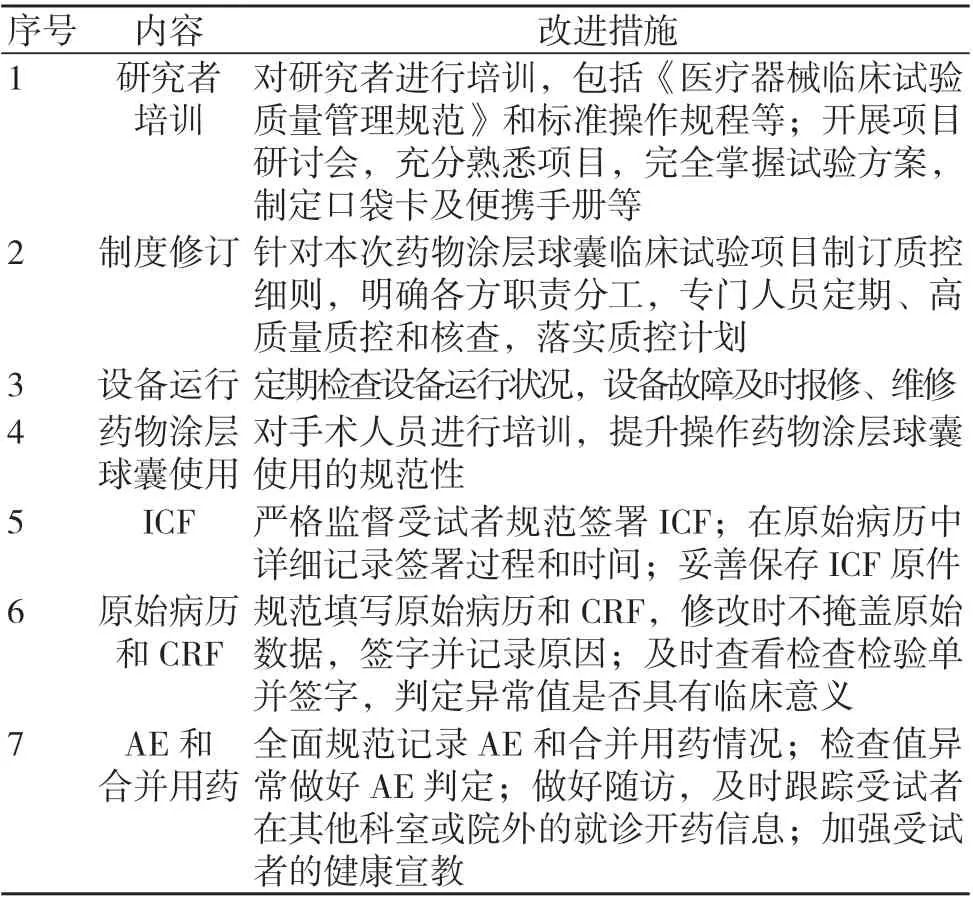
表1 药物涂层球囊临床试验质控流程优化运行方案
五是控制阶段:重新修订临床试验质量控制相关规章制度、工作职责、标准操作规程、质控流程(见图3)及质控细则,尤其是在质控时间点、质控重点内容和质控资料3方面做出系统规划,重点加强主要问题环节的质控和监督力度,做到日常检查、定期抽查、分析调整,形成质量持续改进的良性循环。
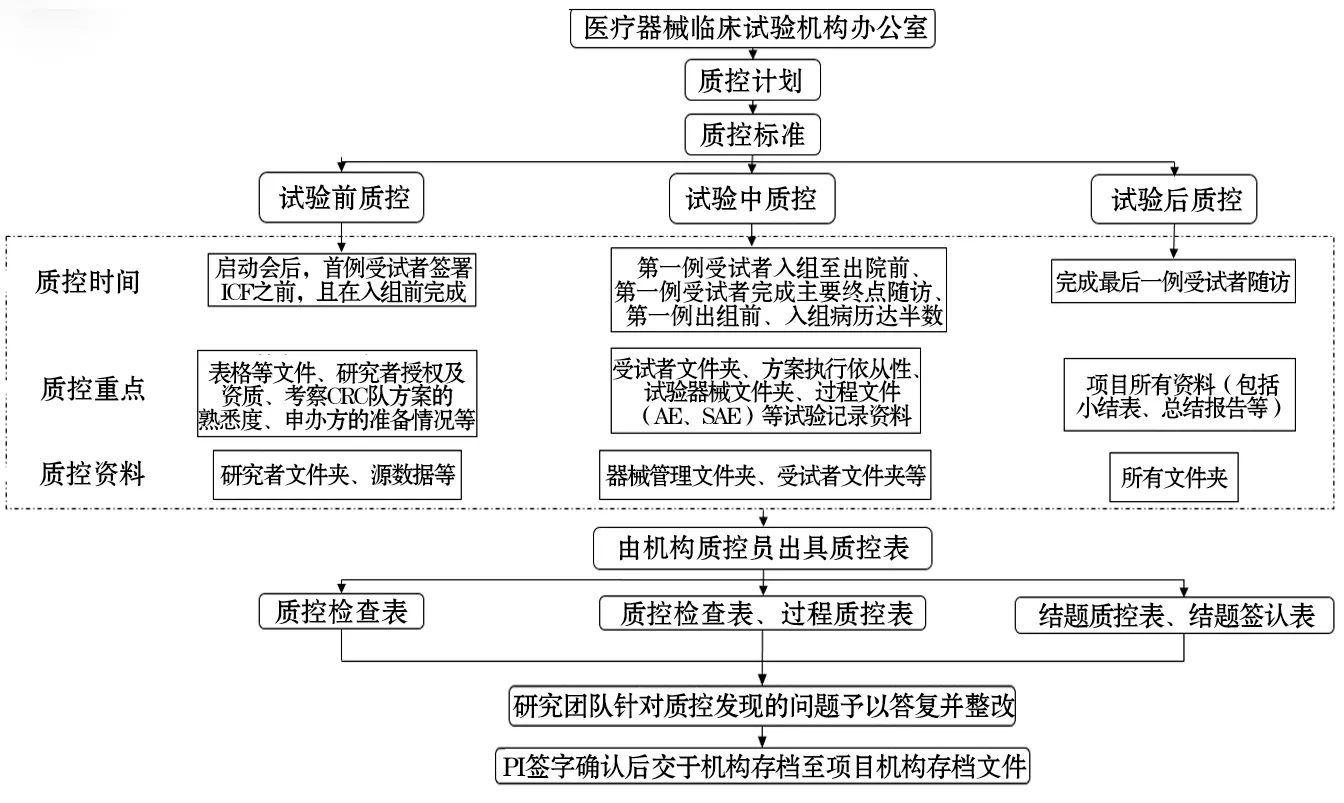
图3 优化后的医疗器械临床试验质量控制流程图
1.3 评价方法
比较六西格玛管理法实施前后临床试验质控问题出现率与临床试验相关人员满意度。满意度评价方法:由30 名临床试验相关人员(均接受过《医疗器械临床试验质量管理规范》培训)填写自制满意度调查问卷,该问卷内容包括临床试验规范化程度、对受试者保护重视程度、方案设计质量、知情同意书设计质量、病例报告表设计质量5个方面,均采用李克特5 级评分法进行评分,25 分为非常满意,16~24 分为比较满意,15 分及以下为不满意;满意度=(非常满意人数+比较满意人数)/总人数×100%。
1.4 统计学处理
对300份质控报告进行回顾性分析,采用SPSS 23.0统计软件进行数据分析,计数资料以率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 六西格玛管理法实施前后质控问题出现情况比较
如表2所示,实施前后临床试验质控问题出现率比较,差异有统计学意义(P<0.05)。
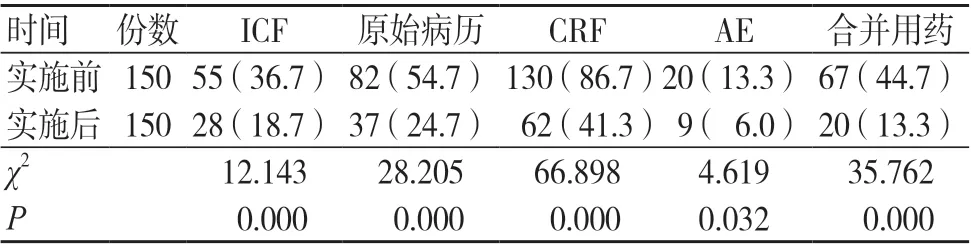
表2 六西格玛管理法实施前后临床试验质控问题出现率[份(%)]
2.2 六西格玛管理法实施前后临床试验相关人员满意度比较
如表3所示,实施前后对临床试验相关人员满意度比较,差异有统计学意义(P< 0.05)。

表3 六西格玛管理法实施前后临床试验相关人员满意度[名(%)]
3 结论
医疗器械临床试验的质量不仅依赖于临床试验方案的设计,更取决于试验数据的真实性、可靠性[12-13],而有效、高质量的临床试验质量控制工作是确保临床试验质量的必要条件,具体包括3点:(1)完善机构内部组织框架,强化机构内部管理,充分发挥机构工作的主观能动性;(2)严格依照相关规章制度、工作职责、标准操作规程、质控流程及质控细则做好质控工作,并保持常态化运行;(3)将提高研究团队临床试验意识作为重点,加强科室人员培训,并不定期对科室人员进行考核及再培训等。
我院通过在临床试验质控工作中引入六西格玛管理法,有效降低了质控问题的发生率,临床试验质量得到了很大提升。但这是一个持续改进的过程,需要在实际工作中不断完善[14]。另外,医疗器械临床试验项目管理未能实现信息化,在一定程度上影响了质量控制工作的周期及效率。下一阶段的改进计划是扩大研究对象范围,争取推广至全院开展临床试验的科室,并实现项目的信息化管理。

