单细胞转录组测序技术及其在动物繁殖中的应用进展
刘源壹,李昕俞,巴音那木拉,翠 芳,芒 来,杜 明*
(1.内蒙古农业大学动物科学学院,内蒙古自治区马属动物遗传育种与繁殖学重点实验室,呼和浩特 010018;2.内蒙古赤峰市阿鲁科尔沁旗动物疫病预防控制中心,赤峰 025550)
繁殖是所有生命都具备的生理现象[1-3],指动物通过生殖活动产生后代[4]。动物繁殖能力是衡量动物生产性能的重要指标之一,在动物生产的经济效益中起主导地位[5]。在动物繁殖过程中,生殖细胞的动态变化和相关基因的表达对其起到了关键的调控作用。转录组(transcriptome)是指由细胞在某一特定的阶段转录出来的全部产物,包括编码RNA和非编码RNA[6-8]。当同一细胞位于不同的生命进程及生长环境时,其基因的表达状态也有所不同。这就导致了转录组研究的特殊之处,即存在时间和空间上的多维度差异,进而促使基因间构成庞大且复杂的调控网络。转录组信息的深入发掘对基因调控网络互作关系的解读至关重要。单细胞转录组测序技术(single cell RNA sequencing,scRNA-seq)是指在单个细胞水平对mRNA进行高通量测序,其基于单细胞、高通量的特点,解决了对于细胞分子机制研究中常见的细胞异质性、细胞量少而无法进行常规高通量测序等问题[9-11]。随着单细胞转录组测序技术的发展,越来越多的研究者开始将这一技术引入到动物繁殖的研究中,使得对生殖细胞的研究也逐渐深入。单细胞转录组测序技术可以对不同生殖细胞进行类型鉴定、群体分类以及各种关键基因及通路的筛选等,上述方法对深入研究动物繁殖机制,提高动物繁殖能力,增加动物生产的经济效益起到了重要作用。
1 单细胞转录组测序技术的发展
1.1 发展历史
在单细胞中对mRNA转录组学进行基于高通量测序且完全无偏倚的研究方法于2009年被Tang等[12]首次发表,这也是单细胞转录组测序技术的关键性开端。然而该技术存在只能对单个细胞进行转录组描绘的不足。为了进一步提高测序方法的应用范围,Islam等[13]于2011年研发了单细胞标记的反转录测序技术STRT-seq (single-cell tagged reverse transcription sequencing)。这是一种通量更高的方法,先将细胞分离到96孔板中,再利用链转化原理给每个细胞加入具有特异性的条形码,从而能够大规模检测各种混合细胞样本。
2012年出现了一项具有里程碑意义的技术,由美国和瑞典的科学家共同开发的能够从单细胞生成全长cDNA的测序方法Smart-seq(switching mechanism at 5′end of the RNA transcript)[14],进一步增加了转录本序列的覆盖度。但这种方法的缺点是不能高效转录超过4 kb的序列,且具有转录本长度偏向性[15-16]。同一年,Hashimshony等[17]开发出了一种采用体外转录代替 PCR 达到扩增目的的测序方法,即CEL-seq (cell expression by linear amplification and sequencing)。该方法采用线性扩增构建cDNA文库虽然具有扩增偏好的缺点,但是其测序结果更加准确[18]。为了达到对许多不同单细胞进行研究和多重分析的目的,此方法也添加了相应的特异性标签。2013年,Picelli等[19]对Smart-seq技术进行了进一步的改进,开发出Smart-seq2并逐渐成为研究者们常用的测序方法之一。正是有了上述几种标志性测序方法的出现,又随着无数研究者对方法进行不断的完善、发展和改进,单细胞转录组测序逐渐实现了更高的通量,更广泛的应用,更自动化的操作以及更高的效率,逐渐成为当下解决诸多生物学问题的有效方法之一。
1.2 发展趋势
随着第二代测序技术(next generation sequencing,NGS)和第三代测序技术(third generation sequencing,TGS)的飞速发展,单细胞转录组测序技术已经成为现代生命科学研究中不可或缺的有力工具[20-23]。测序数据能够揭露出细胞群体的内在异质性,并随着其在分离、标记、通量和深度等方法上的进步,以及人们对单细胞转录组测序技术的研究越来越系统,生物制药和生物技术公司开发市场产品的规模将会持续增长。根据中研普华产业研究院的《2021—2026年全球及中国单细胞测序行业发展调研及投资前景分析报告》统计分析显示(图1),全球市场应用单细胞测序规模自2015年起呈现逐年上升的趋势,预计在2026年可以达到77.62亿美元的应用规模。
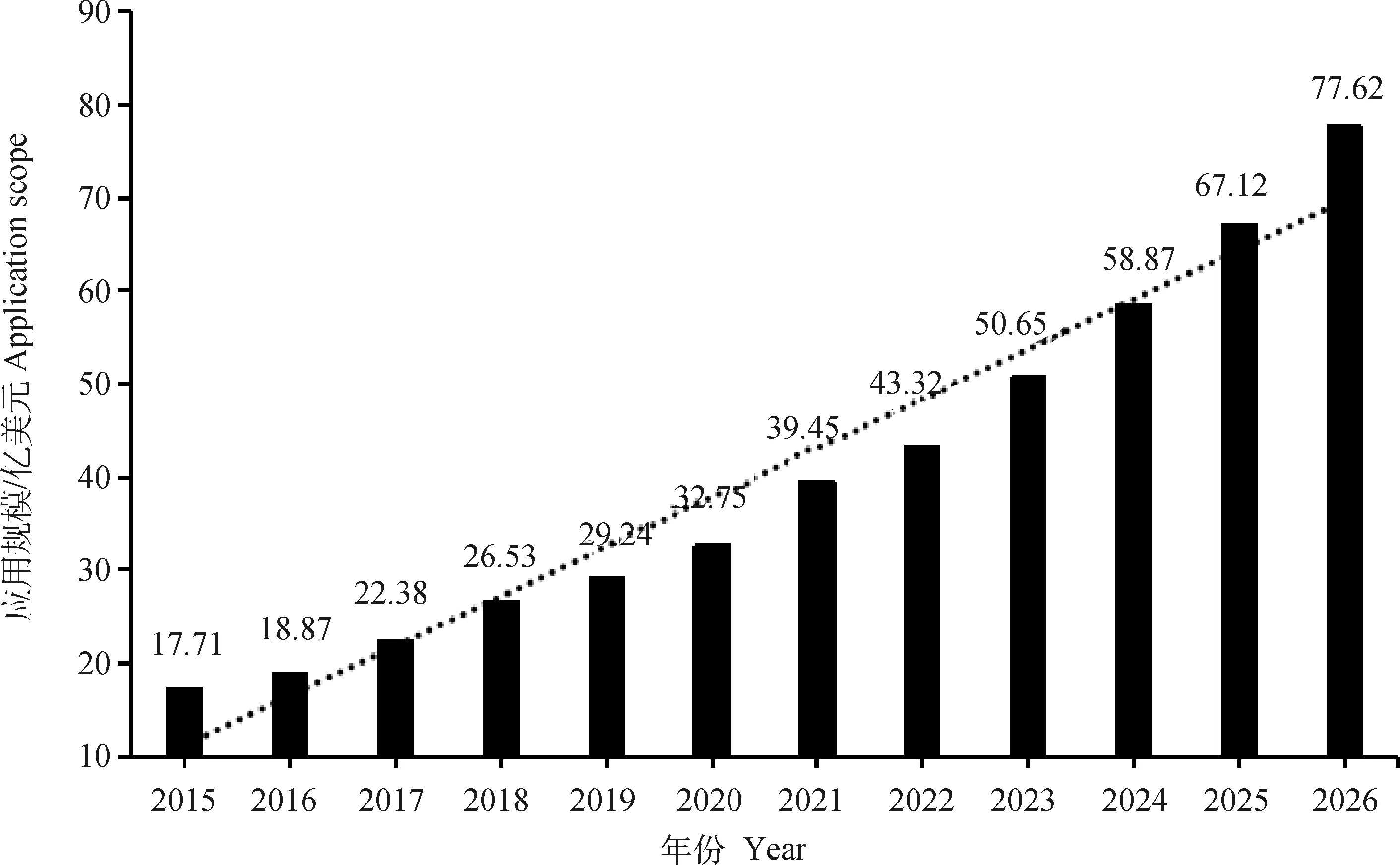
图1 2015—2026年全球市场不同应用单细胞测序规模对比
近年来,单细胞测序相关研究的文献数量也呈指数式增长的趋势,截止到2022年4月,在Pubmed中以“scRNA-seq”为检索词进行文献检索发现已发表超过2 500篇以上与单细胞测序相关的文献(图2)。该技术已广泛应用于如免疫系统,大脑、神经系统,上皮组织,生殖发育,癌症等相关的科研工作当中。
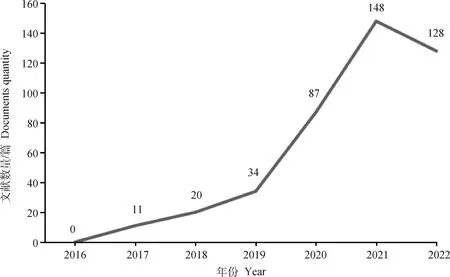
图2 2016—2022年单细胞转录组测序相关文献发表情况
2 单细胞转录组测序相关技术的比较
2.1 单细胞分离方法的比较
单细胞转录组测序过程中首要的步骤即单细胞分离(表1),其质量的高低无疑关乎到后续的测序是否成功。常用方法包括:1)口吸管技术[24]:通过人工方法利用安装有显微针的口吸管对单个细胞进行分离。2)激光捕获显微切割技术(laser capture microdissection,LCM)[25]:利用计算机辅助的激光系统将单个细胞从固体组织中分离出来。3)流式细胞仪技术(fluorescence-activated cell sorting,FACS)[26]:通过计算机系统和荧光染色技术达到对细胞进行分选的目的。4)微滴(microdroplets)[27]:用含有特定条码(barcode)的微升级别的液滴将单个细胞进行包裹。5)微流控(microfluidics)[28]:是一种使用微通道处理或操控微小流体的技术。以上几种方法各有利弊,在实际应用的选择当中,研究人员应当基于样品的差别对不同的单细胞分离方法进行相适应的合理选择,这样才能更好的完成更进一步的测序工作。
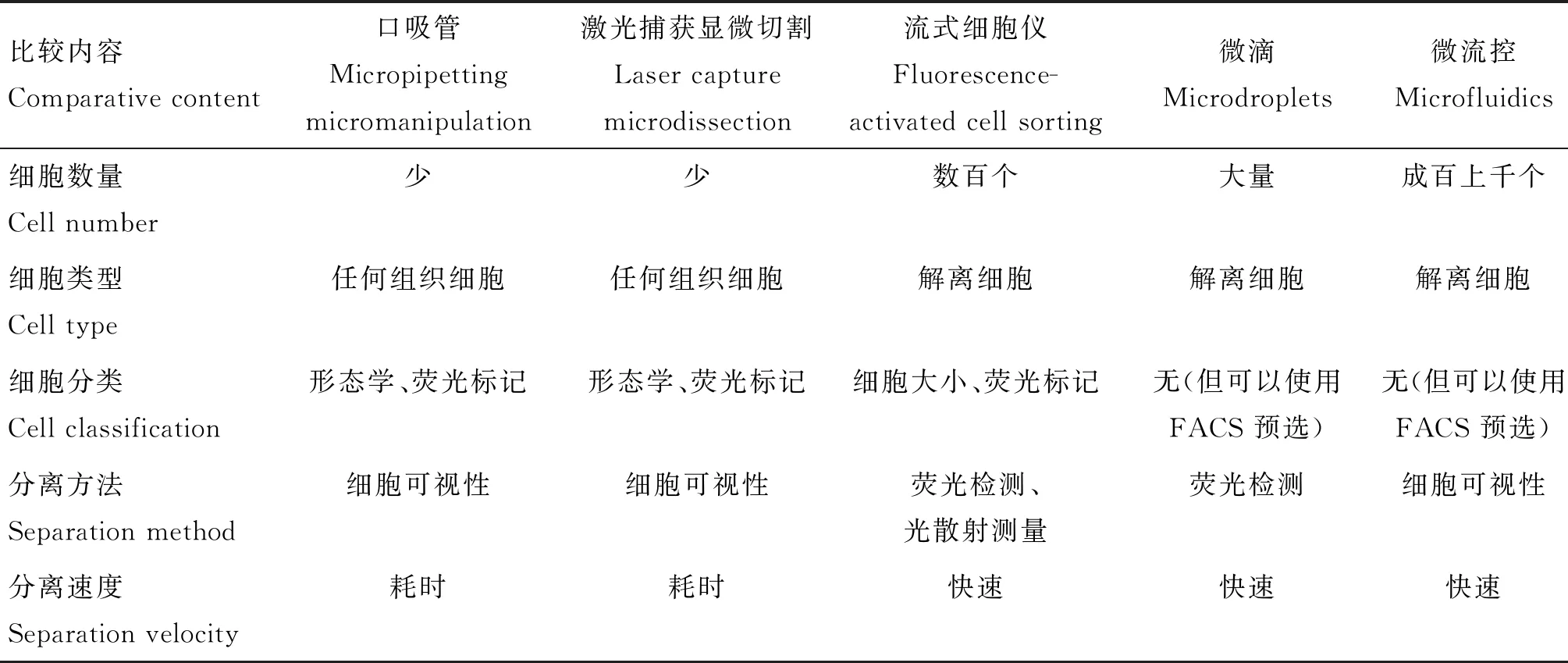
表1 不同单细胞分离方法的比较(修改来自文献[29])
2.2 单细胞转录组测序方法的比较
单细胞转录组测序技术发展至今虽然有着诸多不同的方法,但其测序流程都基本相似(图3)。不同的测序方法存在的差异性往往可以从以下几方面来分析(表2):单细胞的分离方法,反转录后的扩增方法,转录组覆盖度,链是否具有特异性,是否被独特的分子标识符(UMI)识别等。Ziegenhain等[30]通过从583只小鼠胚胎干细胞中提取的数据,详细比较了CEL-seq2、Drop-seq、MARS-seq、SCRB-seq、Smart-seq和Smart-seq2这6种scRNA-seq经典方法的优、缺点,结果表明虽然Smart-seq2检测到每个细胞和跨细胞的基因最多,但CEL-seq2、Drop-seq、MARS-seq和SCRB-seq由于使用独特的分子标识符UMI而量化了mRNA水平,扩增噪声较小。不同测序深度的功率模拟试验表明,Drop-seq在分析大量细胞的转录组时更有效,而MARS-seq、SCRB-seq 和Smart-seq2在分析较少的细胞时更有效。研究为不同方法之间的选择提供了基础,为进一步改进不同方案提供了一个基准框架。西班牙国家基因组分析中心对13种单细胞RNA测序方法开展了性能评估[31]。该研究团队采用了人外周血、小鼠结肠和少量其他细胞系的细胞混合物,在世界上不同的实验室对13种技术开展了基因检测灵敏度、分群、比对率等各方面的比较。最终结果表明,低通量技术中Quartz-seq2、Smart-seq2和CEL-seq2表现出色,而高通量技术中10× Chromium的表现最好。Chen等[32]详细介绍了单细胞转录组测序技术的一些经典方案以及scRNA-seq单细胞分离技术,并讨论不同单细胞转录组测序方案的数据分析,包括质量控制、基因表达量化、批次效应校正、规范化、降维、特征选择、细胞聚类、轨迹推理基因调控网络重构等。Townes等[33]将单细胞转录组测序技术与一般的转录组测序技术(bulkRNA-seq)进行了比较,明确了两者的差异即分析的数据精度不同,前者在单个细胞水平上构建每个细胞的表达谱,而后者获得的是一个大的细胞群体中单个基因的平均表达水平。这对相应方案的选择起到了指导性的作用。

图3 单细胞转录组测序基本流程[34-36]

表2 不同单细胞转录组测序技术方法的差异[37-40]
对于单细胞转录组测序研究中需要选择的不同方法,应该主要考虑的是实际研究的具体情况,包括选择全长还是基于UMI的方法;细胞数量;测序的读取片段(reads)等[41-45]。目前,细胞图谱类的研究由于要测大量的细胞(>10 000),因此常采用UMI方法,测序深度约为100万的reads。该类研究主要是细胞分类和标记基因的鉴定,因此UMI信息是足够的[46]。而对于其他的研究,如果想获得更多的信息,则采用Smart-seq2全长模式比较合适,可以加深测序深度以便得到如非编码RNA和可变剪接(alternative Splice,AS)等更多的生物信息。
2.3 Smart-seq2与10×Genomics的比较
在众多方法中10×Genomics推出的ChromiumTM—Single Cell 3’ Solution和Smart-seq2这两种方法常常较多应用于实际研究中。Smart-seq2是经Smart-seq改良的一种测序方案,与Smart-seq相比使用了锁核酸(locked nucleic acid,LNA)、更高浓度的MgCl2以及甜菜碱[47-48]。而10×Genomics商业测序平台的测序流程主要基于微流控液滴技术(microfluidic droplet)[49-52],与Smart-seq有相似的分子生物学原理,运用了模板转换技术,但与Smart-seq的细胞捕获和通量不同。对于这两种方法的差异,Wang等[53]对两者的优缺点进行了详细的比较,他认为Smart-seq2由于成本更低,可以检测的样本范围更广,所以更适合于分析大量细胞;同时,由于其原理的组分更为公开,可以让研究人员对其进一步进行改良;且由于单细胞检测到的转录本更多,能挖掘出转录本更深的信息。但其不能分析非poly(A)的RNA且测序reads不带有mRNA链特异性。10×Genomics则具有操作简单便捷、细胞通量高、建库周期短、捕获效率高等优点,但是该技术只能获得3′端转录本信息且对样本要求高[54-58]。Kashima等[59]的研究也做出了详细比较(表3)。这些研究成果为今后研究者进行合适方法的选择提供了明确且详细的参考依据。

表3 Smart-seq2与10×Genomics的差异比较(修改来自文献[59])
3 单细胞转录组测序技术在动物繁殖中的应用
单细胞转录组测序技术如今广泛应用于动物繁殖领域的相关研究中。该技术以不同种类的单个细胞为单位,达到了高分辨率的生物分子观测水平,直观反映出所要解答的相关科学问题,例如:通过主成分分析和细胞聚类技术对不同器官的单细胞图谱进行绘制,进而达到对不同细胞类型的鉴定以及未知细胞发掘的目的;通过单细胞与多组学的联合使用以期达到对某些关键基因筛选、差异基因比较的目的。最后通过验证技术(bulkRNA-seq、qPCR、FISH、免疫荧光等)的结合验证,解析不同动物繁殖的相关科学问题(表4)。

表4 单细胞转录组测序技术在不同动物的应用
3.1 非模式动物细胞类型的鉴定
3.1.1 细胞类型的鉴定方法 通过单细胞转录组测序技术对非模式动物在不同繁殖阶段的生殖细胞进行鉴定是动物繁殖领域中最常见且重要的一种应用。一种鉴定方法是基于标记基因的比对,即通过观察某个细胞类群的差异基因与数据库(CellMarker、Mouse Cell Atlas、PanglaoDB等)[60]中哪种细胞类型的差异基因相一致程度更高,结合其定量表达以完成对细胞类型的鉴别判定。另外一种鉴定方法是基于表达谱的比对,即比较未知类型细胞与已知类型细胞的表达谱相关性,通过比较相关性程度来达到鉴定的目的[61]。与之前仅仅通过细胞形态、位置及有特定蛋白的基因表达模式进行鉴定的方法相比,单细胞转录组测序的方法具有更为系统且准确的数据指标,可以更为全面、精确的区分不同种类的细胞[62]。同时也进一步提高了鉴定的灵敏度,这使得一些相似的细胞类型也可以通过有效的方法进行区分和鉴定。
3.1.2 单细胞转录组测序技术在精子和卵子发生中的应用 雄性动物的精子发生是动物繁殖的关键过程之一,包括曲精细管上皮的精原细胞经过精母细胞到精子细胞的增殖发育过程和精子形成过程[63]。这一过程基于生殖细胞和体细胞之间复杂的互作效应,因此往往会同时出现多种生殖细胞和体细胞类型,即出现较为复杂的细胞异质性。这种异质性使得在不同发育阶段很难精准剖析辨别不同类型细胞,而通过单细胞测序技术却可以清晰、准确的鉴定出睾丸中不同细胞的不同类型,同时也可以根据具体的研究目的,更进一步对不同细胞类型进行更详细的聚类分析。Green等[64]从成年小鼠睾丸中收集了3.5万个细胞进行单细胞转录组测序,鉴定了所有已知的生殖细胞和体细胞以及两个未确定过的体细胞类型。重点分析划定了精原细胞的4个类群和支持细胞的9个类群,后者与组织学上确定的生精上皮周期的发育阶段有关。这一发现为研究生殖细胞发育和体内配子发生提供了全面的知识基础。高源[65]通过采集性成熟前后两个阶段安格斯公牛睾丸的细胞,利用单细胞转录组测序鉴定了12 个细胞类群(9种体细胞和3种生殖细胞)。又通过聚类分析重点将睾丸生殖细胞划定为13个类群,与后续特异基因的表达研究相结合,详细解析了牛睾丸发育、精子生成等进程的相关机制。雷佩佩[66]通过采集杜洛克公猪睾丸中的细胞,利用单细胞转录组测序鉴定了 20 个细胞类群,并通过特定基因将其分为 6 个大的细胞类群和一个未确定过的细胞类群,这一发现详细剖析了细胞类型与猪睾丸发育间的相关性。
卵细胞的形成也是动物繁殖的关键过程之一。对于雌性动物而言,卵细胞的生成依赖于卵母细胞减数分裂的相关过程。He等[67]对小鼠新生卵巢单个生殖细胞进行了单细胞转录组测序,对3种细胞状态(生殖细胞囊肿、囊肿破裂、卵泡)的3个细胞类群进行了分类,为后续鉴定一系列卵泡形成和发育相关基因和分子通路起到了关键作用。综上所述,通过单细胞转录组测序技术可以对精子发生和卵细胞形成等过程中各类细胞的异质性进行更为灵敏的捕获,进而精准鉴定出细胞类型,从而使得研究者可以更为精确的解读动物不同生殖阶段与各类细胞间的关系。另外,从细胞角度入手,可以对动物繁殖机制进行更多元化的研究。
3.2 关键基因的研究
在动物繁殖动态进程中,不同类型细胞进行动态发育与分化。当其从当前状态转变为另一种状态时,相应基因的表达也随之改变,转录组进行重组进而出现基因激活或沉默。通过单细胞转录组测序的拟时序分析(pseudotime),可以对单细胞进行排序,利用可视化程序和注释工具构建细胞轨迹,进而将细胞的动态变化过程进行清晰的展现。在这样的结果中一般出现数个分支点,这些分支节点的发生代表着细胞产生了程序性变化,如细胞命运分化。因此,可以对分支事件进行分析,对关键基因实现筛选的目的。单细胞转录组测序也提供了不同细胞类型之间基因的差异表达数据[68]。因此,针对不同细胞类型的差异基因进行富集分析(GO、KEGG、Reactome、GSEA、GSVA等[69-74]),可以更好的了解每种细胞类型参与的生物学功能,比较不同细胞类型的信号通路差异,揭示生物学过程中的关键分子机制。
对于雄性动物睾丸中的细胞而言,通过对其特异性基因进行筛选,可以更加准确的对细胞参与的相关进程机制进行解读,同时也可以更好的把握细胞发育的阶段和其动态性变化。Yang等[75]分析鉴定了绵羊生殖细胞的几个阶段特异性标记基因,如EZH2、SOX18、SCP2、PCNA和PRKCD等。这一发现对绵羊精子发生和生精细胞发育提供了新的见解。Sun等[76]筛选出胚胎干细胞(embryonic stem cells,ESCs)、性腺原始生殖细胞(gonad primordial germ cells,gPGCs)和精原干细胞可变剪切中的阶段特异性基因NANOG、POU5F3、LIN28B、BMP4、STRA8和LHX9等,这一发现全面深入的解读了鸡生殖细胞可变剪切事件的机制。Yu等[77]的研究筛选出精原细胞在精子发生过程中的特异性候选标记基因为TKTL1和AES。同样Zhang等[78]的研究也在4个不同的精原细胞亚群中鉴定了CD99和PODXL2分别作为未分化和分化精原细胞新的细胞表面标记物。这一发现为猪的精子发生提供了有价值的信息,同时也为鉴定参与雄性生殖细胞发育的关键分子标记奠定了基础。
对于雌性动物的卵母细胞而言,处于不同发育阶段或不同环境条件下,其相关基因会出现差异性表达,对此进行分析可以从根本上探究卵母细胞出现变化的相关机制和具体原因。Li等[79]的研究中对驴卵母细胞进行单细胞转录组测序,鉴定了24 164个卵母细胞基因,其中9 073个在GV期和MII期卵母细胞中显著差异表达;进一步的GO 和 KEGG富集分析表明,这些基因与减数分裂细胞周期、线粒体活性和N-聚糖生物合成相关,可能是影响驴卵母细胞成熟的关键基因和调控机制。这一发现解释了驴GV期和 MII期卵母细胞的基因表达模式以及影响驴卵母细胞成熟的调节机制。Ruihuan等[80]通过单细胞转录组测序发现,当小鼠卵母细胞经过玻璃化冷冻、解冻后,经过体外受精形成的MII期胚胎中有1 575个基因发生了显著的变化。最显著改变的生物学途径是氧化还原这一过程,这种转录组学的改变与MII期卵母细胞特异性组蛋白H1FOO基因的水平下降有关,该研究从分子水平对卵母细胞玻璃化冷冻如何影响后续小鼠植入前胚胎发育进行了探究。
当卵母细胞、精原细胞通过减数分裂、有丝分裂等过程发育成卵细胞和精子并结合为受精卵后,对受精卵发育至胚胎过程中相关基因表达差异性的研究也能让研究者更为深入的探究和解读动物繁殖进程的机制。李田田等[81]的研究利用单细胞转录组测序技术对处于早期(16~22 h)和晚期(26~32 h)的猪卵裂胚胎进行测序,富集分析筛选出了有关胚胎发育能力的相关基因,这一发现深入挖掘了卵裂时期与胚胎发育的关联性关键信息。
4 总结和展望
动物繁殖过程包括多种错综复杂且动态变化的机制,传统的转录组测序技术仅仅从基因和表型层面对其进行分析,不能进行动态分析。但是单细胞转录组测序技术可以聚焦于单个细胞,更加直观的将细胞与相关基因进行联系,捕获之前研究缺失的细胞时序性动态变化过程以及细胞间的互作效应[82-83]。研究人员将这一技术应用到动物繁殖过程的研究中,可以从转录组角度直接对生殖细胞进行聚类,并且对相同作用的细胞进行分群得到不同的细胞簇。同时也可以获取在繁殖机制中发挥重要作用的关键基因以及相关通路。但是目前,单细胞转录组测序技术也面临着一些挑战,如测序费用昂贵,扩增的过程存在偏好,容易出现假阳性等问题[84-85]。在后续的发展中研究人员可以针对相关问题进行改进,进一步提高测序效率,增加测序准确性,降低测序费用。可以预见的是,随着单细胞转录组测序技术的发展和完善,其对于理解动物繁殖机制,提高动物繁殖力将会提供更大的帮助,发挥更重要的实质性作用。同样,在今后的研究中也可以将动物的繁殖过程作为相关模型,为人类生殖相关疾病的治疗提供参考[86-87]。也可以将单细胞转录组测序技术与其他组学分析相结合以便更全面的对生命机制进行分析解读[88-89]。

