例析有机氧化还原反应方程式的配平方法
李明亮 卜庆军
(1.山东省潍坊第一中学 2.山东省潍坊市教育科学研究院)
高中化学教材对于有机物的氧化还原反应仅做了简单介绍,未曾涉及复杂反应.近几年高考题中出现了与有机化合物有关的新型燃料电池,这就对有机物的氧化还原反应方程式配平提出了更高的要求,笔者总结出如下配平方法.
1 平均价态法
平均价态法又称平均氧化数法,这种方法主要是针对反应物和生成物组成相对简单且价态明确的氧化还原反应.具体方法是将分子式中的H、O 元素按照常见化合价规定为+1、-2价,根据代数和为0的原则求出C元素的平均化合价,再依据化合价升降总数相等配平氧化还原反应方程式.
例如,乙烯使酸性高锰酸钾溶液褪色:
先用分子式表示有机物的组成(C2H4),根据乙烯中H 元素的化合价为+1,C 元素的平均化合价为-2,生成物CO2中C 为+4价,故化合价升高12,KMnO4被还原为MnSO4化合价降了5,即系数之比为5∶12,根据原子守恒配平方程式:
2 零价法
零价法是将有机物各元素的化合价人为规定为0价,各元素的化合价变化完全由生成物中各元素的价态决定,从而计算出有机化合物得失电子的数目,进一步配平反应方程式.
有机燃料电池产物中C 元素一般为+4价,在酸性介质中C元素转换为CO2,碱性介质中一般转换为,H 元素一般变为+1价氢.
若烃的分子式为CxHy,则在燃料电池中化合价总体升高(4x+y),即1 mol CxHy可以失去(4x+y)mole-.
若是烃的含氧衍生物燃料电池,则O 元素化合价一般是由0→-2,故分子式为CxHyOz的烃的含氧衍生物,在燃料电池中化合价升高(4x+y-2z),1molCxHyOz可以失去(4x+y-2z)mole-.
肼类化合物同样也是一种常见液体火箭燃料,其燃烧产物一般为CO2、N2和H2O,依据零价法,生成物中N 元素化合价未变化,C 元素升高4价,H 元素升高1价,O 元素降低2价.分子式为CxHyOzNw肼类燃料的化合价升高(4x+y-2z).若燃料为偏二甲肼[(CH3)2NNH2],则1 mol (CH3)2NNH2失去16mole-.
依据零价法得出有机物在燃料电池中化合价升高数目(失电子数)规律:碳4氢1氧减2,生成氮气氮为0.
例(2021年山东卷,改编)以KOH 溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,判断消耗等质量燃料时,哪种燃料电池的理论放电量最大.
分析依据总结的规律,1 molCH3OH 失去6mole-,1 mol N2H4失去4 mol e-,1 mol(CH3)2NNH2失去16mole-,理论放电量与燃料的物质的量和转移的电子数有关.设消耗燃料的质量均为mg,则CH3OH、N2H4和(CH3)2NNH2放电量分别是16,通过比较可知(CH3)2NNH2理论放电量最大.
3 得失氢氧法
有机物的氧化还原反应还可以从得失氢氧的角度定义,即可以根据定义和得失H、O 原子的个数判断化合价的升高与降低.
氧化反应:失去1个H 原子对应失去1个电子,化合价升高1;得到1个O 原子对应失去2个电子,化合价升高2.
还原反应:得到1个H 原子对应得到1个电子,化合价降低1;失去1个O 原子对应得到2个电子,化合价降低2.
根据得失氢氧法,该过程中失去2个H 原子,得到2个O 原子,化合价升高6,属于氧化反应,1 mol间硝基甲苯共失去6 mole-,1 mol转换为2molCr3+,得到6mole-,其系数之比为1∶1,溶液为酸性,故配平后该方程式为
4 基团示踪标注法
部分有机反应的特点是分子中个别基团发生了改变(被氧化或者被还原),其余部分固定不变,用平均价态法或者零价法配平,计算量太大,在此种情况下可追踪反应前后发生改变的部分原子或者原子团,进而可以得出有机化合物得失电子的数目.具体方法就是将发生改变的基团整体定义为0价,然后根据电负性判断发生变化的基团中反应前后各元素的化合价的变化,判断转移电子的数目.
例如,实验室在水相中用铁粉还原硝基苯制备苯胺,Fe被氧化为Fe3O4,反应为
根据基团示踪标注法,追踪在该过程中发生变化的基团:—NO2→—NH2,依据各元素的电负性,—NO2中的O 为-2 价,N 为+4 价,产物苯胺的—NH2中H 为+1价,N 为-2价,化合价降低6,故1molC6H5—NO2得6 mole-,而Fe被氧化为Fe3O4,化合价平均升高,故苯胺与Fe的系数之比为4∶9,该反应的方程式为
5 聚合物得失电子要乘n
有机高分子聚合物在参加氧化还原反应时,由于其化学式中存在表示链节数的n,故在化合价升降过程中要乘以n,在判断其得失电子数时也要注意乘以n.例如,一种全有机质子二次电池放电原理如图1所示,电极材料中的P、PO、PR 均为有机高分子化合物.
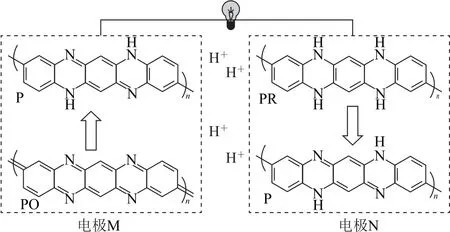
图1
根据得失氢氧法,放电时,电极M,从结构上看PO→P,得到了2n个H,其化合价降低2n,1molPO得到2nmole-,发生还原反应,为正极,电极反应式为PO+2ne-+2nH+=P;电极N,从结构上看PR→P,失去2n个H,其化合价升高2n,1 molPR 失去2nmole-,发生氧化反应,为负极,电极反应式为
综上所述,以上几种方法皆可以判断出有机物在氧化还原反应中转移的电子数,而且可以得出正确的结论,因此要具体情况具体分析.
(完)

