急性缺血性卒中溶栓药物的研究进展 Δ
孔维麟 ,杨清武 (1.陆军军医大学第二附属医院神经内科,重庆 400037;.重庆脑与智能科学中心广阳湾实验室,重庆 400064)
我国正面临着全球最严峻的卒中挑战。最新发布的《中国卒中报告2020(中文版)》结果显示,卒中是2019年我国伤残调整生命年的首要原因,位于我国城乡居民死亡原因的第三位[1],给我国医疗卫生和社会经济发展带来了沉重的负担,已成为当前危害国民健康的重要因素。卒中主要分为缺血性卒中和出血性卒中两种亚型,其中缺血性卒中占比高达82.6%;近30年来,尽管卒中的年龄标化发病率下降了9.3%,但缺血性卒中的年龄标化发病率却增加了34.7%,且呈现出持续上升的趋势[1]。
当前,急性缺血性卒中(acute ischemic stroke,AIS)的治疗方法主要为静脉溶栓或静脉溶栓联合血管内治疗。由于血管内治疗能够快速开通闭塞血管,有效恢复脑梗死区域血流再灌注,已成为急性大血管闭塞性卒中的主要治疗方法[2]。但鉴于只有不足15%的AIS患者符合血管内治疗要求[3],且术中及术后的诸多因素(如机械取栓方式、取栓次数、血栓性质、侧支循环状态等)会造成栓子逃逸或者开通血管再闭塞,加之血管内治疗对医疗机构条件设备及医师技术要求也较高,因此血管内治疗仍有许多亟待解决的难题。相比之下,在治疗允许的时间窗内,静脉团注或滴注溶栓药物能快速溶解血栓,同时由于溶栓药物具有适用范围广、治疗便捷、发挥作用迅速、治疗费用相对较低等优势,已成为我国各级医疗机构治疗AIS的主要方法[2]。基于此,本研究从溶栓药物的作用原理及分类运用等方面进行综述,以期为AIS的优化治疗提供参考。
1 溶栓药物的作用原理
人体血液系统能够维持机体正常功能主要依赖于凝血系统和纤维蛋白溶解系统的动态平衡。凝血系统通过多种凝血因子作用于纤维蛋白,与激活的血小板等细胞形成血栓;纤维蛋白溶解系统是纤维蛋白溶酶原(以下简称“纤溶酶原”)激活剂将非活性纤溶酶原转化为活性纤溶酶,进而分解纤维蛋白的系统。在血栓溶解过程中,溶栓药物通过与血栓结合形成复合物,继而激活纤溶酶原转化为活性纤溶酶,最终发挥溶栓作用[4―5]。在纤溶酶降解纤维蛋白的过程中,溶栓药物可受纤溶酶原激活物抑制剂1(plasminogen activator inhibitor 1,PAI-1)和α2抗纤溶酶的影响,从而降低溶栓效能。溶栓药物作用机制见图1[6―7]。
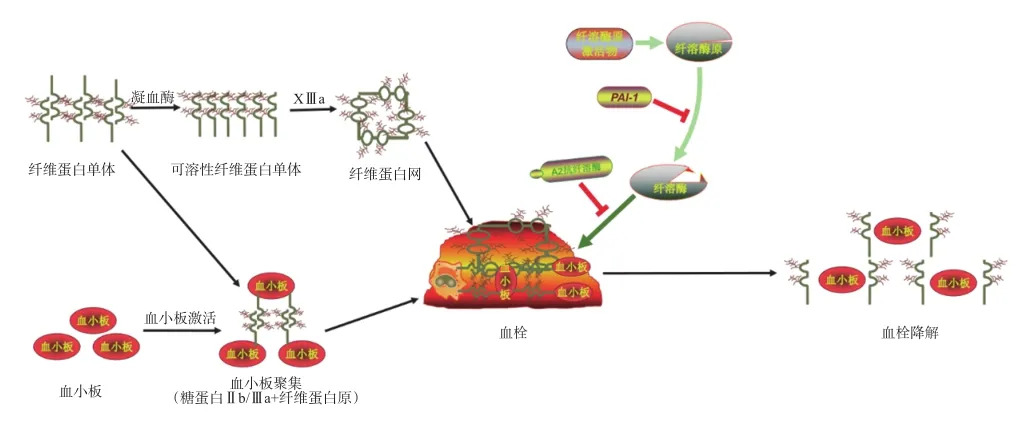
图1 溶栓药物作用机制
2 溶栓药物的分类及研究现状
溶栓药物的疗效受其特性影响,主要包括:(1)特异的血栓纤维蛋白选择性;(2)免疫原性;(3)药物半衰期;(4)对PAI-1抵抗性;(5)再通率、复发率、出血率;(6)对血脑屏障通透性以及脂质代谢的影响。按照溶栓药物的上述特性,有学者将溶栓药物分为第一代、第二代、第三代溶栓药物和其他溶栓药物[8]。
2.1 第一代溶栓药物
第一代溶栓药物主要是非特异性纤溶酶原激活剂,对溶解纤维蛋白不会产生直接影响,代表药物有链激酶(streptokinase,SK)、尿激酶(urokinase,UK),但两者的作用机制并不完全一致。
2.1.1 SK SK是1933年Tillet团队在β溶血性链球菌中提取得到的一种非蛋白酶外源性纤溶酶原激活剂,属于非酶单链糖蛋白[9]。SK通过与纤溶酶原形成复合物来间接活化纤溶酶原,从而生成活性纤溶酶,最终发挥溶栓作用[10]。该药于1954年进入临床,主要用于急性心肌梗死和AIS的溶栓治疗。作为第一个用于临床的溶栓药物,尽管SK的溶栓效果较佳、价格低廉,但由于其出血发生率较高(10%),且具有免疫原性,会引起药物抵抗性,而引发发热和其他变态反应[11],这限制了该药在临床的应用。
2.1.2 UK UK是1947年Macfarlane和Pilling首次在人体尿液中发现的一种具有激酶活性的丝氨酸蛋白酶[12]。UK不仅可以直接活化纤溶酶原,将其转化为纤溶酶,还可以增强血管腺嘌呤二核苷酸磷酸酶活性,能迅速、有效地溶解血栓,抑制血小板聚集[13]。UK具有较强的溶栓能力(血栓溶解率达83%),溶栓时间窗稍长(6 h),且无免疫原性,价格低廉,是目前我国常用的溶栓药物,临床常用剂量为100~150万单位[14]。UK作为第一代溶栓药物,同样具有缺乏溶栓特异性、对溶解陈旧血栓无效、易导致出血等缺点。
2.2 第二代溶栓药物
第二代溶栓药物是一种组织型纤溶酶原激活剂(tissue-type plasminogen activator,t-PA),属于丝氨酸蛋白酶,代表药物为阿替普酶(alteplase,rt-PA)[15]。rt-PA于1987年由美国FDA批准上市,该药能选择性激活纤溶酶原,无免疫原性,能高效、特异性地溶解血栓,不易发生系统性纤维蛋白溶解,且出血风险较低,是目前临床应用最广泛、效果最理想的溶栓药物。
1995年美国国立神经系统疾病与卒中研究所(National Institute of Neurological Disease and Stroke,NINDS)开展的rt-PA(以下简称“NINDS rt-PA”)研究证实了rt-PA(0.9 mg/kg,负荷剂量90 mg)用于发病3 h内AIS的安全性和有效性,奠定了rt-PA在AIS治疗中的地位[16]。基于NINDS rt-PA研究结果,1996年美国FDA正式批准rt-PA用于发病3 h内AIS患者的静脉溶栓[17]。2008年欧洲急性卒中研究(European Cooperative Acute Stroke Study,ECASS Ⅲ)成功将rt-PA的静脉溶栓时间窗延长至发病4.5 h[18]。2012年第3次国际卒中试验(the Third International Stroke Trial,IST-3)尝试将rt-PA的静脉溶栓时间窗延长至发病6 h,尽管90 d随访结束时能获益,但由于增加了7 d内的患者死亡率而宣告失败[19]。2019年Ma等[20]研究结果证实,发病4.5~9 h的AIS患者在多模态影像学指导下,rt-PA(0.9 mg/kg)能够显著增加患者改良Rankin量表评分0~1分的比例。
基于对亚洲人群AIS病因学分型、出血风险和经济成本等方面的考虑,有学者认为低剂量rt-PA可能是一种更适合亚洲患者的治疗方法[21]。2006年以来的3项随机对照试验(randomized controlled trial,RCT)证实了低剂量(0.6 mg/kg)rt-PA静脉溶栓的临床疗效非劣于标准剂量(0.9 mg/kg)[22―24]。基于上述研究结果,日本卒中学会2019年发布了《静脉溶栓治疗指南(第三版)》,推荐0.6 mg/kg rt-PA用于AIS的溶栓治疗[25]。澳大利亚Anderson团队也针对亚洲患者开展的研究发现,在AIS患者90 d功能结局改变方面,低剂量(0.6 mg/kg)rt-PA不仅疗效非劣于标准剂量(0.9 mg/kg),而且还能降低脑出血的发生率[26]。中国学者也开展了低剂量(0.6 mg/kg)rt-PA治疗AIS的研究,由于样本量有限,其安全性和有效性结论存在争议[27―28]。因此对于中国AIS溶栓治疗使用的rt-PA剂量,仍亟待大样本的前瞻性RCT进一步探讨。
尽管rt-PA已作为目前急性缺血性卒中一线治疗药物,但仍有以下缺点:(1)能够被PAI-1影响,从而快速失去酶活性;(2)半衰期较短(4~5 min),单次治疗用量较大,且需持续输注;(3)主要是结合在纤维蛋白表面发挥溶栓作用,穿透血栓的能力有限,容易延迟血流再通,而增加开通血管再闭的风险;(4)会激活基质金属蛋白酶,进而破坏血脑屏障,引发脑出血和脑水肿;(5)价格昂贵。
2.3 第三代溶栓药物
运用现代分子生物学和生物化学技术对第一、二代溶栓药物结构进行改进后得到的第三代溶栓药物,既保留了直接活化纤溶酶原的特性,还增强了纤维蛋白特异性及溶栓效果,延长了半衰期,但有效时间窗和使用剂量尚需进一步证实。第三代溶栓药物的主要代表药物有替奈普酶(tenecteplase,TNK)、去氨普酶(desmoteplase,bat-PA)、瑞替普酶(reteplase,rPA)等,目前TNK备受各国学者的青睐,已成为AIS治疗中的重要替代药物。
TNK是rt-PA经多个位点突变和结构改造后形成的,具有更长的半衰期(11~20 min)、更高的纤维蛋白特异性、更低的组织清除率及更强的血栓基质穿透力和抗纤溶酶原激活物(plasminogen activator,PA)抑制能力[29]。TNK于2000年被美国FDA批准作为溶栓药物用于临床。多项研究显示,在AIS的溶栓治疗中,TNK与rt-PA的安全性和有效性比较差异均无统计学意义[30―33]。此外,TNK的价格适中,临床给药便捷,与rt-PA长达1 h的给药时间相比,TNK可在10 s内团注[31],且无须开通和管理额外的静脉通路。TNK的这些优点将使其成为具有前景的新的一线溶栓治疗药物,可能让更多的AIS患者获益。
既往动物实验研究已经证实了TNK良好的溶栓能力,TNK具有比rt-PA更强的血栓溶解效率,更快的闭塞血管开通能力和更低的梗死出血转化率[34―36]。前期多项临床研究证实,TNK组患者的死亡率和症状性颅内出血发生率均与rt-PA组相当,但TNK组患者的非脑出血发生率更低[29,37―38]。目前正在开展的多项RCT初步研究结果也显示,TNK在AIS治疗中具有更多获益的趋势(表1)。2021年多国学者针对TNK治疗AIS进行了全面的分析讨论,也初步认定了TNK在AIS治疗中的优势,随之也启动多项RCT进一步探讨TNK在AIS治疗中的疗效,这将为TNK用于AIS治疗提供更多依据(表1)。
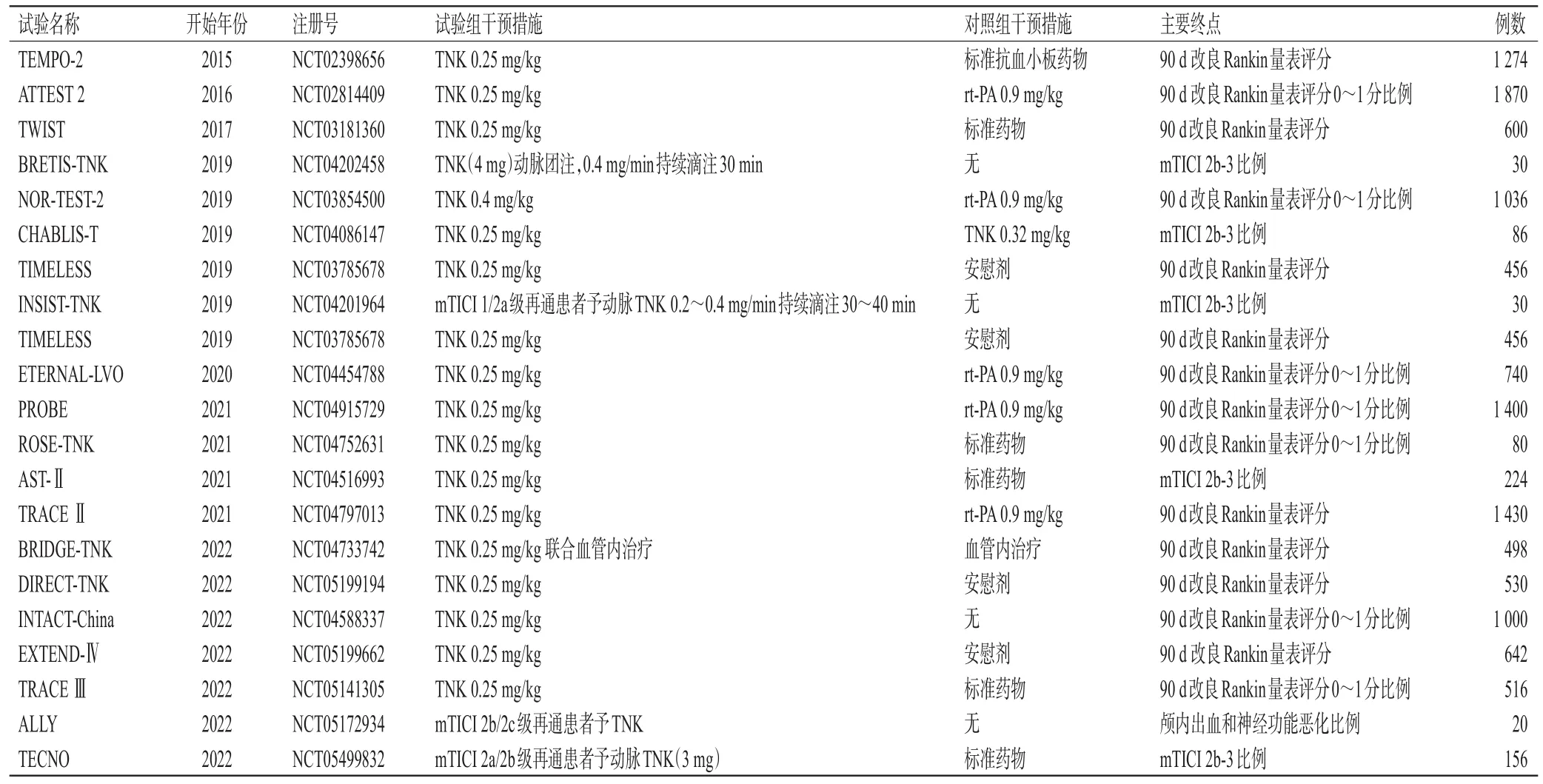
表1 正在和计划启动的TNK临床试验
2.4 其他溶栓药物
前期研究表明,PAI-1与AIS的发病和进展相关,rt-PA等溶栓药物能够被PAI-1影响,快速失去纤溶酶活性,从而降低溶栓效能[38―39]。因此寻找具有PA抑制作用的小分子化合物或者改造具有较强体内抗PA抑制活性的溶栓药物是溶栓药物研究的热点。有学者认为,PAI-1具有较强的体内抗PA活性,可开发成为第四代溶栓药物[40]。PAI-1通过与PA特异性结合来降低血浆中PA活性,减弱PA和rt-PA的结合能力,从而增加血浆中rt-PA浓度,提高rt-PA活性,抑制血小板活化和血栓聚集,达到溶栓的目的[41]。近年来,我国学者设计并构建了一种新的rt-PA突变体(A146Y,即rt-PA结构的第146位Ala被Tyr替代),其不仅具有较强的纤溶酶活性,还能够逃逸PA抑制,极大地提高了体内纤溶酶活性[42]。此外,有学者还发现了一种长效的PAI-1[PAItrap(H37R)-HAS],其能够有效抑制外源性或内源性PAI-1,促进人血浆纤维蛋白溶解,减少纤维蛋白生成[43]。
从微生物或者天然植物中寻找新型的具有溶栓作用的小分子物质也是PAI-1研究的方向。Friederich等[44]从海洋微生物中提取的小分子XR5118,通过对其XR334结构进行修饰后,得到了具有溶栓作用的小分子物质,目前已在临床进行试验。我国也有学者从天然小分子化合物中发现左旋紫草素和竹节香附素A能通过显著抑制PA活性来发挥溶栓的作用,这为以PAI-1为靶点的新型溶栓药物研发提供了新的方向[45]。
3 展望
尽管血管内治疗在AIS的适用范围逐渐扩大,但静脉溶栓依旧是目前治疗AIS的主要方法。基于我国基本国情,各级医疗机构,特别是基层医疗机构在治疗AIS时,静脉溶栓药物依然发挥着不可替代的作用。继续深入开展静脉溶栓药物研究,对世界各国,尤其是发展中国家具有现实意义。作为第三代静脉溶栓药物的代表,TNK便捷的给药方式以及优越的药理学特性使其成为前景广阔的一线溶栓药物。期待在影像学和其他相关学科发展的基础上,未来有更多的研究能为TNK在AIS治疗的广泛应用提供更高级别的证据。

