脂质体药物递送系统研究进展及临床应用 Δ
谷文睿 ,杨雅 ,马欢 ,夏培元 (.陆军军医大学第一附属医院药学部,重庆 400038; .重庆医科大学附属儿童医院药学部,重庆 40005)
脂质体(liposome)作为一种人工制备的药物递送系统,是将有效成分包封在类脂质双分子层内形成的微型球状载体。该类制剂可使药物有效聚集于病变部位,避免了药物循环过程中经代谢失去活性。相比传统药物制剂,脂质体制剂具有高效、低毒和靶向等特点。近年来全球脂质体市场飞速发展,脂质体药物种类和销售额不断增加,迄今有超过20种脂质体药物获批上市,全球销售额在2021年已超过30亿美元[1]。在国家政策支持和技术创新突破的推动下,脂质体制剂已成为国内外新型药物制剂的研究热点。鉴于此,本文对脂质体的制备方法、分类及临床应用进行综述,旨在为脂质体制剂的临床合理使用和新药开发提供参考。
1 脂质体的制备方法
1.1 传统制备方法
脂质体的传统制备方法包括薄膜水合法、乙醇/乙醚注入法、反相蒸发法、微流控通道法、膜挤压法等。虽然传统制备方法操作简单,但是也存在包封率低、粒径差异大以及有机溶剂残留等缺点。因此,该方法目前主要局限用于性质稳定药物的实验室小规模生产,难以实现工业化生产[2]。
1.2 新型制备方法
为了改善脂质体传统制备方法的上述缺点,学者们经过创新改进,开发出较为成熟的新型制备方法,包括超临界流体法(supercritical fluid methods,SCF)、冷冻干燥法、双不对称离心法等。其中,SCF系将药物溶解于超临界流体中,通过降低压力使溶液过饱和,药物析出形成均匀微粒的方法。CO2具有较低的临界温度和临界压力,且无毒、价廉,是SCF最常用的气体[3]。根据制备过程及应用方向的不同,SCF又可分为超临界反溶剂法,以及在该方法基础上开发出来的连续反溶剂法、超临界CO2反相蒸发法、超临界溶液的快速膨胀法、膨胀液体有机溶液降压法等。吴宏华等[4]利用优化的超临界流体强化溶液快速分散技术制备冬凌草甲素脂质体口服制剂,与传统有机溶剂制备方法相比,该技术制备的脂质体粒径更小,包封率、载药量及稳定性更高,可显著提高药物的体外溶出度。SCF以无毒、饱和气体代替传统制备方法的有机溶剂,产能高且无污染。此外,该方法还具有所制脂质体粒径可控、原位灭菌、支持大规模生产等优点,已逐步取代有机溶剂制备方法[5]。但该方法成本较高,需要特殊设备以维持高压环境,对其在大规模工业制备中的应用带来了不便。
2 脂质体的分类
按照制剂的配方及作用方式,脂质体可大致分为普通脂质体、环境敏感型脂质体、长循环脂质体、主动靶向脂质体、多功能脂质体等。
2.1 普通脂质体
普通脂质体仅由磷脂和胆固醇组成,进入机体后易被单核-巨噬细胞系统(mononuclear phagocyte system,MPS)吞噬。20世纪80年代即有研究发现五价锑化合物的脂质体可用于治疗利什曼原虫病等巨噬细胞系统疾病[6]。但普通脂质体在体内容易聚集并相互融合,难以保证持续稳定的释放,因此有必要对脂质体进行表面修饰,改变其在体内的药动学过程。由此新型的脂质体被陆续研发出来。
2.2 环境敏感型脂质体
环境敏感型脂质体进入机体内后,可因动态微环境的变化(如pH、酶)或通过人工控制靶组织的物理环境(如光敏、温敏、磁响应等)促使其在特定组织中释放药物。Yuba等[7]根据肿瘤组织的pH值通常低于正常人体组织这一特性,设计出一种含博来霉素的pH敏感型脂质体。该研究显示,含二硬脂酰磷脂酰乙醇胺的脂质体随着环境pH值的降低而释放,被肿瘤细胞吸收的速率是不含二硬脂酰磷脂酰乙醇胺脂质体的2.5倍。另外,Boratto等[8]制备的含α-生育酚琥珀酸酯的pH敏感型脂质体,可在肿瘤组织的外部基质及内体小泡的酸性环境中主动释放药物。体内试验表明,与游离的多柔比星相比,该pH敏感型脂质体能显著缩小肿瘤组织的体积,并可在一定程度上减轻心脏的毒性反应。
2.3 长循环脂质体
长循环脂质体的表面覆盖有低聚糖、糖蛋白、多糖及合成聚合物等惰性聚合物分子,可延长其在循环系统中的半衰期[9]。其中,聚乙二醇[poly(ethylene glycol),PEG]具有无毒、无免疫原性、无抗原性,且极易溶于水的优点,是常用的聚合物。Yadav等[10]制备的立体稳定脂质体是将PEG在脂质体表面交错覆盖成致密的构象云,形成较厚的立体位阻,降低其与MPS的亲和力。PEG多柔比星脂质体Doxil®与游离的多柔比星相比,在体内循环时间延长3倍,在肿瘤组织中的药物浓度提高4~16倍,已被批准用于乳腺癌、卵巢癌等多种恶性肿瘤的治疗[11]。
2.4 主动靶向脂质体
肿瘤细胞或血管表面存在某些特异性的过表达受体,如叶酸受体、人表皮生长因子受体2、转铁蛋白受体等,这些受体通常与肿瘤的生长和增殖密切相关。以肿瘤组织高表达受体为靶点,设计由对应配体修饰的脂质体,使之成为靶向肿瘤组织的纳米载体,通过与选择性的细胞结合或受体介导的内吞过程实现药物在肿瘤细胞聚集[12]。主动靶向脂质体又分为抗体靶向配体修饰和非抗体靶向修饰两类。前者比如Rodallec等[13]使用曲妥珠单抗对包封有多西他赛的PEG化脂质体表面进行修饰,在人乳腺癌模型上表现出更强的抗增殖活性和更好的稳定性。后者则以叶酸为非抗体靶向修饰的典型代表。因叶酸受体在卵巢癌、子宫内膜癌、骨肉瘤等肿瘤细胞中过表达,利用叶酸作为配体修饰脂质体,能够主动靶向肿瘤细胞[14]。事实上,只要获得特定肿瘤细胞上特定的配体,并进行修饰,就能获得靶向具体肿瘤部位的脂质体。目前,研究最多的靶向性基因载体是肝靶向性载体[15]。赵娜[16]将普通阳离子脂质体与载脂蛋白E偶联,得到了具有与肝癌细胞结合特异性的载脂蛋白E修饰脂质体。主动靶向型脂质体是精准治疗靶向制剂的主要发展方向,近年来已有以表皮生长因子受体、程序性死亡配体1等为靶标的长春新碱、紫杉醇、阿霉素等多个制剂进入临床试验阶段[12]。
2.5 多功能脂质体
越来越多的研究试图通过合理叠加不同的功能,使脂质体对复杂的体内环境做出更智能的反应。根据组成成分的化学性质差异,药物、基因片段、分子探针及蛋白质可通过混合、吸附或共价连接等方式装载到脂质体的不同部位。这种叠加工艺使脂质体转变为一种共载体系,可通过不同治疗药物的协同作用实现“诊疗一体化”或更好的治疗效果。多药耐药是影响肿瘤化学治疗效果的原因之一,基因治疗虽然不存在耐药问题,但起效慢、转染效率低严重限制了其在抗肿瘤治疗中的应用。而基因-药物共载体系可以利用彼此不同的治疗机制弥补相互的不足,达到协同治疗的目的[17]。目前,双载药脂质体已取得了重要的临床进展,有多种制剂正进行临床前和临床阶段研究[18],如阿糖胞苷/柔红霉素脂质体CPX-351于2017年在美国获批上市,标志着双载药脂质体已进入临床治疗应用阶段。
3 脂质体的临床应用
脂质体作为一种成熟的药物递送载体已被广泛应用于抗肿瘤、抗感染、疫苗等多种制剂的制备
3.1 抗肿瘤
抗肿瘤治疗是脂质体制剂应用最为广泛的领域。自1995年美国FDA批准多柔比星脂质体用于卡波西肉瘤、卵巢癌和乳腺癌的治疗之后,已有9种抗肿瘤治疗的脂质体制剂上市[19]。
通过将细胞毒性药物制备成脂质体制剂,使其具有被动或主动的肿瘤靶向性,可降低药物对非靶器官的毒性。目前研究的被动靶向主要有两种机制:(1)利用高渗透长滞留效应(enhanced permeability and retention effect,EPR)使药物滞留在肿瘤组织处,从而实现被动靶向的目的[20]。Li等[21]研究利用EPR将米托蒽醌制成60 nm粒径的脂质体,从而提高了药物在肿瘤组织的分布,减少了药物在肢体远端的释放,降低了手足综合征等不良反应的发生率。(2)利用纳米粒子的电荷特性诱导被动靶向。Wang等[22]制备出携带氧离子的多柔比星脂质体,通过流式细胞术分析表明,肿瘤细胞对该多柔比星脂质体的摄取量是普通脂质体的2倍,是游离多柔比星的8倍。被动靶向脂质体作为一种较为成熟的靶向技术,已成功应用于阿霉素脂质体、多柔比星脂质体、米托蒽醌脂质体等多个上市的抗肿瘤药物。
如前文所述,主动靶向脂质体利用靶向物质对脂质体进行修饰,通过选择性的细胞结合或受体介导的内吞过程实现药物在肿瘤细胞聚集。2017年在美国获批上市的全球首个主动靶向的双载药脂质体CPX-351,用于治疗继发和伴有骨髓增生异常综合征相关细胞遗传学异常的急性髓细胞白血病[23]。该制剂开创性地将阿糖胞苷和柔红霉素两种细胞毒性药物通过两种不同的装载技术封装进纳米递送载体中,同时利用脂质体表面偶联的阴离子磷脂酰甘油与白血病细胞上CD36和CD91配体结合,通过主动摄取优先进入白血病细胞,最终在细胞核内释放药物。这种释放方式,完全实现了对白血病细胞的靶向,保证疗效的同时,降低了对正常造血干细胞的细胞毒性。
3.2 抗感染
广谱抗真菌药物两性霉素B(amphotericin B,AmB)的含脂制剂是脂质体制剂研发最经典和成功的案例。AmB进入体内后部分与人体细胞结合,导致溶血、肾损伤等不良反应。而AmB含脂制剂被MPS吞噬,聚集于肝和脾,从而减少与肾小管细胞膜上胆固醇的结合,降低肾毒性。临床前研究显示,相比等剂量的游离AmB,AmB含脂制剂具有更高的血浆峰值浓度和曲线下面积,预示着AmB含脂制剂具有更高的治疗潜力[24]。目前已有3种配方的AmB含脂制剂上市,包括AmB脂质复合体、AmB胆固醇硫酸酯复合物和AmB脂质体。这3种制剂在粒径、结构、脂质成分、AmB浓度等方面有所不同,导致三者的组织分布、血浆浓度、巨噬细胞的摄取率、在感染部位的浓度都存在一定差异[25]。由于含脂制剂对人体细胞的毒性都远小于单纯AmB制剂,所以临床允许使用剂量高于单纯AmB制剂,还可应用于肾功能受损的患者。
吸入性脂质体抗菌药物是另一类近年来取得重大进展的脂质体类型。脂质体通过吞噬作用将药物沉积在肺泡的巨噬细胞内,以增强药物对胞内感染的治疗效果[26]。已获得临床应用的吸入用阿米卡星脂质体(商品名ArikayceTM)以电中性的脂质体包裹带正电的阿米卡星,从而阻止药物与带负电荷的痰液直接接触,并可穿透痰液中铜绿假单胞菌生物膜的网状结构[27]。在伴有慢性铜绿假单胞菌感染的囊性纤维化患者中进行的临床Ⅱ期研究表明,ArikayceTM治疗14~28 d后患者肺功能明显改善,临床效果明显且安全[28]。另外,纳入由鸟分枝杆菌导致的非结核分枝杆菌肺病患者的全球性Ⅲ期临床研究CONVERT显示,ArikayceTM与指南标准疗法联合用药可显著提高痰培养转阴率[29]。基于以上临床试验结果,美国FDA于2018年批准ArikayceTM用于治疗由鸟分枝杆菌导致的非结核分枝杆菌肺病成人患者。
3.3 疫苗
随着免疫学和生物工程技术的不断进步,亚单位疫苗、核酸疫苗、多糖结合疫苗等新型疫苗取得快速进展。脂质体用于构建新型疫苗佐剂递送系统,可保护疫苗中的关键成分——病原体抗原长效缓慢释放,并增强疫苗的免疫原性[30]。研究表明,某些脂质体本身就具有独特的免疫刺激功能,在特殊条件下能够诱导机体产生广谱的获得性免疫。例如,含有单磷酸脂质A成分的脂质体可触发人体辅助性T细胞1免疫反应并很少产生难以耐受的副作用,应用该技术的一些产品包括针对恶性疟原虫的Mosquirix®,以及针对带状疱疹病毒的 Shringrix®[31―32]。PDS0101是由阳离子脂质体R-DOTAP和人乳头瘤病毒多肽抗原组成的治疗性疫苗,在已结束的Ⅰ期临床试验(NCT02065973)中,该疫苗显示出较好的安全性,并达到了抗原特异性CD4+和CD8+T细胞增加的次要终点[33]。2020年以来,为应对全球公共卫生事件,各国迅速研发多种疫苗。目前,针对该公共卫生事件,全球已上市及处于临床试验阶段的疫苗已超过200种[34]。其中,mRNA疫苗属于第三代疫苗,相比减毒、灭活、重组亚单位等前代疫苗,mRNA疫苗无需细胞培养或动物源基质,合成速度快,从基因测序至生产只需要数周的时间,在疫情防控中体现出了重要作用。但mRNA的单链结构极其不稳定,且难以穿过带负电荷的细胞膜递送,所以需要经特殊的脂质体纳米颗粒包裹后递送至细胞质[35]。德国生物新技术公司与美国辉瑞公司、上海复星医药集团联合开发的COMIRANTY®疫苗由SARS-CoV-2刺突糖蛋白mRNA和外层包裹的脂质体纳米颗粒组成。该疫苗2021年8月获得美国FDA上市许可,目前已在全球超过140个国家获批使用。
我国mRNA疫苗技术虽起步较晚,但在技术追赶层面并没有落后太多,已有多个候选疫苗进入临床试验阶段。其中,艾博生物与沃森生物共同研发的mRNA疫苗AWcorna,已完成Ⅲ期临床试验(NCT04847102),并于2022年9月30日获得印度尼西亚紧急使用授权。另外,斯微生物、丽凡达生物申报的mRNA疫苗也相继进入临床试验阶段[36]。
3.4 处于临床试验阶段的脂质体制剂
近年来,国家药品监督管理局陆续出台多项政策鼓励长效、缓控释、靶向等新型制剂的发展。在国家政策激励下,国内制药企业也纷纷投入研发脂质体。目前,国内外已有多个创新或改良型脂质体制剂进入临床试验阶段(表1)。随着临床研究深入,相信将会有更多的脂质体药物获批上市,为多种疾病的治疗提供更多选择。
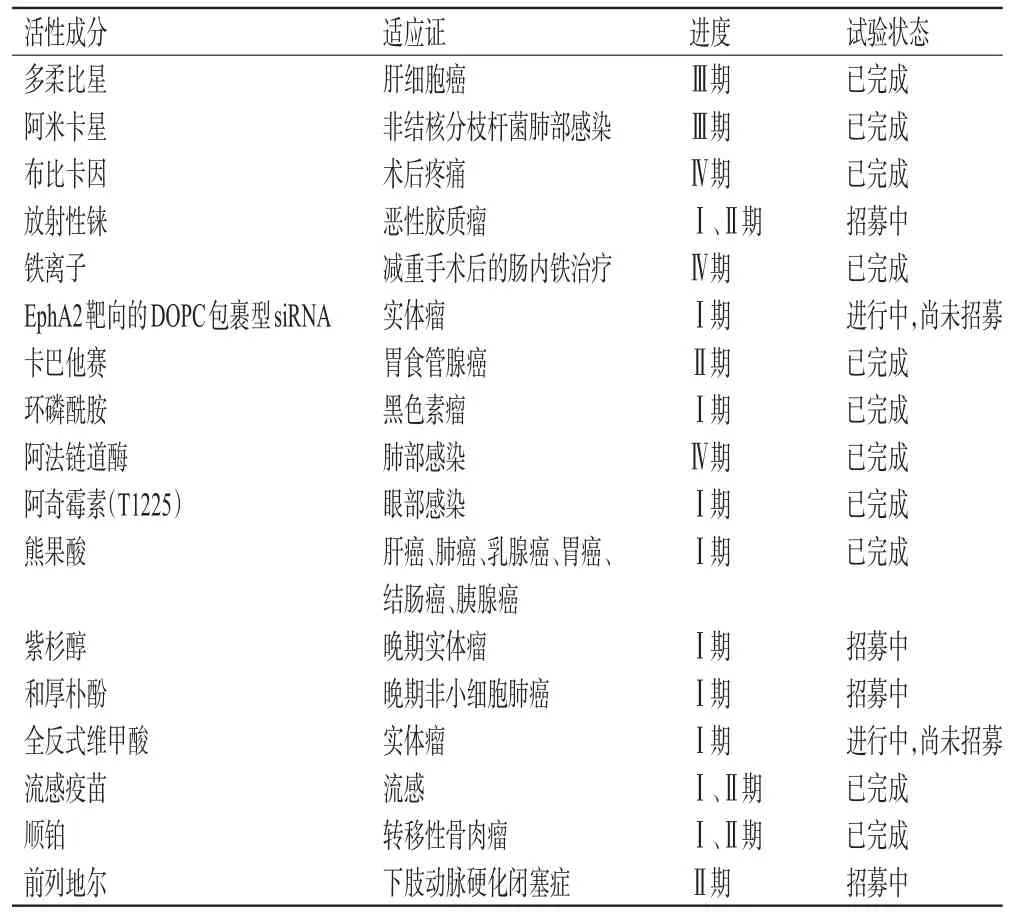
表1 2020-2022年国内外临床试验阶段的脂质体制剂
4 结语
经过60多年的研究和发展,脂质体已经从抽象的概念发展成为主流的药物递送系统之一。通过对表面进行各种功能化修饰,能够灵活可控地调整脂质体的药动学特征,使其作为药物载体具有增效、减毒、靶向、控释等诸多优点。脂质体从最初的经典模式进一步发展为长循环脂质体、环境敏感型脂质体、主动靶向脂质体、多功能脂质体等不同种类,在抗肿瘤、抗感染、疫苗等多方面具有广阔的临床应用前景。目前针对新型脂质体的研究多数还处于早期的开发阶段,距离最终成功应用于临床尚需大量研究。随着配方研发的进展和制备工艺的精进,相信越来越多的脂质体将在临床获得广泛使用,在各种疾病的诊断、治疗、预防中发挥重要作用。

